
第3章.配位场理论和配合物的电子光谱 一.d轨道在配位场中的能级分裂(电子光谱的 基础和来源) 二.过渡金属配合物的电子光谱,△大小的表征 一 电子光谱(吸收光谱,紫外可见光谱), T一S图 三.电荷迁移光谱(charge transfer,CT光谱)
第3章. 配位场理论和配合物的电子光谱 一.d 轨道在配位场中的能级分裂(电子光谱的 基础和来源) 二.过渡金属配合物的电子光谱,O大小的表征 ―电子光谱(吸收光谱,紫外可见光谱), T―S图 三.电荷迁移光谱(charge transfer,CT光谱)

一.d轨道在配位场中的能级分裂 影响分裂能的因素: 10Dg=f千igand8ion 1.配位场的强度,配体,光谱化学系列 I-<Br-<S2<SCN-<CI<NO3<F-<OH ox2-<H,0 NCS-<CH2CN<NH3 <en dipy phen NO2<PR3<CN-<CO 2.金属离子Mnt,n越大,分裂能越大
一 .d 轨道在配位场中的能级分裂 影响分裂能的因素: 10Dq=fligand g ion 1.配位场的强度,配体,光谱化学系列 I − Br− S 2− SCN− Cl− NO3 − F − OH− ox2− H2 O NCS− CH3 CN NH3 en dipy phen NO2 − PR3 CN− CO 2.金属离子M n+,n越大,分裂能越大

3.周期数越高,分裂能越大,Pt2+,Ni2+ 4.不同的配位场中: 平面四方>八面体>四面体> PtCl D4h) NiCl2 (Td) Ni (CN)2-(D4h) (6周期) (4周期) C1(弱) CN(强)
3.周期数越高,分裂能越大, Pt2+, Ni2+ 4.不同的配位场中: 平面四方八面体四面体 PtCl4 2– ( D4h) NiCl4 2– (Td) Ni(CN)4 2–(D4h) (6周期) (4周期) Cl (弱) CN–(强)

eg 十+eg 6Dq t2g 4Dq t2g d5,High spin(弱场) 八面体场△=10Dg eg 三t2 4Dq 6Dq =e t20 四面体场△三4/9△0 d5,low spin(强场
6Dq 4Dq eg t2ge t2 6Dq 4Dq 八面体场 O=10Dq 四面体场 T= 4/9 O d 5 , High spin(弱场) t2g eg eg t2g d 5 , low spin(强场)
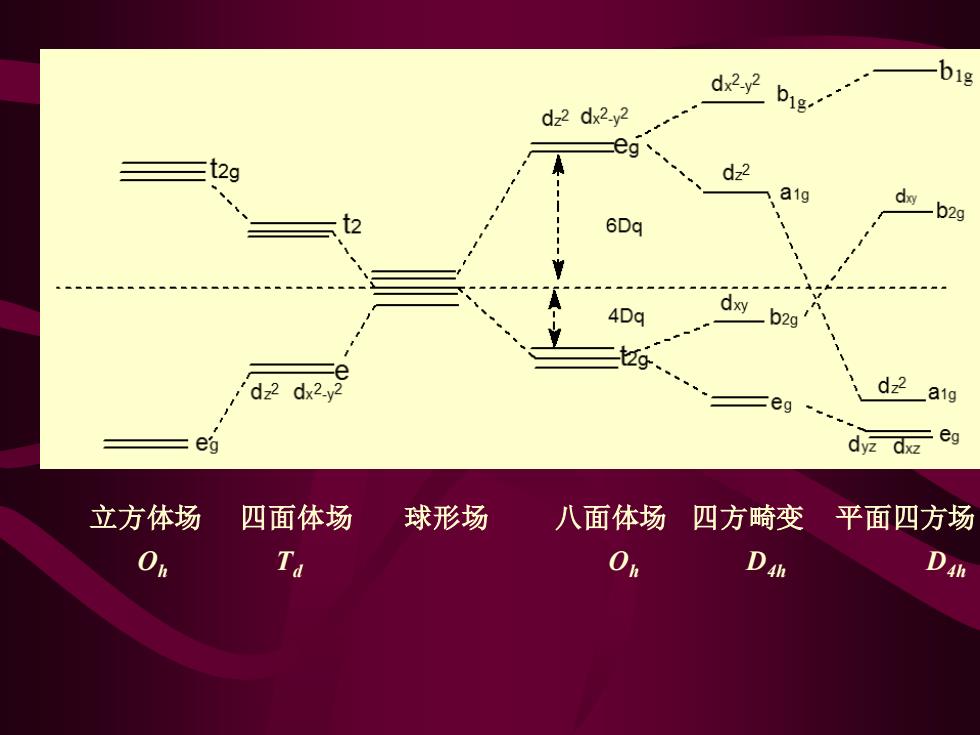
dx2y2 big 01 - dz2 dx2-y2 g eg (2g d22 a1g 6Dq 4Dq dxy b2g d22 dx2. a1g eg ea dyz dxz eg 立方体场 四面体场 球形场 八面体场四方畸变平面四方场 On Ta Dah D4
立方体场 四面体场 球形场 八面体场 四方畸变 平面四方场 Oh Td Oh D4h D4h
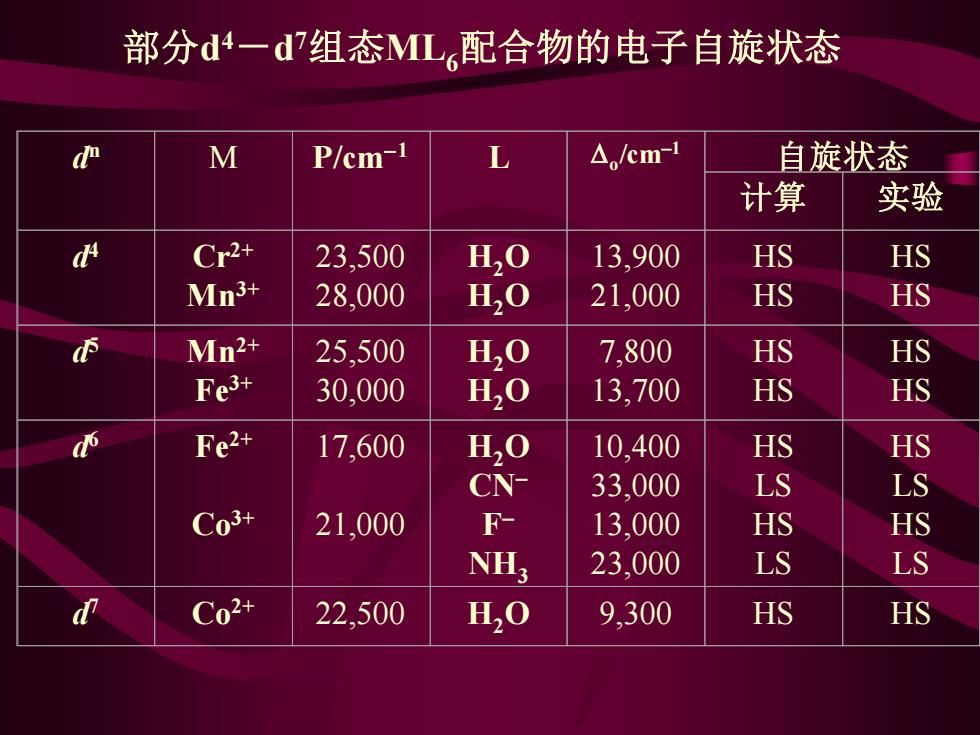
部分d4一d7组态ML配合物的电子自旋状态 % M P/cm-1 △,/cm-1 自旋状态 计算 实验 Cr2+ 23,500 H20 13,900 HS HS Mn3+ 28,000 H,O 21,000 HS HS Mn2+ 25,500 H,O 7,800 HS HS Fe3+ 30,000 H,O 13,700 HS HS Fe2+ 17,600 H,O 10,400 HS HS CN- 33,000 LS LS C03+ 21,000 F- 13,000 HS HS NH; 23,000 LS LS C02+ 22,500 H,O 9,300 HS HS
部分d 4-d 7组态ML6配合物的电子自旋状态 d n M P/cm−1 L o /cm−1 自旋状态 计算 实验 d 4 Cr2+ Mn3+ 23,500 28,000 H2O H2O 13,900 21,000 HS HS HS HS d 5 Mn2+ Fe3+ 25,500 30,000 H2O H2O 7,800 13,700 HS HS HS HS d 6 Fe2+ Co3+ 17,600 21,000 H2O CN− F − NH3 10,400 33,000 13,000 23,000 HS LS HS LS HS LS HS LS d 7 Co2+ 22,500 H2O 9,300 HS HS

二.△大小的表征一电子光谱(或电子光谱,紫 外可见光谱 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 0 excitation Cu(NH3)2+ 强场 紫色 黄色 Cu(OH2)42+ 弱场 蓝色 橙色 大小 Cr(NH3)3+ 强场 橙色 蓝色 大 Cr(OH2)63+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 △的能级范围在紫外可见区域,∴.d区元素的配合物有色
二. O大小的表征―电子光谱(或电子光谱,紫 外可见光谱) 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 O excitation Cu(NH3 )4 2+ 强场 紫色 黄色 大 Cu(OH2 )4 2+ 弱场 蓝色 橙色 小 Cr(NH3 )6 3+ 强场 橙色 蓝色 大 Cr(OH2 )6 3+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 O的能级范围在紫外可见区域,d区元素的配合物有色
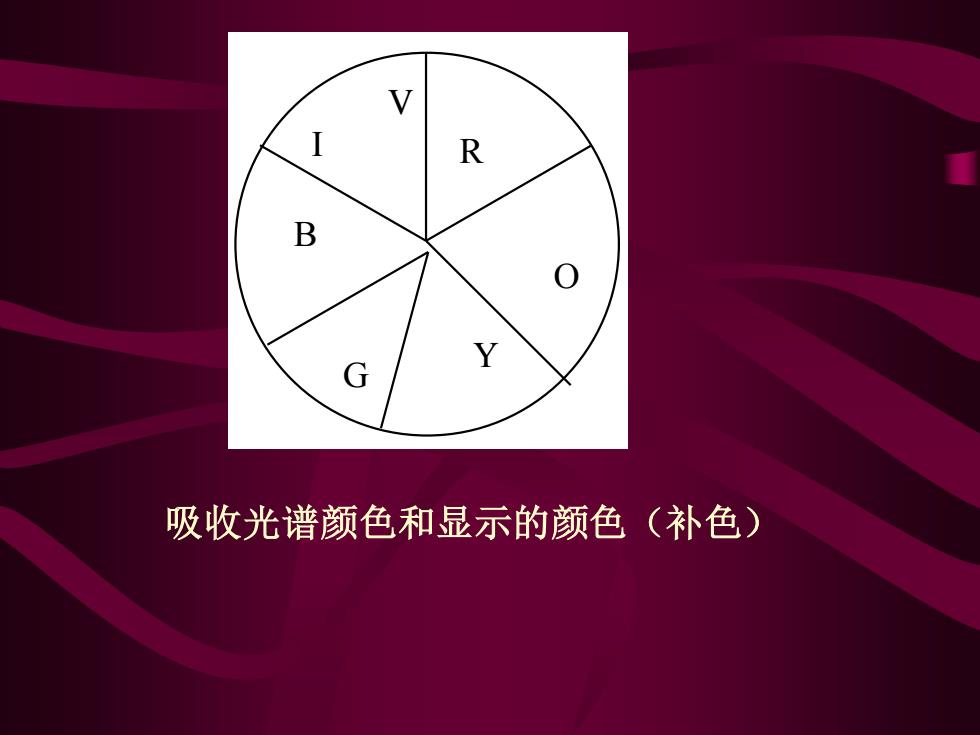
R B 吸收光谱颜色和显示的颜色(补色)
R O Y G B I V 吸收光谱颜色和显示的颜色(补色)
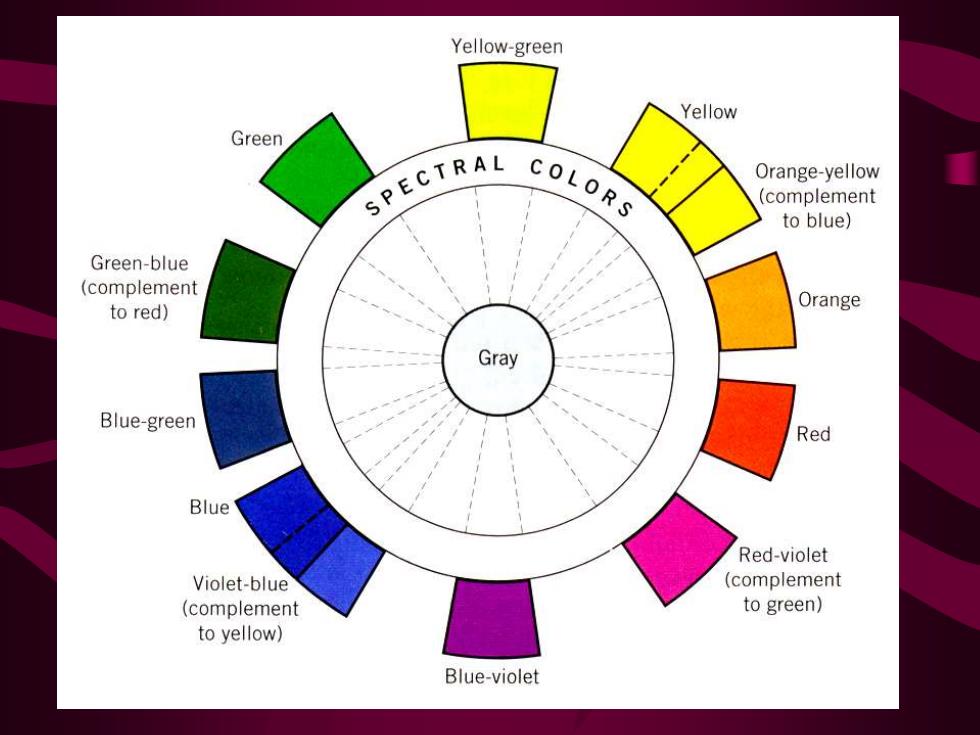
Yellow-green Yellow Green SPECTRAL COLORS Orange-yellow (complement to blue) Green-blue (complement to red) Orange Gray Blue-green Red Blue Red-violet Violet-blue (complement (complement to green) to yellow) Blue-violet
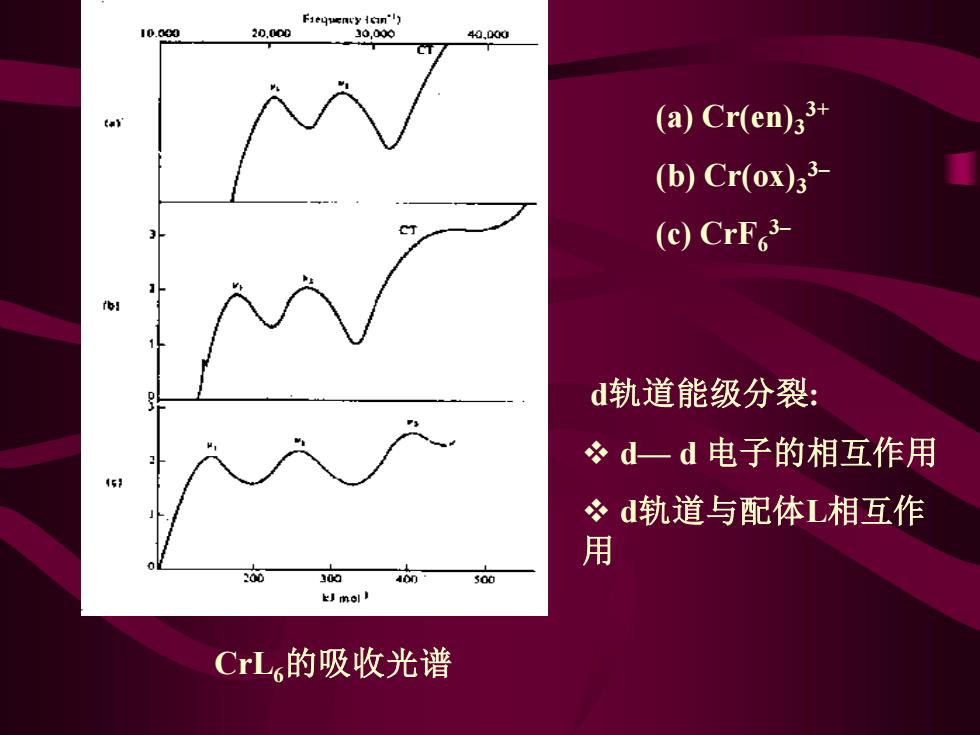
Fiequency icin') 10.040 20.000 10,000 44.000 (a)Cr(en)33+ (b)Cr(ox)33 (c)CrF3 d轨道能级分裂: 必d一d电子的相互作用 51 冬d轨道与配体L相互作 用 200 100 500 kJmol CrL,的吸收光谱
CrL6的吸收光谱 (a) Cr(en)3 3+ (b) Cr(ox)3 3– (c) CrF6 3– d轨道能级分裂: ❖ d— d 电子的相互作用 ❖ d轨道与配体L相互作 用