
无机化学总结 物理无机化学(physical inorganic chemistry) 无机化学 描述无机化学(descriptive inorganic chemistry) 化学原理:动力学,热力学,微观结构 (有后续课) 普通无机化学 元素周期系:各族元素的基本性质,重要 化合物(氧化物,卤化物,硫化物及含氧 酸盐)
无机化学总结 无机化学 物理无机化学(physical inorganic chemistry) 描述无机化学( descriptive inorganic chemistry) 普通无机化学 化学原理: 动力学, 热力学, 微观结构 (有后续课) 元素周期系:各族元素的基本性质, 重要 化合物 (氧化物, 卤化物, 硫化物及含氧 酸盐)

分子对称性和红外光谱;配位场理论和电 子光谱;配位反应机理;固体结构和X射 线粉末衍射 无机化学 中级) 配合物(复杂配体);羰基化合物;有机金 属化合物;原子簇(硼烷,羰基);固体, 生物无机 对称性原理群论) 高等无机化 学(文献阅读 功能配位化合物
无机化学 (中级) 分子对称性和红外光谱; 配位场理论和电 子光谱; 配位反应机理; 固体结构和X-射 线粉末衍射 配合物(复杂配体); 羰基化合物; 有机金 属化合物; 原子簇(硼烷, 羰基);固体, 生物无机 高等无机化 学 (文献阅读) 对称性原理(群论) 功能配位化合物

(一)1-5章 经典配位化合物(结构,反应动力学,电子光谱,配位 场理论) Mn+(高价阳离子),Lewis酸 L (阴离子),Lewis碱,配位原子:N,O,X等电负性 大的元素 单核配合物 多核配合物
(一) 1-5章 经典配位化合物(结构,反应动力学,电子光谱,配位 场理论) Mn+ (高价阳离子) ,Lewis 酸 L (阴离子),Lewis 碱,配位原子:N, O, X等电负性 大的元素 单核配合物 多核配合物
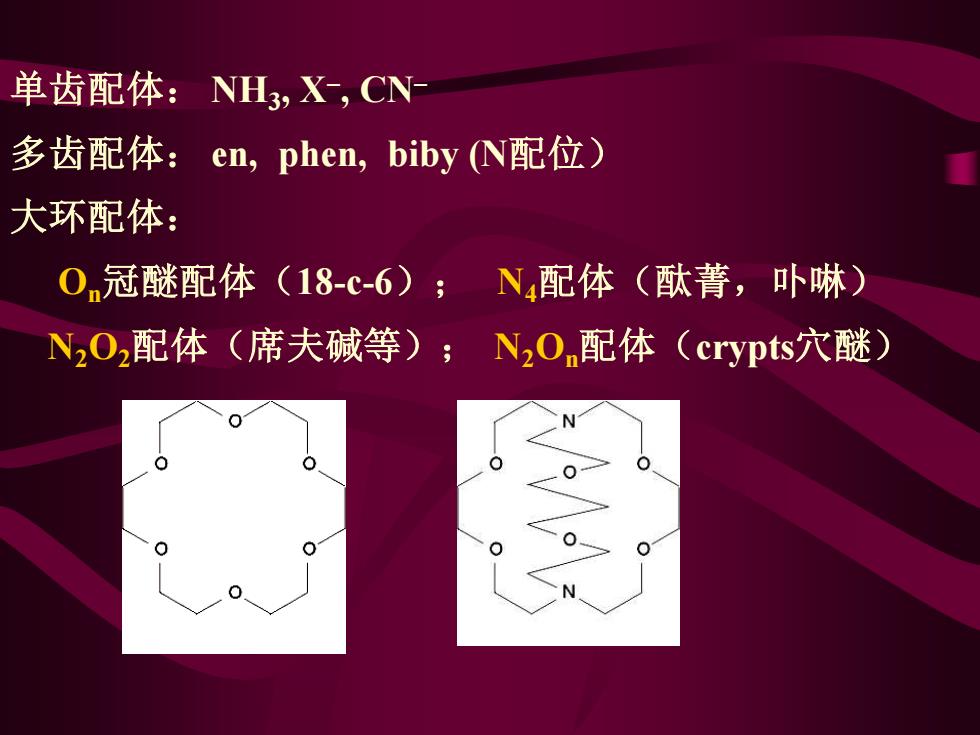
单齿配体:NH3,X,CN 多齿配体:en,phen,biby (N配位) 大环配体: On冠醚配体(18-c-6);N配体 (酞菁,卟啉) N202配体(席夫碱等);N2O配体(crypts穴醚)
单齿配体: NH3 , X– , CN– 多齿配体: en, phen, biby (N配位) 大环配体: On冠醚配体(18-c-6); N4配体(酞菁,卟啉) N2O2配体(席夫碱等); N2On配体(crypts穴醚)
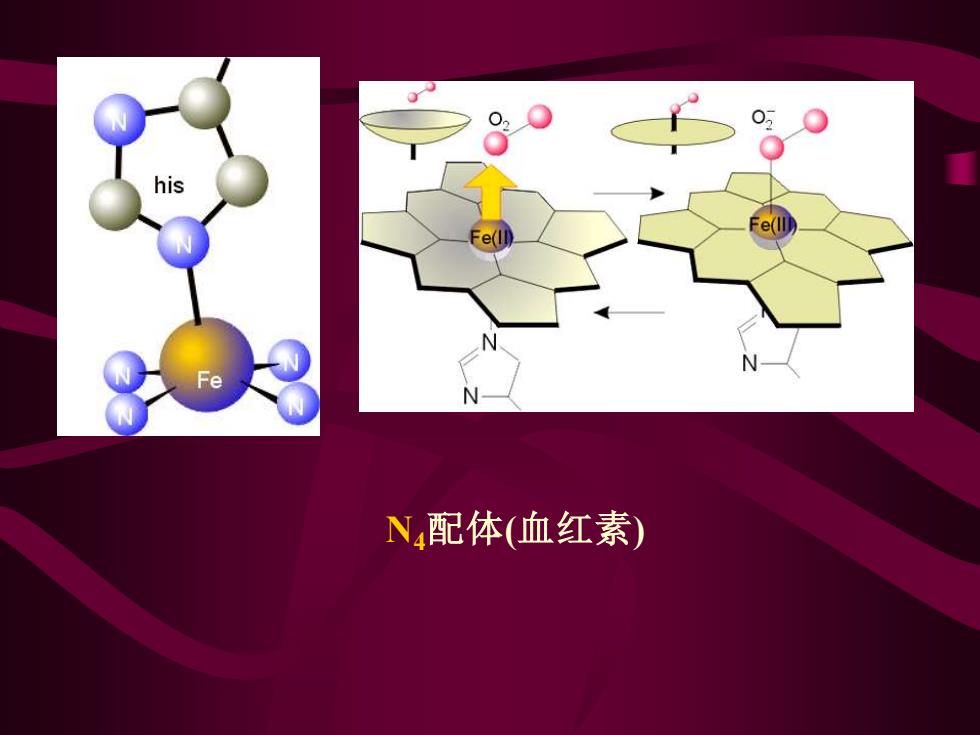
his Fe N配体(血红素)
N4配体(血红素)

(二)6-10章 有机金属化合物 EAN(18/16电子)规则 M (低价阳离子或原子),Lewis酸及反馈电子给体 (中性分子或基团), Lewis碱及反馈电子受体 (1)o键化合物 配体为烷基R或芳基•Ar 主族:Sn(CH3)4,Sn(CH3)3Cl,MgCH3CI 过渡:Mn(CO)sCH3,Ti(m5-CsHs)2(ml-C5)2 H
(二) 6-10章 有机金属化合物 EAN(18/16电子)规则 M (低价阳离子或原子) , Lewis 酸及反馈电子给体 L (中性分子或基团), Lewis 碱及反馈电子受体 (1)键化合物 配体为烷基 •R 或芳基 •Ar 主族:Sn(CH3 )4 , Sn(CH3 )3Cl, MgCH3Cl 过渡:Mn(CO)5 CH3 , Ti(5-C5H5 )2 (1-C5H5 )2 H M

(2)元酸配体配合物 ō轨道和π*轨道成键 CO(类羰基N2,NO,PR3,RNC等) (3)π配体配合物 π轨道和π*轨道成键 不饱和烃CH2=CH2(CH=CH,CsHs,C6H6)
(2) 酸配体配合物 轨道和*轨道成键 CO ( 类羰基N2 , NO, PR3 , RNC等) (3) 配体配合物 轨道和*轨道成键 不饱和烃CH2=CH2 (CHCH, C5H5 - , C6H6 )
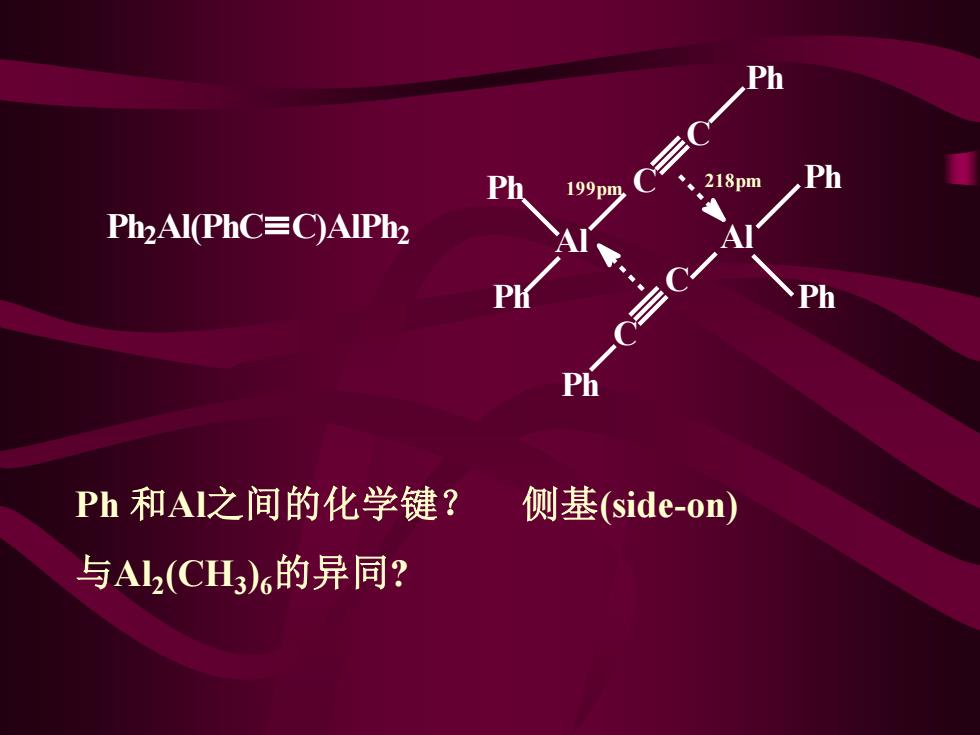
199pm 218pm Ph2Al(PhC=C)AIPh2 Ph Ph和A之间的化学键? 侧基(side-on) 与A2(CHL3)6的异同?
Al Ph Ph Ph Ph Al C C Ph C C Ph Ph2 Al(PhC )AlPh2 Ph 和Al之间的化学键? 侧基(side-on) 与Al2 (CH3 )6的异同? 199pm 218pm Ph2 Al(PhC C)AlPh2

IrCI(CO)PPh3)2+CH2=CH2的反应产物 rCI(CO)PPh3)2+CF2=CF,的反应产物 Hydride complexes Co2(CO)s+H2->HCo(CO) Or Co2(CO)s+Na->Co(CO)4+Na+ Co(CO)+H+->HCo(CO)
IrCl(CO)(PPh3 )2 + CH2=CH2的反应产物 IrCl(CO)(PPh3 )2 + CF2=CF2的反应产物 Hydride complexes Co2 (CO)8+H2 ⎯→ HCo(CO)4 Or Co2 (CO)8+Na ⎯→ Co(CO)4 – +Na+ Co(CO)4 – + H+ ⎯→ HCo(CO)4
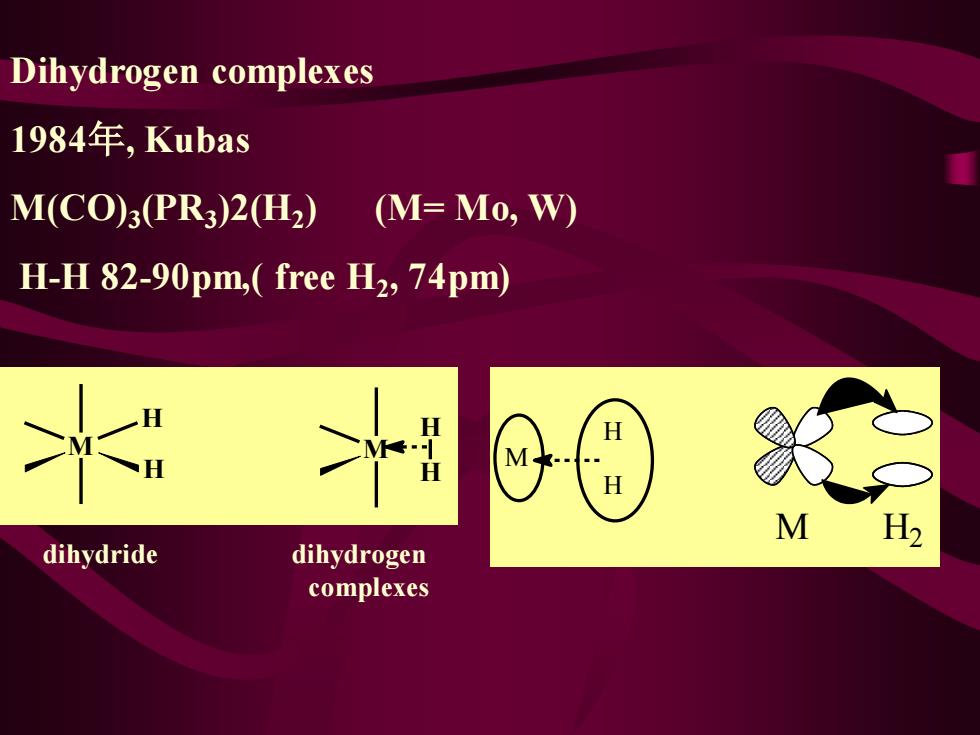
Dihydrogen complexes 1984年,Kubas M(CO):(PR3)2(H2) (M=Mo,W) H-H 82-90pm,(free H2,74pm) 州 M H2 dihydride dihydrogen complexes
Dihydrogen complexes 1984年, Kubas M(CO)3 (PR3 )2(H2 ) (M= Mo, W) H-H 82-90pm,( free H2 , 74pm) M H2 H H M M H H H M H dihydride dihydrogen complexes