
第13章f区元素 Chapter 13 f-Block Elements
第13章 f 区元素 Chapter 13 f-Block Elements
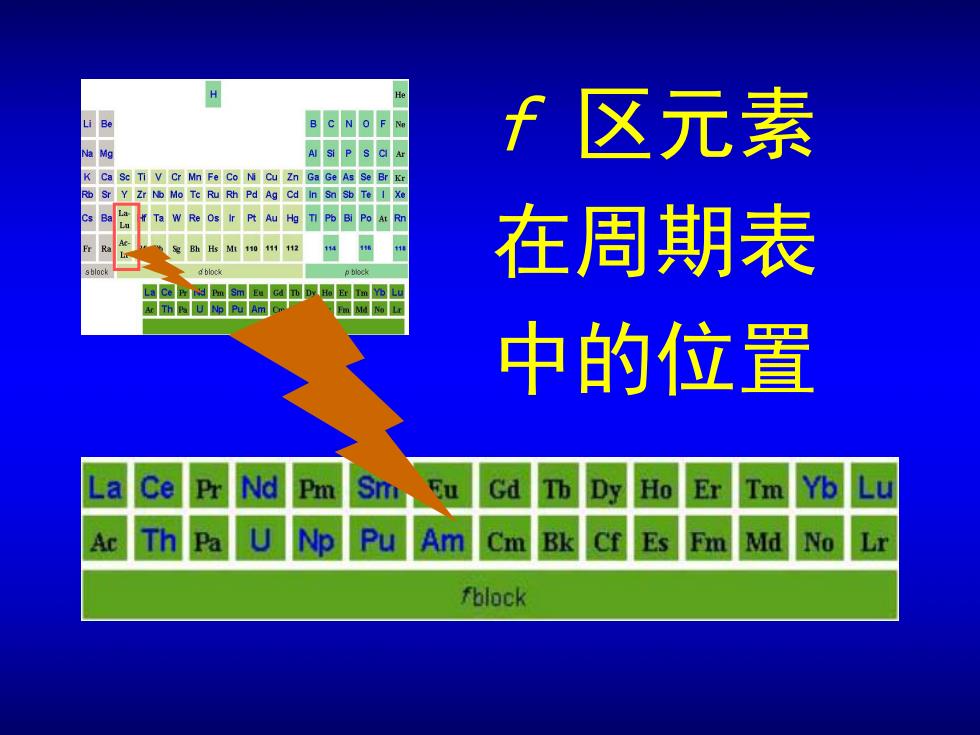
Be B C N O F Ne Npsa如 f区元素 Ca Sc TI V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br kr R Sr Y Zr N Mo Tc Ru Rh Pd Ag Cd in Sn Sb Te I Xe W Re os ir Pt Au Ha TI P6BPoam 在周期表 bloc La Ce Pr rid Pm Sm Ee Gd T Dy.He Er Im Yb Lu Ar Th Pa U Np Pu Am Cr 中的位置 La Ce Pr Nd Pm Sm Eu Gd Th Pa Np Pu Am Cm fblock
f 区元素 在周期表 中的位置

本章教学要求 1. 熟悉铜系元素的电子结构、名称,镧系收缩概 念及其产生的原因和影响: 2.了解镧系元素的存在,制备及用途: 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取 法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元 素的相似性
1.熟悉镧系元素的电子结构、名称,镧系收缩概 念及其产生的原因和影响; 本章教学要求 5. 简单了解锕系元素电子结构、名称及与镧系元 素的相似性. 4.了解镧系元素的分离方法,特别注意溶剂萃取 法及离子交换法的原理; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 2.了解镧系元素的存在,制备及用途;

13.1镧系元素 Lanthanides 13.1.1基本性质概述 章内容 13.1.2重要化合物 13.1.3镧系元素的相互分离 13.1.4存在、提取和应用 13.2锕系元素简介 Introduction of actinides
13.1 镧系元素 Lanthanides 13.1.1 基本性质概述 13.1.2 重要化合物 13.1.3 镧系元素的相互分离 13.1.4 存在、提取和应用 13.2 锕系元素简介 Introduction of actinides 本 章 内 容

13.1 镧系元素 有关∫区元素定义的争论仍在继续: 种意见将镧系和锕系分别界定为La之后的14种元素和Ac 之后的14种元素,结果是镧系不包括La而锕系不包括Ac; 另一种意见是镧系应包括La而锕系应包括Ac,各有15个元素, 这都与f电子的填充有关, “稀土”一别致有趣的名字: 稀土的英文是Rare Earths,l8世纪得名,“稀”原指稀贵,“ 土”是指其氧化物难溶于水的“土” 性,其实稀土元素在地壳中 的含量并不稀少,性质也不象土,而是一组活泼金属,“稀土”之 称只是一种历史的习惯, 根据UPAC推荐,把57至71的15个元素称为镧系元素,用 Ln表示,它们再加上21号的Sc和39号的Y称为稀土完素, RE表示
13.1 镧系元素 “稀土” — 别致有趣的名字: 稀土的英文是 Rare Earths,18 世纪得名, “稀”原指稀贵, “ 土” 是指其氧化物难溶于水的 “土” 性. 其实稀土元素在地壳中 的含量并不稀少,性质也不象土,而是一组活泼金属, “稀土” 之 称只是一种历史的习惯 . 根据 IUPAC 推荐,把 57 至 71 的 15 个元素称为镧系元素,用 Ln 表示 ,它们再加上 21 号的 Sc 和 39 号的 Y 称为稀土元素,用 RE 表示 . 有关 f 区元素定义的争论仍在继续: 一种意见将镧系和锕系分别界定为 La 之后的 14 种元素和 Ac 之后的 14 种元素,结果是镧系不包括 La 而锕系不包括 Ac ; 另一种意见是镧系应包括 La 而锕系应包括 Ac , 各有 15 个元素. 这都与 f 电子的填充有关

13.1.1 基本性质概述 1.镧系元素的分组 57La58Ces9Pr60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67H068Er69Tm70Yb7Lu 镧铈错钕钜钐铕钆铽镝钬铒铥镱镥 轻稀土组 重稀土组 轻稀土组 中稀土组 重稀土组 另有四分组: 57La58Ce59Pr60Nd61Pm 62Sm 63Eu 64G 镧铈错钕 阳 64Gd 65Tb 66Dy 67H068Er69Tm70Yb71Lu 钆铽镝钬铒铥镱镥
13.1.1 基本性质概述 1. 镧系元素的分组 轻稀土组 重稀土组 轻稀土组 中稀土组 重稀土组 57La 58Ce 59Pr 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm70Yb 71Lu 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 钆 铽 镝 钬 铒 铥 镱 镥 另有四分组: 57La58Ce 59Pr 60Nd 镧 铈 镨 钕 钷 钐 铕 钆 61Pm 62Sm 63Eu 64Gd 64Gd 65Tb 66Dy 67Ho68Er 69Tm70Yb71Lu
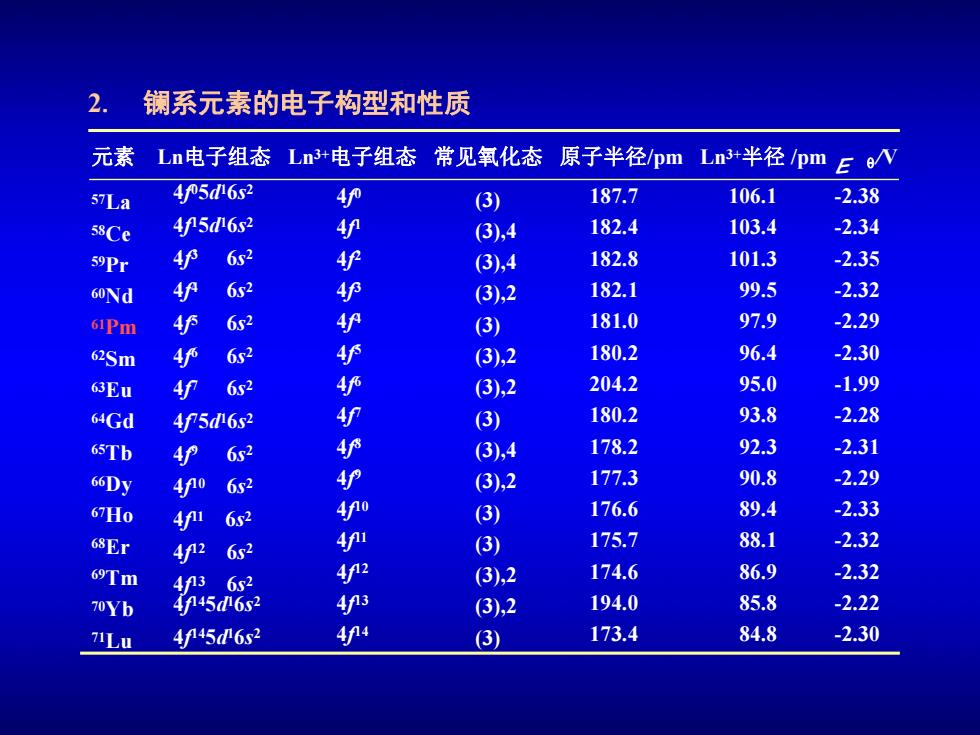
2. 镧系元素的电子构型和性质 元素 Ln电子组态Ln+电子组态 常见氧化态 原子半径/pmLn3+半径pm 57La 45d6s2 4 (3 187.7 106.1 -2.38 58Ce 4n5d6s2 4 (3),4 182.4 103.4 -2.34 59Pr 4护 6s2 (3),4 182.8 101.3 -2.35 60Nd 4f 6s2 4护 (3),2 182.1 99.5 -2.32 61Pm F 6s2 4护 (3) 181.0 97.9 -2.29 62Sm 4 6s2 4护 (3),2 180.2 96.4 -2.30 63Eu 4f 6x2 4护 (3),2 204.2 95.0 -1.99 64Gd 4f5d62 4 (3) 180.2 93.8 -2.28 65Tb 4f 6r2 4护 (3),4 178.2 92.3 -2.31 66Dy 40 6s2 4 (3),2 177.3 90.8 -2.29 6H0 4fi 6s2 4fo (3) 176.6 89.4 -2.33 68Er 4r2 6r2 4 (3) 175.7 88.1 -2.32 69Tm 4f13 6s2 42 (3),2 174.6 86.9 -2.32 70Yb 445d6s2 4n3 (3),2 194.0 85.8 -2.22 4f45d6s2 44 (3) 173.4 84.8 -2.30
2. 镧系元素的电子构型和性质 元素 Ln电子组态 Ln E q 3+电子组态 常见氧化态 原子半径/pm Ln3+半径 /pm /V 57La 58Ce 59Pr 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm 70Yb 71Lu 4f 05d 16s 2 4f 15d 16s 2 4f 3 6s 2 4f 4 6s 2 4f 5 6s 2 4f 6 6s 2 4f 7 6s 2 4f 75d 16s 2 4f 9 6s 2 4f 10 6s 2 4f 11 6s 2 4f 12 6s 2 4f 13 6s 2 4f 145d 16s 2 4f 145d 16s 2 4f 0 4f 1 4f 2 4f 3 4f 4 4f 5 4f 6 4f 7 4f 8 4f 9 4f 10 4f 11 4f 12 4f 13 4f 14 (3) (3),4 (3),4 (3),2 (3) (3),2 (3),2 (3) (3),4 (3),2 (3) (3) (3),2 (3),2 (3) 187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4 106.1 103.4 101.3 99.5 97.9 96.4 95.0 93.8 92.3 90.8 89.4 88.1 86.9 85.8 84.8 -2.38 -2.34 -2.35 -2.32 -2.29 -2.30 -1.99 -2.28 -2.31 -2.29 -2.33 -2.32 -2.32 -2.22 -2.30

3.氧化态特征 镧系元素全部都形成稳定的+3氧化态,同一周期连续15个元 素形成同一种特征氧化态的现象在周期表中是绝无仅有的.非特征 氧化态与它们的电子组态稳定性有关. f4+ 十4 Nd Pm Dy Ho Er I'm +2 Ba2+ Sm Eu La+(4f0),Gd+(4f)和Lu(4f1)已处于稳定结构,获得+2和 +4氧化态是相当困难的;Ce3(4f)和Tb3+(4f8)失去一个电子即达 稳定结构,因而出现+4氧化态;Eu3+(4f6)和Yb3+(4f13)接受一个 电子即达稳定结构,因而易出现+2氧化态
3. 氧化态特征 镧系元素全部都形成稳定的 + 3 氧化态,同一周期连续 15 个元 素形成同一种特征氧化态的现象在周期表中是绝无仅有的 . 非特征 氧化态与它们的电子组态稳定性有关 . +4 +3 +2 Ba 2+ Hf 4+ Dy Ho Er Tm La Ce Pr Nd Pm Sm Eu Gd Tb Yb Lu La3+(4f 0), Gd3+(4f 7) 和 Lu3+(4f 14) 已处于稳定结构,获得 +2 和 +4 氧化态是相当困难的; Ce 3+(4f 1) 和 Tb3+(4f 8) 失去一个电子即达 稳定结构,因而出现 +4 氧化态;Eu3+(4f 6) 和 Yb3+(4f 13) 接受一个 电子即达稳定结构,因而易出现 +2 氧化态
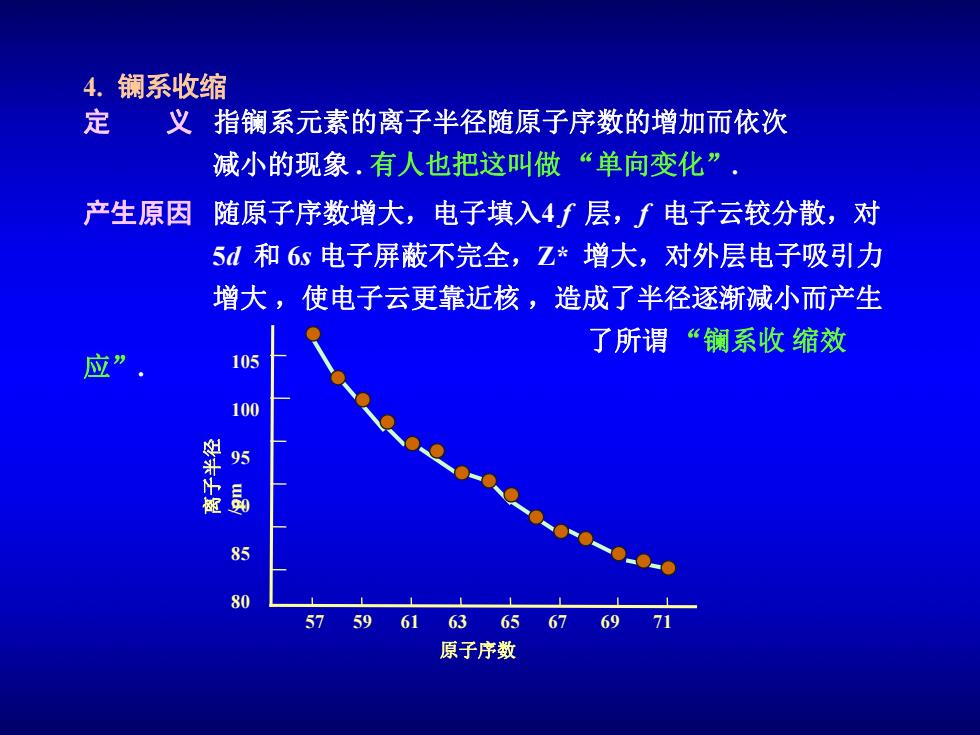
4. 镧系收缩 定 义指镧系元素的离子半径随原子序数的增加而依次 减小的现象.有人也把这叫做“单向变化” 产生原因 随原子序数增大,电子填入4f层,f电子云较分散,对 5d和6s电子屏蔽不完全,Z*增大,对外层电子吸引力 增大,使电子云更靠近核,造成了半径逐渐减小而产生 了所谓“镧系收缩效 105 100 85 80 57 59 61 63656769 71 原子序数
4. 镧系收缩 定 义 指镧系元素的离子半径随原子序数的增加而依次 减小的现象 . 有人也把这叫做 “单向变化”. 产生原因 随原子序数增大,电子填入4 f 层,f 电子云较分散,对 5d 和 6s 电子屏蔽不完全,Z* 增大,对外层电子吸引力 增大 ,使电子云更靠近核 ,造成了半径逐渐减小而产生 了所谓 “镧系收 缩效 应”. 原子序数 离 子 半 径 /p m 57 59 61 63 65 67 69 71 105 100 95 90 85 80

产生影响 ● 收缩缓慢是指相邻两个元素而言,两两之间的减小幅 度不如其他过渡元素两两之间的减小幅度大,使镧系 元素内部性质太相似,增加了分离困难; ● 也使镧系元素后的第三过渡系的离子半径接近于第二 过渡系同族,如Zr+(80pm)和Hf+(81pm),Nb(70 pm)和Ta+(73pm),Mo+(62pm)和W+(65pm),使 其化学性质相似,在矿物中共生,分离困难; ●使Y的原子半径处于Ho和Er之间,使其化学性质与 镧系元素非常相似,在矿物中共生,分离困难故在稀 土 元素分离中将其归于重稀土一组
● 使 Y 的原子半径处于 Ho 和 Er 之间,使其化学性质与 镧系元素非常相似,在矿物中共生,分离困难故在稀 土 元素分离中将其归于重稀土一组. 产生影响 ● 收缩缓慢是指相邻两个元素而言,两两之间的减小幅 度不如其他过渡元素两两之间的减小幅度大,使镧系 元素内部性质太相似,增加了分离困难 ; ● 也使镧系元素后的第三过渡系的离子半径接近于第二 过渡系同族,如 Zr 4+(80 pm) 和 Hf 4+(81 pm), Nb5+(70 pm) 和 Ta5+(73 pm),Mo6+ (62 pm) 和 W6+(65 pm), 使 其化学性质相似,在矿物中共生,分离困难;