
第八章电化学 1.研究对象: 研究电现象与化学现象之间的内在联系及 电能与化学能之间转换规律的一门科学 研究装置: 原电池:化学能→电能 通过自动发生的化学反应向外输送电能, 如干电池,蓄电池 电解池:电能→化学能 输入电能使之发生化学反应,如蓄电池充 电,电解,治炼
1 第八章 电化学 1. 研究对象: 研究电现象与化学现象之间的内在联系及 电能与化学能之间转换规律的一门科学 研究装置: 原电池:化学能→电能 通过自动发生的化学反应向外输送电能, 如干电池,蓄电池 电解池:电能→化学能 输入电能使之发生化学反应,如蓄电池充 电,电解,冶炼

1799年伏特(Volta) 电池(Cu,Zn电池)→直流电 实现了其逆反应过程: 直流电通入电解质溶液→电解 1870年有了直流发电机,得到廉价直流电 大量研究电能→化学能,电解法广泛应用 于工业生产中 2
2 1799 年伏特(Volta) 电池(Cu,Zn 电池)→直流电 实现了其逆反应过程: 直流电通入电解质溶液→电解 1870 年有了直流发电机,得到廉价直流电 大量研究电能→化学能,电解法广泛应用 于工业生产中
2.本章内容 (1) 电解质溶液理论: 研究电解质溶液性质,导电机理 电化学基础 (2)电化学平衡问题: 存在电功的化学平衡问题 介绍:可逆电极,可逆电池,电动势等 (3)不可逆电极过程(电极过程动力学) 包括电解,腐蚀问题一与应用密切相关 3
3 2. 本章内容 (1)电解质溶液理论: 研究电解质溶液性质,导电机理 ——电化学基础 (2)电化学平衡问题: 存在电功的化学平衡问题 介绍:可逆电极,可逆电池,电动势等 (3)不可逆电极过程(电极过程动力学) 包括电解,腐蚀问题——与应用密切相关

3.应用: 应用于国民经济各个领域,与生产,生活, 实验密切相关 (1)上 电治炼: 许多有色和稀有金属的提炼或精练: 如:Al,Mg,K,Na,Li的冶炼, Cu,Pb,Zn的精练 (2)腐蚀与防腐: 许多金属生锈腐蚀的原因与电化学有关, 可利用电化学原理及方法来防腐
4 3. 应用: 应用于国民经济各个领域,与生产,生活, 实验密切相关 (1)电冶炼: 许多有色和稀有金属的提炼或精练: 如:Al,Mg,K,Na,Li 的冶炼, Cu,Pb,Zn 的精练 (2)腐蚀与防腐: 许多金属生锈腐蚀的原因与电化学有关, 可利用电化学原理及方法来防腐

(3) 电化学分析: 电位(导)的滴定法,库仑分析, 极谱分析,电位扫描伏安法,循环伏安法 (4)化学电源: 可提高能源利用率,方便:蓄电池 热电法: 燃烧(煤,油)→加热水蒸气→推动气轮 机转动→带动发电机→电能 热能→电能40%转化率 电池:燃料反应在电池中进行,直接转化 成电能,效率80%一一燃料电池
5 (3)电化学分析: 电位(导)的滴定法,库仑分析, 极谱分析,电位扫描伏安法,循环伏安法 (4)化学电源: 可提高能源利用率,方便:蓄电池 热电法: 燃烧(煤,油)→加热水蒸气→推动气轮 机转动→带动发电机→电能 热能→电能 40%转化率 电池:燃料反应在电池中进行,直接转化 成电能,效率 80%——燃料电池
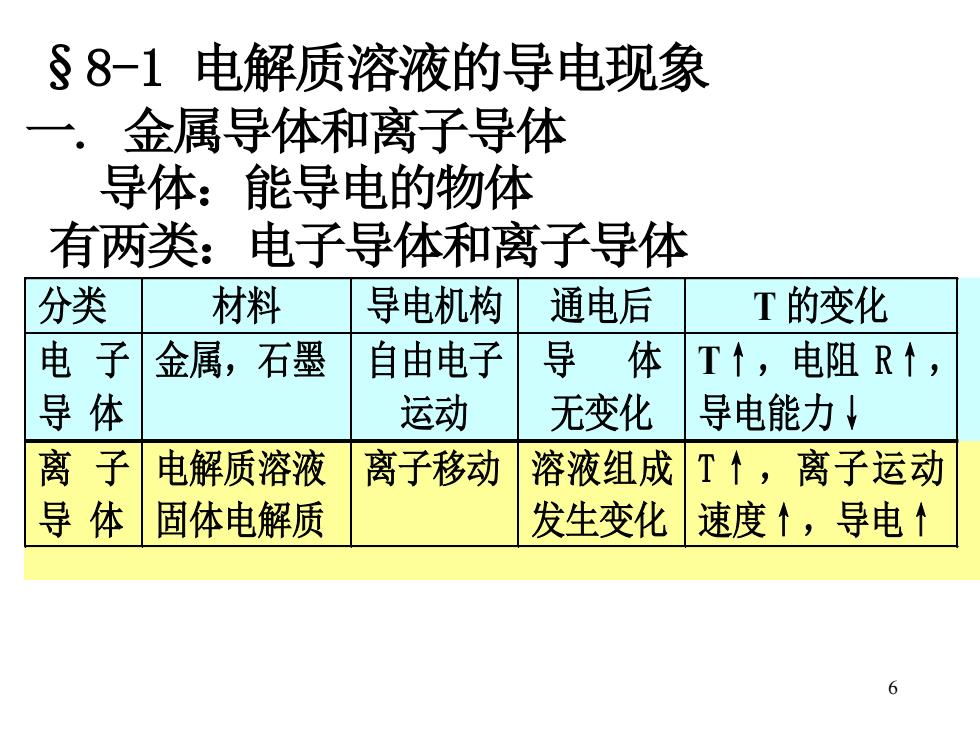
§8-1电解质溶液的导电现象 一.金属导体和离子导体 导体:能导电的物体 有两类:电子导体和离子导体 分类 材料 导电机构 通电后 T的变化 电子 金属,石墨 自由电子 导体 T↑,电阻R↑, 导体 运动 无变化 导电能力↓ 离子 电解质溶液 离子移动 溶液组成T↑,离子运动 导体 固体电解质 发生变化 速度个,导电 6
6 §8-1 电解质溶液的导电现象 一 . 金属导体和离子导体 导体:能导电的物体 有两类:电子导体和离子导体 分类 材料 导电机构 通电后 T 的变化 电 子 导 体 金属,石墨 自由电子 运动 导 体 无变化 T↑,电阻 R↑, 导电能力↓ 离 子 导 体 电解质溶液 固体电解质 离子移动 溶液组成 发生变化 T↑,离子运动 速度↑,导电↑

下面以电解池为例说明离子导电机理: 以Pt为电极, (一) 电解池 HCI溶液为电解质 电子方向 电流方向 溶液中的离子做定向移动 CI→正极十 →负极- 电极上发生的化学反应: +极2C-2e→Cl2 阴 阳 阳极,氧化反应 极 极 -极2H+2e→H2 阴极,还原反应
7 下面以电解池为例说明离子导电机理: 以 Pt 为电极, HCl 溶液为电解质 溶液中的离子做定向移动 Cl- ⎯→ 正极 + H + ⎯→ 负极 - 电极上发生的化学反应: +极 2Cl- - 2e ⎯→ Cl2 阳极,氧化反应 - 极 2H+ + 2e ⎯→ H2 阴极,还原反应
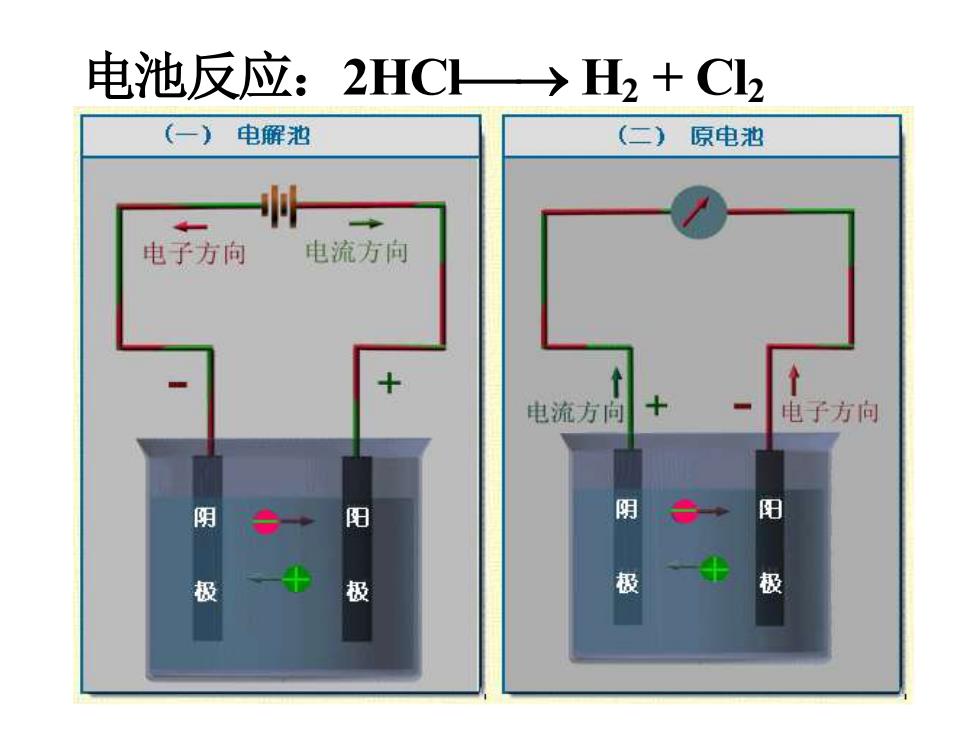
电池反应:2HC→2+C2 (一)电解池 (二)原电池 电子方向 电流方向 + 电流方向 电子方向 阴 阳 阴 阳 极 极 极 极
8 电池反应:2HCl⎯→ H2 + Cl2

二.法拉第(Faraday)定律(1883年) 电解时,在电极上发生反应的物质的数量 与通入的电量Q成正比 例:电极反应:A+Ze→A m 电量Q=ZF=nZF M Q:通入的电量(单位:库仑) m: 电极上发生反应的物质的质量 M: 该物质的摩尔质量 Z: 电极反应中电子的计量系数 n:电极上发生反应的量
9 二. 法拉第(Faraday)定律(1883 年) 电解时,在电极上发生反应的物质的数量 与通入的电量 Q 成正比 例:电极反应: A z+ + Ze ⎯→ A 电量 ZF nZF M m Q = = Q:通入的电量(单位:库仑) m:电极上发生反应的物质的质量 M:该物质的摩尔质量 Z:电极反应中电子的计量系数 n:电极上发生反应的量

F:1摩尔电子的电荷,称作Faraday常数 F=Ne=6.022×1023molx1.602×1019C =96484.6C.mol1≈96500C.mol1 表示有1摩尔物质在电极上反应,需要通 过ZN。个电子,即通过的电量为ZF Q=nZF 无任何限制条件,对电池、电解池均适用 例:2H+2e→H2 n=2,Z=1 Q=2×1×F=2P=2X96500C 10
10 F:1 摩尔电子的电荷,称作 Faraday 常数 F = No e = 6.0221023mol-11.60210-19C = 96484.6 C . mol-1 96500 C . mol-1 表示有 1 摩尔物质在电极上反应,需要通 过 ZNo个电子,即通过的电量为 ZF Q = nZF 无任何限制条件,对电池、电解池均适用 例:2H+ + 2e ⎯→ H2 n=2,Z=1 Q=2×1×F=2F=2×96500C