
§7-2过渡态理论(活化络合物理论) 1935年由Eyring和Polanyi在量子力学 和统计热力学基础上提出 一。 基本观点: 发生化学反应,必须经过生成活化络合 物的中间阶段 由活化络合物再生成产物 (形成过渡态需要活化能,故把过渡态叫 作活化络合物)
1 §7-2 过渡态理论(活化络合物理论) 1935 年由 Eyring 和 Polanyi 在量子力学 和统计热力学基础上提出 一 . 基本观点: ① 发生化学反应,必须经过生成活化络合 物的中间阶段 由活化络合物再生成产物 (形成过渡态需要活化能,故把过渡态叫 作活化络合物)

中间物—活化络合物不稳定 易分解,既可生成产物,又可生成反应物 ③ 活化络合物分解成产物的速率很慢,与 反应物之间达成平衡 总反应速率“取决于活化络合物分解速率 反应通式:A+BC=[ABCB+C 用该理论,只要知道分子的振动频率、 质量、核间距等基本物性,就能计算反应的 速率系数,所以又称为绝对反应速率理论 (absolute rate theory)
2 ② 中间物——活化络合物不稳定 易分解,既可生成产物,又可生成反应物 ③ 活化络合物分解成产物的速率很慢,与 反应物之间达成平衡 总反应速率 r 取决于活化络合物分解速率 反应通式: 用该理论,只要知道分子的振动频率、 质量、核间距等基本物性,就能计算反应的 速率系数,所以又称为绝对反应速率理论 (absolute rate theory)

二 势能面 A与BC反应,B-C原子间断裂 原子间相互作用的势能与核间距有关 a)双原子体系: 两原子之间的势能与距离的关系曲线由莫 尔斯给出 3
3 二. 势能面 A 与 BC 反应,B-C 原子间断裂 原子间相互作用的势能与核间距有关 a) 双原子体系: 两原子之间的势能与距离的关系曲线由莫 尔斯给出
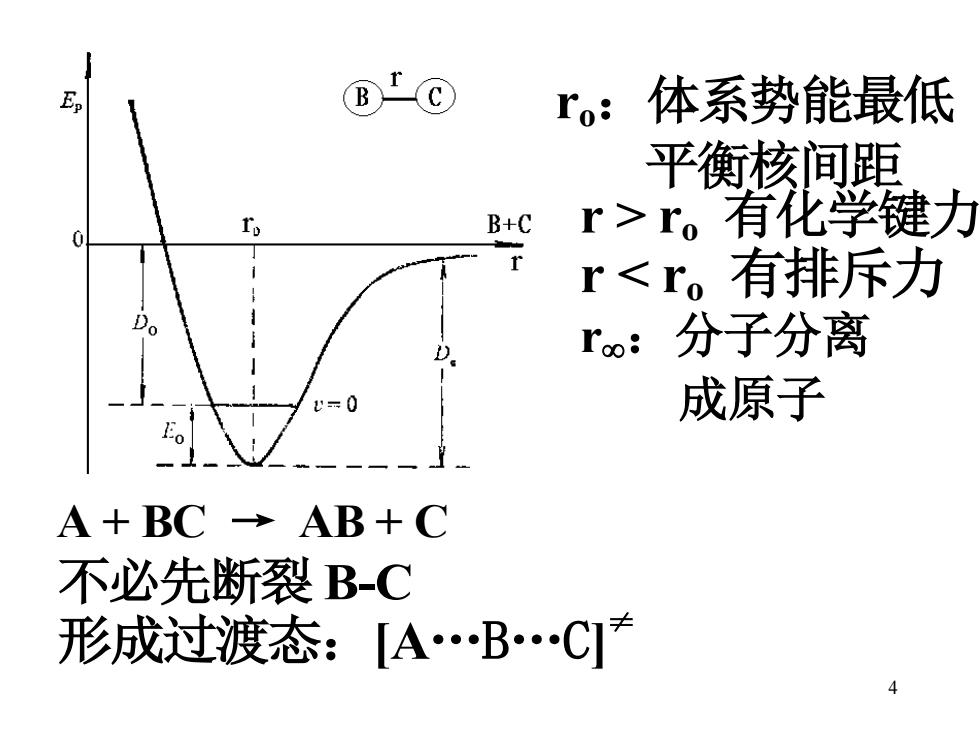
E B ro:体系势能最低 平衡核间距 B+C 0 I r>r。有化学键力 r<r。有排斥力 Do D Ioo: 分子分离 =0 成原子 Eo A+BC→AB+C 不必先断裂B-C 形成过渡态:[A.B.C无 1
4 ro:体系势能最低 平衡核间距 r > ro 有化学键力 r < ro 有排斥力 r:分子分离 成原子 A + BC → AB + C 不必先断裂 B-C 形成过渡态:[A.B.C] ≠
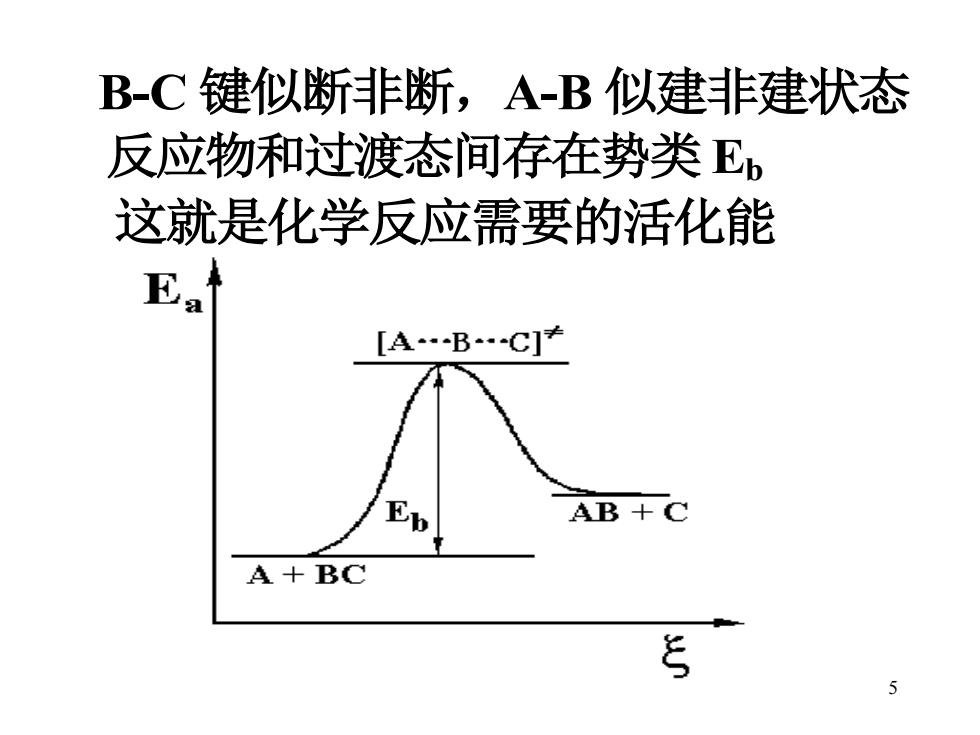
B-C键似断非断,A-B似建非建状态 反应物和过渡态间存在势类E, 这就是化学反应需要的活化能 Ea [ABC]≠ AB+C A+BC 三
5 B-C 键似断非断,A-B 似建非建状态 反应物和过渡态间存在势类 Eb 这就是化学反应需要的活化能
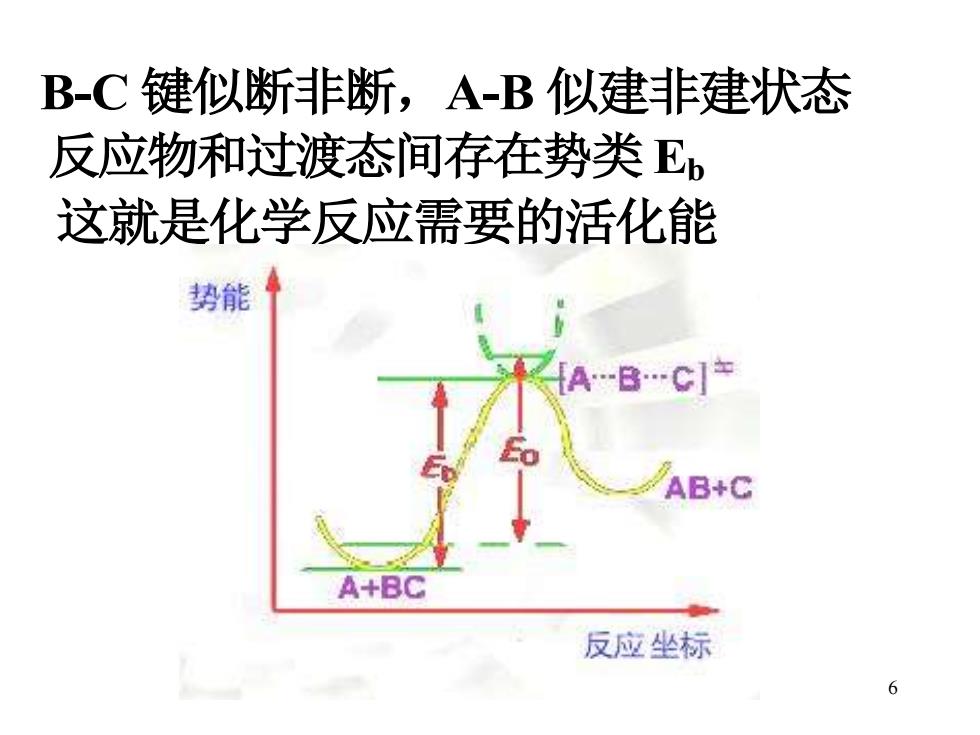
B-C键似断非断,A-B似建非建状态 反应物和过渡态间存在势类E, 这就是化学反应需要的活化能 势能 AB+C A+BC 反应坐标 6
6 B-C 键似断非断,A-B 似建非建状态 反应物和过渡态间存在势类 Eb 这就是化学反应需要的活化能
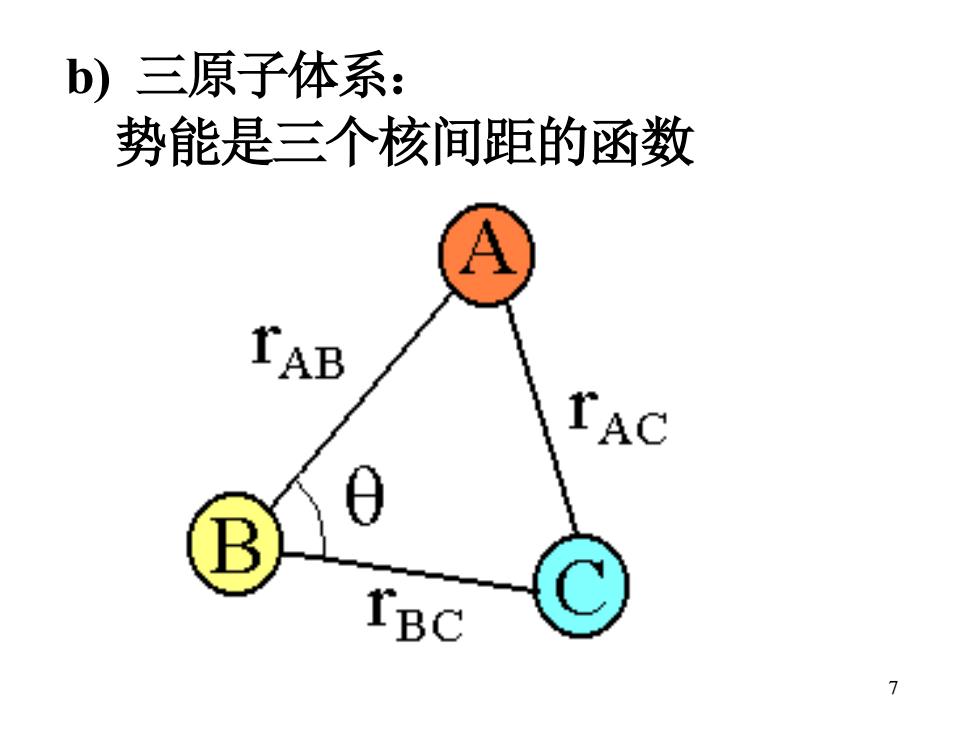
b)三原子体系: 势能是三个核间距的函数 rAC B IBC
7 b) 三原子体系: 势能是三个核间距的函数
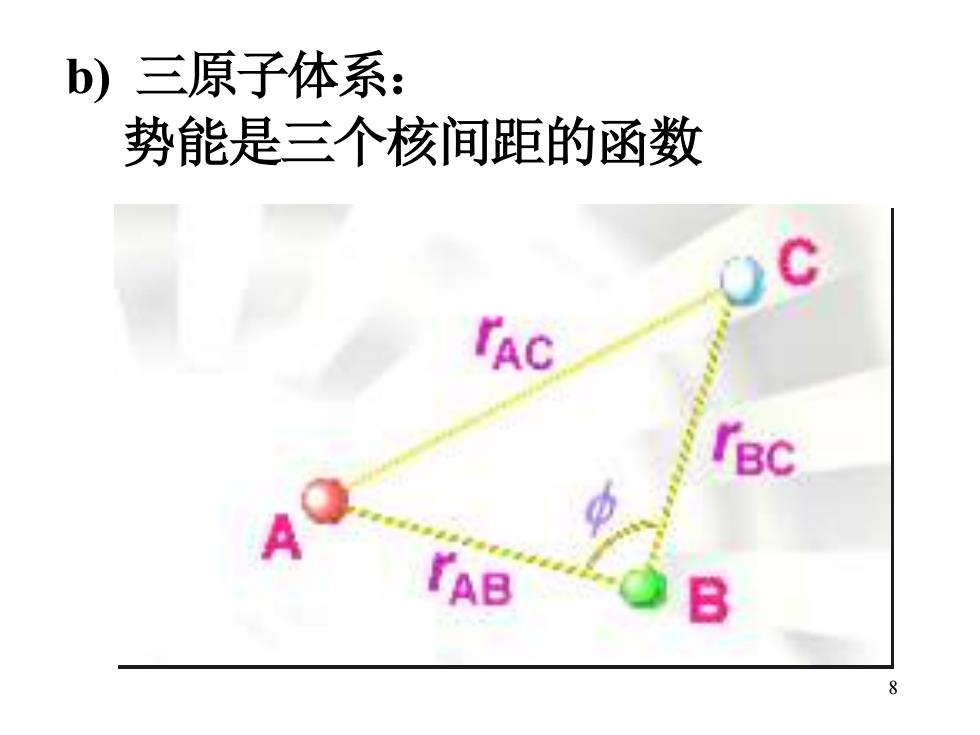
b)三原子体系: 势能是三个核间距的函数 rBC rAB 8
8 b) 三原子体系: 势能是三个核间距的函数
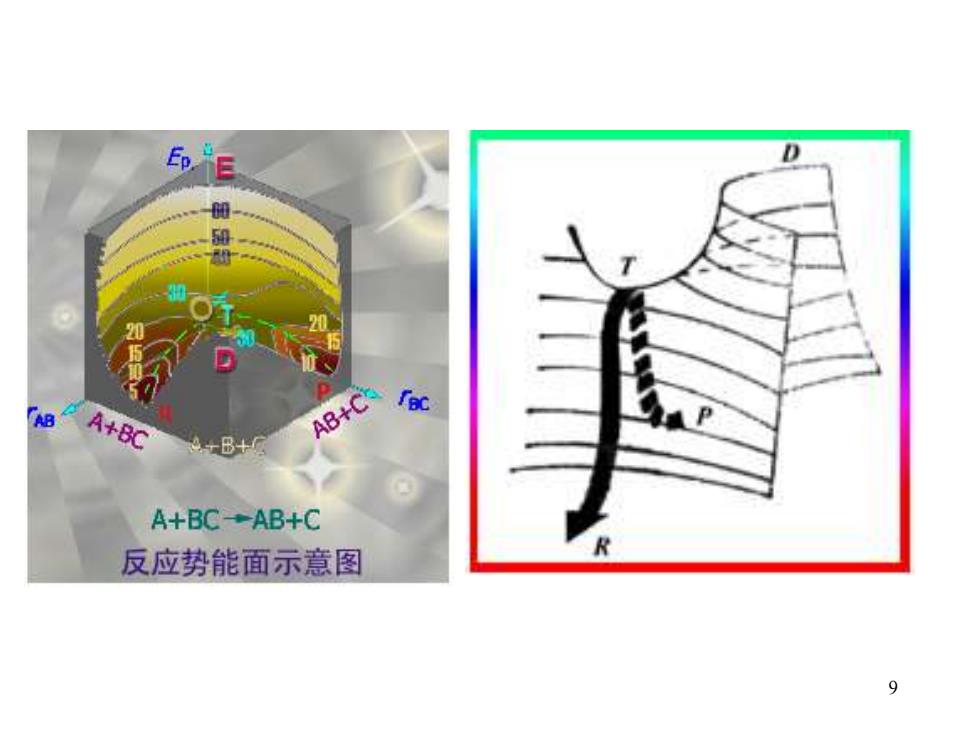
Ep.E D A+BC AB+C A+BC-AB+C 反应势能面示意图
9
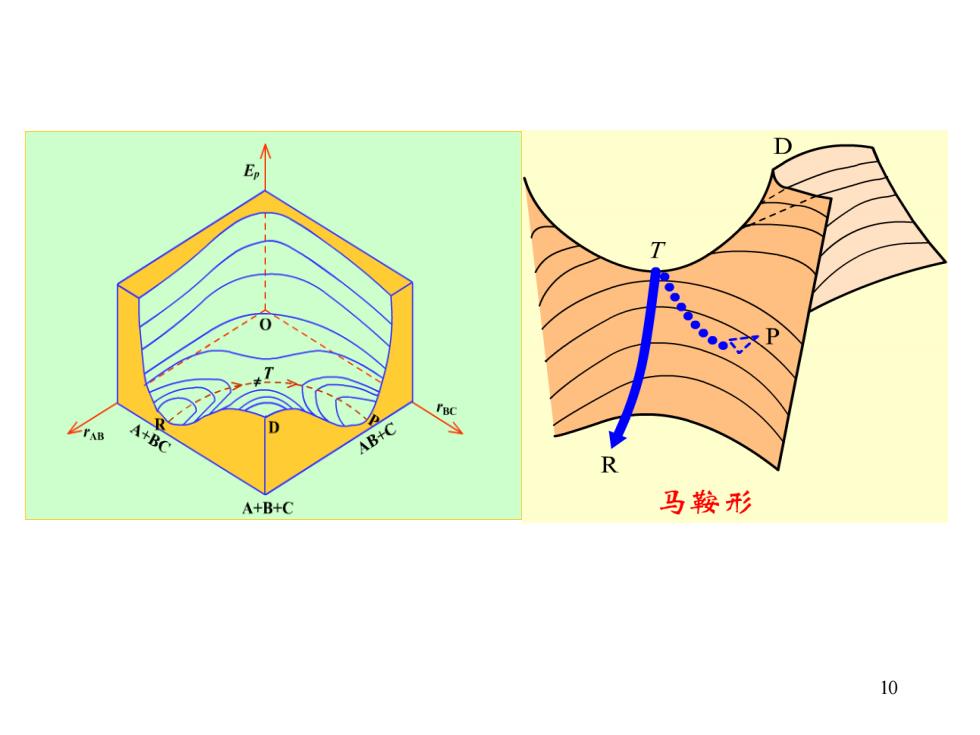
D A+BC AB+C R A+B+C 马鞍形 10
10