
第五章 酶与其他生物催化剂 Enzymes and Other Biocatalysts 目录
目 录 Enzymes and Other Biocatalysts 第 五 章 酶与其他生物催化剂

酶的研究简史 公元前两千多年,我国已有酿酒记载。 1833年,Anselme Payen提纯了麦芽淀粉糖化酶(淀粉酶) 1878年,Wilhelm Kuhne首次提出Enzyme一词。 ◆ 1894年,Emil Fischeri证明了酶的专一性,酶与底物之间作用的锁钥关系。 1897年,Buchner.兄弟用不含细胞的酵母提取液,实现了发酵。 1913年,Leonor Michaelisi和Maud Menten推导出酶反应的动力学方程式。 1926~1930年,James Sumner和John H.Northrop2分别将脲酶和胃蛋白酶、 胰蛋白酶制成结晶,确定了酶的蛋白质本质。 1941年,George Beadle和Edward Tatum的“一个基因一个酶”假说首次 将蛋白质与基因联系在一起,推动了生物化学与遗传学的结合。 1982年,Cech首次发现RNA也具有酶的催化活性,提出核酶(ribozyme)的 概念。 1995年,Jack W.Szostak研究室首先报道了具有DNA连接酶活性DNA片段, 称为脱氧核酶(deoxyribozyme)
目 录 酶的研究简史 公元前两千多年,我国已有酿酒记载。 1833年, Anselme Payen提纯了麦芽淀粉糖化酶(淀粉酶)。 1878年,Wilhelm Kühne首次提出Enzyme一词。 1894年, Emil Fischer证明了酶的专一性,酶与底物之间作用的锁钥关系。 1897年,Buchner兄弟用不含细胞的酵母提取液,实现了发酵。 1913年,Leonor Michaelis和Maud Menten推导出酶反应的动力学方程式。 1926~1930年,James Sumner和John H. Northrop分别将脲酶和胃蛋白酶、 胰蛋白酶制成结晶,确定了酶的蛋白质本质。 1941年,George Beadle和Edward Tatum的“一个基因一个酶”假说首次 将蛋白质与基因联系在一起,推动了生物化学与遗传学的结合。 1982年,Cech首次发现RNA也具有酶的催化活性,提出核酶(ribozyme)的 概念。 1995年,Jack W. Szostak研究室首先报道了具有DNA连接酶活性DNA片段, 称为脱氧核酶(deoxyribozyme)

第一节 酶和酶反应简介 Introduction to Enzymes and Enzymatic Reactions 目录
目 录 第一节 酶和酶反应简介 Introduction to Enzymes and Enzymatic Reactions

、化学反应具有热力学和动力学特性 (一)热力学性质涉及能量平衡和反应平衡 1.反应平衡可用平衡常数来描述 反应平衡(reaction equilibrium) 任何一个化学反应在正向反应与逆向反 应速率相等时,反应便不再有新的产物生成, 这时的化学反应称为反应平衡。 平衡常数(equilibrium constant,.Keg) 平衡常数是指化学反应达到平衡时,反 应产物浓度积与剩余底物浓度积之比。 目录
目 录 一、化学反应具有热力学和动力学特性 (一)热力学性质涉及能量平衡和反应平衡 1.反应平衡可用平衡常数来描述 反应平衡(reaction equilibrium) 任何一个化学反应在正向反应与逆向反 应速率相等时,反应便不再有新的产物生成, 这时的化学反应称为反应平衡。 平衡常数(equilibrium constant, Keq) 平衡常数是指化学反应达到平衡时,反 应产物浓度积与剩余底物浓度积之比

S+S2=P1+P2 [Pileg[P2lea [SileglS2lea 一定的温度下,Kg与反应的初始浓度无关, 它反映化学反应的本性。 K如越大则反应越倾向于产物的生成,即正向 反应进行得越完全;K越小则逆反应的程度越大。 Kg是化学反应可能进行的最大限度的量度。 目录
目 录 S1+S2 P1+P2 Keq = [P1 ]eq[P2 ]eq [S1 ]eq[S2 ]eq 一定的温度下,Keq与反应的初始浓度无关, 它反映化学反应的本性。 Keq越大则反应越倾向于产物的生成,即正向 反应进行得越完全;Keq越小则逆反应的程度越大。 Keq是化学反应可能进行的最大限度的量度

2.自由能的变化是化学反应的动力 自由能(free energy) 自由能是能够用于做功的能量。 反应物的自由能(G)与其焓、温度( 和熵(S)相关,等于其焓减去绝对温度和嫡的 乘积,即G=H-TS。 在生物系统中,生物分子在等温、等压条 件下,在化学反应中能量的变化可以用自由能 变(△G)来量度。 △G=△H-T△S 目录
目 录 2.自由能的变化是化学反应的动力 自由能(free energy) 自由能是能够用于做功的能量。 反应物的自由能(G)与其焓、温度(T) 和熵(S)相关,等于其焓减去绝对温度和熵的 乘积,即G = H TS 。 在生物系统中,生物分子在等温、等压条 件下,在化学反应中能量的变化可以用自由能 变( G)来量度。 G = H TS

自由能的变化是化学反应的动力,影响化学反 应的方向。 △G0 反应为吸能反应(endergonic reaction)不能自发进行 △G=0 反应正逆向速率相等,反应处于平衡状态 目录
目 录 自由能的变化是化学反应的动力,影响化学反 应的方向。 G 0 反应为吸能反应(endergonic reaction)不能自发进行 G = 0 反应正逆向速率相等,反应处于平衡状态
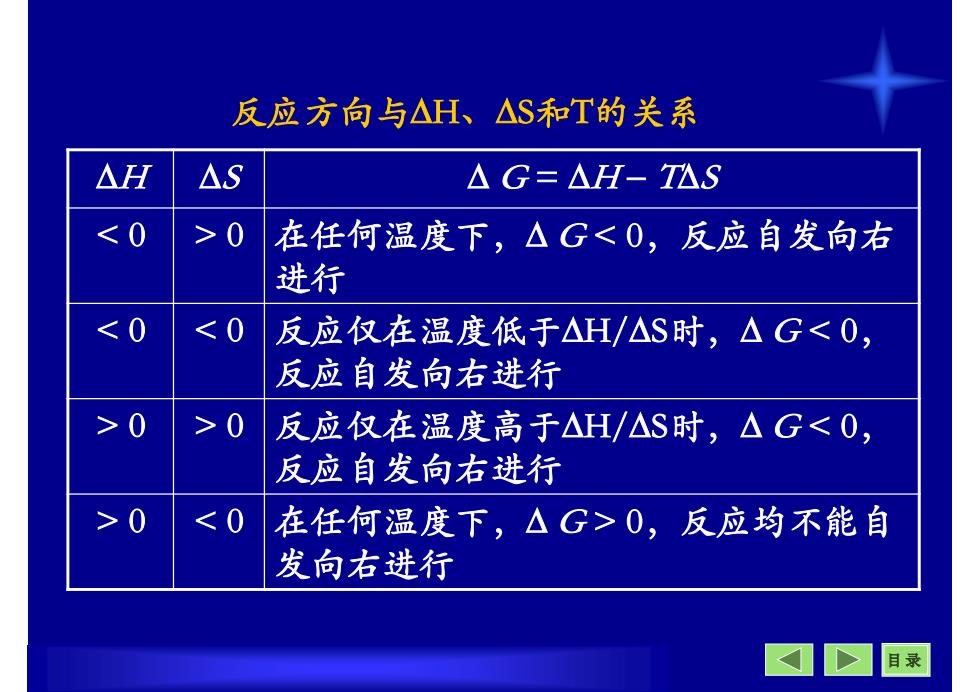
反应方向与△H、△S和T的关系 △H △S △G=△H-T公S 0 在任何温度下,△G0 >0 反应仅在温度高于△H/△S时,△G0 0,反应均不能自 发向右进行 目录
目 录 反应方向与H、S和T的关系 H S G = H TS 在任何温度下, G 0 反应仅在温度低于H/S时, G 0 > 0 在任何温度下, G > 0,反应均不能自 发向右进行 > 0 < 0

3.标准自由能变与平衡常数有关 标准自由能变(△G)是指在标准状态下的自由能变 标准状态: 压力=1大气压(101.3kPa) 温度=298K(25°C) pH=7.0 [S]=[P]=1mol/I 在S+S2 P+P2中 P[P2] △G=△G0'+RTln [S JIS2I 反应达到平衡时即△G=0 △G0'=-RTIn K'eg 目录
目 录 3.标准自由能变与平衡常数有关 标准自由能变(G0 ´)是指在标准状态下的自由能变 标准状态: 压力 = 1大气压(101.3kPa) 温度 = 298K(25C) pH = 7.0 [S]=[P]=1mol/l G = G0´+ RT ln [P1 ][P2 ] [S1 ][S2 ] 反应达到平衡时即 G = 0 G0´ = RT ln K’eq 在S1+S2 P1+P2 中

(二)动力学性质是对反应速率的描述 动力学是研究化学反应速率及其影 响因素的科学。 反应速率是单位体积内反应进度随时 间的变化率,任何反应速率均由底物浓度和 速率常数(rate constant,k)所决定。 目录
目 录 (二)动力学性质是对反应速率的描述 动力学是研究化学反应速率及其影 响因素的科学。 反应速率是单位体积内反应进度随时 间的变化率,任何反应速率均由底物浓度和 速率常数(rate constant, k)所决定