
第三篇水溶液化学原理 第8章水溶液 Chapter 8 Water Solution
第三篇 水溶液化学原理 第8章 水溶液 Chapter 8 Water Solution

本章教学要求 1, 进一步掌握溶液的浓度的表示方法。 2.了解稀溶液的通性。 3.初步了解强电解质理论。 上页下页节首节尾
2 1. 进一步掌握溶液的浓度的表示方法。 2. 了解稀溶液的通性。 3. 初步了解强电解质理论。 本章教学要求

本章教学内容 8-1溶液的浓度和溶解度Concentration and solubility of solution 8-2非电解质稀溶液的依数性Colligative properties dilute nonelectroiyte solution 8-3强电解质溶液理论 Theory of strong electrolyte solution 上页下页节首节尾
3 本章教学内容 8-1 溶液的浓度和溶解度 8-2 非电解质稀溶液的依数性 8-3 强电解质溶液理论 Concentration and solubility of solution Colligative properties dilute nonelectroiyte solution Theory of strong electrolyte solution

8-1溶液的浓度和溶解度(concentration and solubility of solution) 8-l-1溶液的浓度(The concentration of solution) 1、溶液浓度的表示方法 广义的浓度定义是溶液重的溶质相对于溶液或溶剂的相对量。 狭义的浓度定义是一定体积的溶液重溶质的“物质的量”。在历史上由 于不同的实践需要形成了名目众多的浓度表示方法,已经学过的浓度表 示方法有: 溶液浓度的几种表示方法 类型 符号 单位 物质的量浓度(molarity) M mol/L 质量摩尔浓度(molality) m mol/kg 质量分数 w 无单位 摩尔分数 x(B) 无单位 上页 页 节首 节尾
4 8-1 溶液的浓度和溶解度(concentration and solubility of solution) 8-1-1 溶液的浓度(The concentration of solution) 1、溶液浓度的表示方法 广义的浓度定义是溶液重的溶质相对于溶液或溶剂的相对量。 狭义的浓度定义是一定体积的溶液重溶质的“物质的量”。在历史上由 于不同的实践需要形成了名目众多的浓度表示方法,已经学过的浓度表 示方法有: 溶液浓度的几种表示方法 类型 符 号 单 位 物质的量浓度(molarity) M mol/L 质量摩尔浓度(molality) m mol/kg 质量分数 w 无单位 摩尔分数 x(B) 无单位

2.各种浓度之间的换算如:p297表8-1实验室常用酸碱溶液的浓度。 3.各种不同纯度试剂的表示: 优级纯(G.R):Guarantee Reagent(绿色) 分析纯(A.R):Analytical Reagent(红色) 化学纯(C.P):Chemical Pure(蓝色) 实验试剂(L.R:Laboratory Reagent(棕或黄色) 5 上页下页节首 节尾
5 2. 各种浓度之间的换算.如:p297表8-1 实验室常用酸碱溶液的浓度。 3. 各种不同纯度试剂的表示: 优级纯(G.R):Guarantee Reagent (绿色) 分析纯(A.R):Analytical Reagent(红色) 化学纯(C.P):Chemical Pure(蓝色) 实验试剂(L.R): Laboratory Reagent (棕或黄色)
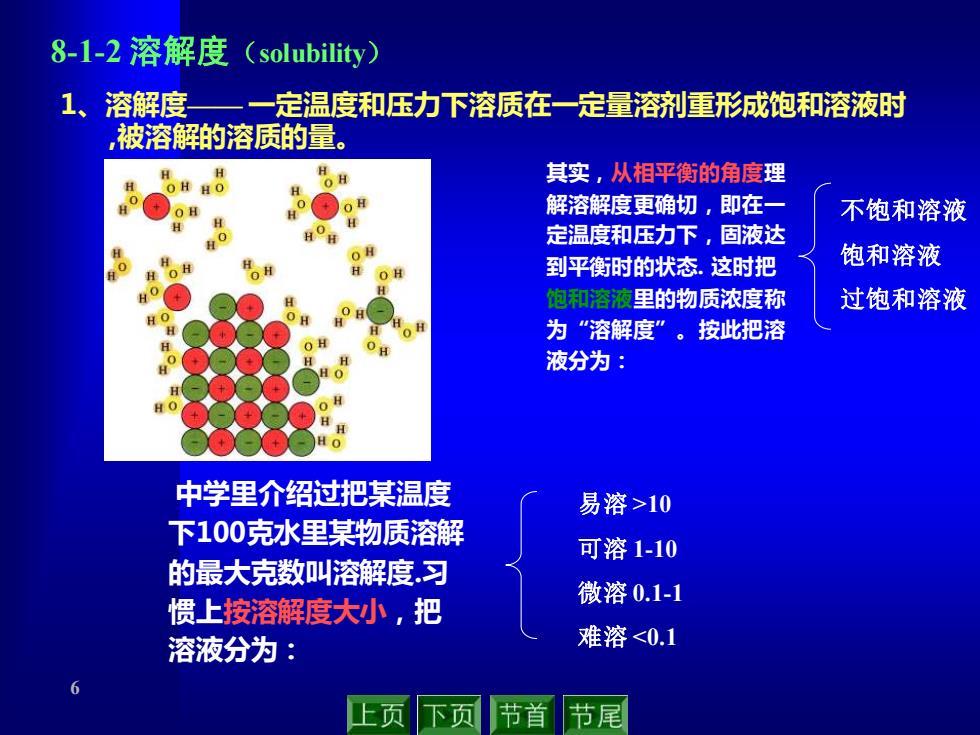
8-1-2溶解度(solubility) 溶解度 一定温度和压力下溶质在一定量溶剂重形成饱和溶液时 被溶解的溶质的量。 其实,从相平衡的角度理 H HO 解溶解度更确切,即在 不饱和溶液 定温度和压力下,固液达 到平衡时的状态.这时把 饱和溶液 饱和溶液里的物质浓度称 过饱和溶液 为“溶解度”。按此把溶 液分为: 中学里介绍过把某温度 易溶>10 下100克水里某物质溶解 可溶1-10 的最大克数叫溶解度.习 惯上按溶解度大小,把 微溶0.1-1 溶液分为: 难溶<0.1 页 节首 节尾
6 8-1-2 溶解度(solubility) 中学里介绍过把某温度 下100克水里某物质溶解 的最大克数叫溶解度.习 惯上按溶解度大小,把 溶液分为: 1、溶解度—— 一定温度和压力下溶质在一定量溶剂重形成饱和溶液时 ,被溶解的溶质的量。 其实,从相平衡的角度理 解溶解度更确切,即在一 定温度和压力下,固液达 到平衡时的状态. 这时把 饱和溶液里的物质浓度称 为“溶解度”。按此把溶 液分为: 易溶 >10 可溶 1-10 微溶 0.1-1 难溶 <0.1 不饱和溶液 饱和溶液 过饱和溶液
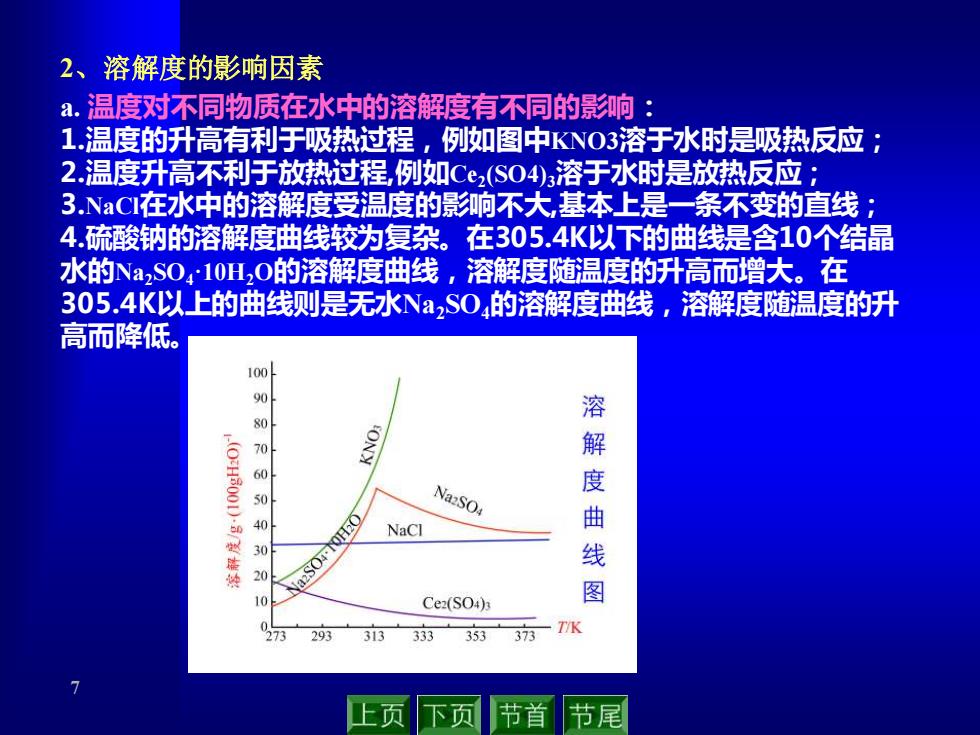
2、溶解度的影响因素 a.温度对不同物质在水中的溶解度有不同的影响: 1.温度的升高有利于吸热过程,例如图中KN03溶于水时是吸热反应; 2.温度升高不利于放热过程,例如C2(S04)3溶于水时是放热反应; 3NaC在水中的溶解度受温度的影响不大,基本上是一条不变的直线: 4.硫酸钠的溶解度曲线较为复杂。在305.4K以下的曲线是含10个结晶 水的NaS04·10H20的溶解度曲线,溶解度随温度的升高而增大。在 305.4K以上的曲线则是无水Na2S0,的溶解度曲线,溶解度随温度的升 高而降低。 100 000 溶 解 50 NazSO4 0 曲 NaCl 30 线 20 10 Ce2(S04) 图 273 293 313 333 353 373 -T/K 上页 下页 节首 节尾
7 2、溶解度的影响因素 a. 温度对不同物质在水中的溶解度有不同的影响: 1.温度的升高有利于吸热过程,例如图中KNO3溶于水时是吸热反应; 2.温度升高不利于放热过程,例如Ce2 (SO4)3溶于水时是放热反应; 3.NaCl在水中的溶解度受温度的影响不大,基本上是一条不变的直线; 4.硫酸钠的溶解度曲线较为复杂。在305.4K以下的曲线是含10个结晶 水的Na2SO4·10H2O的溶解度曲线,溶解度随温度的升高而增大。在 305.4K以上的曲线则是无水Na2SO4的溶解度曲线,溶解度随温度的升 高而降低
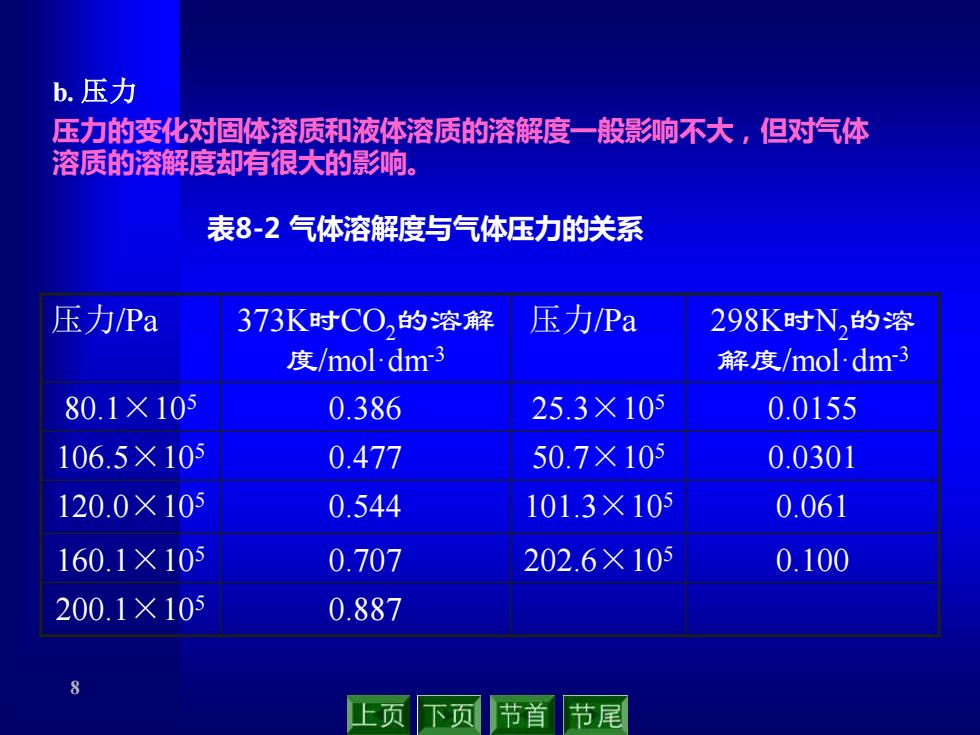
b.压力 压力的变化对固体溶质和液体溶质的溶解度一般影响不大,但对汽体 溶质的溶解度却有很大的影响。 表8-2气体溶解度与气体压力的关系 压力Pa 373K时C0,的溶解 压力Pa 298K时N的溶 度/mol-dm3 解度/nol.dm3 80.1×105 0.386 25.3×105 0.0155 106.5×105 0.477 50.7×105 0.0301 120.0×105 0.544 101.3×105 0.061 160.1×105 0.707 202.6×105 0.100 200.1×105 0.887 8 上页 下页 节首 节尾
8 b. 压力 压力的变化对固体溶质和液体溶质的溶解度一般影响不大,但对气体 溶质的溶解度却有很大的影响。 表8-2 气体溶解度与气体压力的关系 压力/Pa 373K时CO2的溶解 度/mol·dm-3 压力/Pa 298K时N2的溶 解度/mol·dm-3 80.1×105 0.386 25.3×105 0.0155 106.5×105 0.477 50.7×105 0.0301 120.0×105 0.544 101.3×105 0.061 160.1×105 0.707 202.6×105 0.100 200.1×105 0.887

3、享利定律-气体溶解定律 a.叙述:在一定温度下,一定体积的液体中所溶解的汽体质量与该气体的 分压成正比 b.解释:当气体的压强增加n倍;那么气体进入液体的机会也增加n倍, 所以气体溶解的质量也增加倍。故亨利定律与其它气体的分压无 关 c数学表达式:p=Kx(K一Henry's constant) 亨利定律只适用于溶解度小,不与溶剂相互作用的气体。所以 HC1,NH3等气体都不适用。 0 上页下页节首节尾
9 3、享利定律-气体溶解定律 a.叙述:在一定温度下,一定体积的液体中所溶解的气体质量与该气体的 分压成正比 b.解释:当气体的压强增加n倍;那么气体进入液体的机会也增加n倍, 所以气体溶解的质量也增加n倍。故亨利定律与其它气体的分压无 关. c.数学表达式: p=K x (K—— Henry’s constant) 亨利定律只适用于溶解度小,不与溶剂相互作用的气体。所以 HCl,NH3等气体都不适用

Example 25C时,氧气的分压为1个标准压力101325Pa)时, 氧气在水中的溶解度为1.23×103olL.空气中氧氧 的分压分0.2个标准压力因此,当水与空气达到时,水 中氧气的浓度为: .p=k.x x2= P P 0.2标压×1.23×10-3mo1.L .X2 1标压 =2.5×10-4mol.L. 10 上页 下页 节首 节尾
10 。 标压 标压 中氧气的浓度为: 个标准压力因 当水与空气达到 水 氧气 的 度为 空气 的分压为 个标准压力 时, 4 1 3 1 2 1 2 1 2 -3 -1 0 2.5 10 . 1 0.2 1.23 10 . . . 的分压分 0.2 . 此, 时, 在水中 溶解 1.23 10 molL . 中氧氧 25 C时,氧气 1 (101325Pa) − − − − = = = = mol L mol L x p p x x p k x Example