
第九章s区元素 Chapter 9 s-Block Elements
第九章s 区元素 Chapter 9 s-Block Elements

Li Be He Li Be B N 0 Na Mg Na Mg Si P Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br K K Ca Rb Sr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Sr Cs Ba La- Ta W Re Os Ir Pt Au Lu Hg TI Pb Bi Po At Rn Ac- Ra Rf Db Sg Bh Hs Mt 110 111 112 11d 110 Lr Cs Ba sblock d block p block La Ce Pr Nd Pm Sm Eu Gd Th Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cr Es Fm Md No Lr /block Fr Ra S区元素在周期表中的位置 sblock
S区元素在周期表中的位置

本章教学要求 1.了解s区元素的物理性质和化学性质,能够解释Lⅰ的 标准电极电势为什么最低,能解释碱金属与水、醇和液 氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意 钾和钠制备方法的不同; 3.了解s区元素的氢化物、氧化物、氢氧化物的性质,特别 注意氢氧化物的碱性变化规律; 4.了解s区元素的重要盐类化合物,特别注意盐类溶解性 的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性
1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的 标准电极电势为什么最低 ,能解释碱金属与水、醇和液 氨反应的不同; 本章教学要求 6.了解对角线规则和锂、铍的特殊性. 5.会用离子极化理论解释碳酸盐分解规律; 4.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性 的热力学解释; 3.了解s区元素的氢化物、氧化物、氢氧化物的性质,特别 注意氢氧化物的碱性变化规律; 2.了解主要元素的矿物资源及单质的制备方法 ,特别注意 钾和钠制备方法的不同;

本章内容 9.1 概述 generalization 9.2 单质 simple substance 9.3 化合物 compound 9.4 锂、铍 special characteristic 的特殊性 of lithium and beryllium
9.1 概述 9.2 单质 9.3 化合物 9.4 锂 、铍 的特殊性

9.1 概述(generalization) 碱金属(alkalin metals) 碱土金属(alkalin earth metals) (IA):ns! (ⅡA:ns2 电离能 金属性 原子 lithium Be beryllium 、还原性增 径增大 sodium Mg magnesium 电负性减小 potassium a calcium rubidium strontium caesium Ba barium francium Ra radium 原子半径减小 金属性、还原性减弱 电离能、电负性增大
9.1 概述 (generalization) 碱金属 (alkalin metals) (ⅠA): ns 1 碱土金属 (alkalin earth metals) (ⅡA): ns 2 lithium sodium potassium rubidium caesium francium beryllium magnesium calcium strontium barium radium 原 子 半 径 增 大 金 属 性 、 还 原 性 增 强 电 离 能 、 电 负 性 减 小 原子半径减小 金属性、还原性减弱 电离能、电负性增大

9.2 单质(simple substance) 都是最活泼的金属 同一族自上而下性质的变化有规律 通常只有一种稳定的氧化态 形成的化合物大多是离子型的 冰*
● 都是最活泼的金属 9.2 单质 (simple substance) ● 形成的化合物大多是离子型的 ● 通常只有一种稳定的氧化态 ● 同一族自上而下性质的变化有规律

9.2.1物理性质和化学性质 它们都有金属光泽,密度小, 1.单质的物理性质 硬度小,熔点低,导电、导热性 s区单质的熔点变化 好的特点 Na Be
9.2.1 物理性质和化学性质 它们都有金属光泽,密度小, 硬度小,熔点低,导电、导热性 好的特点. s区单质的熔点变化 Li Na K Rb Cs Be Mg Ca Sr Ba 1.单质的物理性质

2.单质的化学性质 (①)与氧、硫、氮、卤素反应,形成相应的化合物 单质在空气中燃烧,形成相应的氧化物: LizO Na202 KO2 RbO2 CsO2 BeO MgO Cao SrO Ba202 你能发现这些氧化物的形式有 什么不同? Na2O2 镁带的燃烧 K02
单质在空气中燃烧,形成相应的氧化物: Li2O Na2O2 KO2 RbO2 CsO2 BeO MgO CaO SrO Ba2O2 Gc2-706-18.12 Li2O Na2O2 KO2 (1) 与氧、硫、氮、卤素反应,形成相应的化合物 2.单质的化学性质 镁 带 的 燃 烧 你能发现这些氧化物的形式有 什么不同?

为什么在空气中燃烧碱金属 所得的产物不同? 该问题可以从以下几个方面讨论: 燃烧产物可从燃烧反应的能量变化中推测.哪一个燃烧反应的 DG负值最大,产物就是哪一个.例如,Na生成Na20、Na2O2 和NaO2的DG分别是-376 kJ.mol-1,-430kJmo1和-389.2 kJmo1,因此然烧产物就是Na2O2. 2 △G的大小则由△,Gm=△,Hm-T△,Sm决定.其中嫡变一般对 DG的贡献比较小,△G的大小主要由△,Hm来决定.△,Hm则要 由设计的Borm-Haber循环来决定.而循环中的晶格能值的大小 对整个反应能否进行及产物稳定性关系重大, 3. 晶格能又正比于阴、阳离子电荷的乘积,反比于阴、阳离子的 距离.这样就要求阴、阳离子具备一定的“匹配”条件,产生 最好的能量效应.此即所谓的“大大,小小”规则.请参看第 二章有关内容
该问题可以从以下几个方面讨论: 1. 燃烧产物可从燃烧反应的能量变化中推测. 哪一个燃烧反应的 DG负值最大,产物就 是哪一个. 例如,Na 生成Na2O、Na2O2 和 NaO2的DG 分别是 -376 kJ·mol -1 , -430 kJ·mol -1和 –389.2 kJ·mol -1 , 因此燃烧产物就是 Na2O2 . 2. DG 的大小则由 决定. 其中熵变一般对 DG的贡献比较小, DG的大小主要由D r Hm来决定. D r Hm则要 由设计的 Born-Haber 循环来决定. 而循环中的晶格能值的大小 对整个反应能否进行及产物稳定性关系重大. 3. 晶格能又正比于阴、阳离子电荷的乘积,反比于阴、阳离子的 距离. 这样就要求阴、阳离子具备一定的 “匹配” 条件,产生 最好的能量效应. 此即所谓的“大-大,小-小”规则. 请参看第 二章有关内容. D r Gm = D r Hm-T D r Sm 为什么在空气中燃烧碱金属 所得的产物不同? Question 1
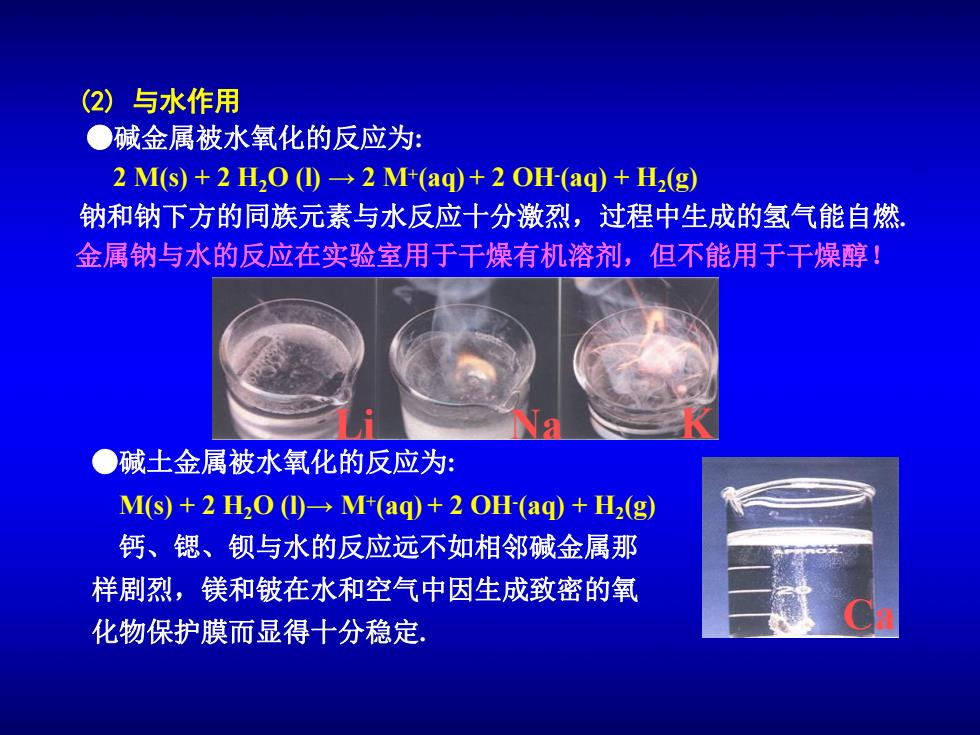
(2)与水作用 ●碱金属被水氧化的反应为: 2M(s)+2H0(①→2M(aq+2OH(aq)+H2(g) 钠和钠下方的同族元素与水反应十分激烈,过程中生成的氢气能自然 金属钠与水的反应在实验室用于干燥有机溶剂,但不能用于干燥醇! ●碱土金属被水氧化的反应为: M(s)+2 H2O(1 M+(aq)+2 OH-(aq)+H2(g) 钙、锶、钡与水的反应远不如相邻碱金属那 样剧烈,镁和铍在水和空气中因生成致密的氧 化物保护膜而显得十分稳定
(2) 与水作用 Ca Li Na K ●碱金属被水氧化的反应为: 2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g) 钠和钠下方的同族元素与水反应十分激烈,过程中生成的氢气能自燃. ●碱土金属被水氧化的反应为: M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g) 钙、锶、钡与水的反应远不如相邻碱金属那 样剧烈,镁和铍在水和空气中因生成致密的氧 化物保护膜而显得十分稳定. 金属钠与水的反应在实验室用于干燥有机溶剂,但不能用于干燥醇!