
生物化学实验室规则 1,每个同学都应该自觉遵守课棠纪律,维护课堂秩序,不迟到,不早退,不大声谈 笑。 2.实验前必须认真预习,熟悉本次实验的目的、原理、操作步骤,懂得每一操作步 骤的意义和了解所用仪器的使用方法,否则不能开始实验。 3.实验过程中要听从教师的指导,严肃认真地按操作规程进行实验,并把实验结果 和数据及时、如实记录在实验记录本上,文字要简练、准确。完成实验后经教师检查同意, 方可离开实验室。 4.实验台面应随时保持整洁,仪器、药品摆放整齐。公用试剂用完后,应立即盖严 放回原处。勿使试剂、药品洒在实验台面和地上。实验完毕,仪器洗净放好,将实验台面 抹拭干净,大能离开实验室。 5.使用仪器、药品、试剂和各物品必须注意节约。洗涤和使用仪器时,应小心仔细, 防止损坏仪器。使用贵重精密仪器时,应严格遵守操作规程,发现故障须立即报告教师, 不得擅自动手检修。 6.实验室内严禁吸烟!加热用的电炉应随用随关,严格做到:人在炉火在,人走炉 火关。乙醇、丙酮、乙醚等易燃品不能直接加热,并要远离火源操作和放置。实验完毕, 应立即拔去电炉开关和关好水笼头,拉下电闸。离开实验室以前应认真、负责地进行检查 水电,严防发生安全事故。 7.废液体可倒入水槽内,同时放水冲走。强酸、强碱溶液必须先用水稀释。废纸屑 及其他固体废物和带渣滓的废物倒入废品缸内:不能倒入水槽或到处乱扔。 8.要精心使用和爱护仪器,如使用分光光度计时,不能将比色杯直接置于分光光度 计上,并注意拿放比色杯时,不要打碎。仪器损坏时,应如实向教师报告,并填写损坏仪 器登记表,然后补领。 9.实验室内一切物品,未经本室负责教师批准,严禁带出室外,借物必须办理登记 手续 10.每次实验课由班长或课代表负责安排值日生。值日生的职责是负责当天实验室的 卫生、安全和一切服务性的工作
1 生物化学实验室规则 1.每个同学都应该自觉遵守课堂纪律,维护课堂秩序,不迟到,不早退,不大声谈 笑。 2.实验前必须认真预习,熟悉本次实验的目的、原理、操作步骤,懂得每一操作步 骤的意义和了解所用仪器的使用方法,否则不能开始实验。 3.实验过程中要听从教师的指导,严肃认真地按操作规程进行实验,并把实验结果 和数据及时、如实记录在实验记录本上,文字要简练、准确。完成实验后经教师检查同意, 方可离开实验室。 4.实验台面应随时保持整洁,仪器、药品摆放整齐。公用试剂用完后,应立即盖严 放回原处。勿使试剂、药品洒在实验台面和地上。实验完毕,仪器洗净放好,将实验台面 抹拭干净,才能离开实验室。 5.使用仪器、药品、试剂和各物品必须注意节约。洗涤和使用仪器时,应小心仔细, 防止损坏仪器。使用贵重精密仪器时,应严格遵守操作规程,发现故障须立即报告教师, 不得擅自动手检修。 6.实验室内严禁吸烟!加热用的电炉应随用随关,严格做到:人在炉火在,人走炉 火关。乙醇、丙酮、乙醚等易燃品不能直接加热,并要远离火源操作和放置。实验完毕, 应立即拨去电炉开关和关好水笼头,拉下电闸。离开实验室以前应认真、负责地进行检查 水电,严防发生安全事故。 7.废液体可倒入水槽内,同时放水冲走。强酸、强碱溶液必须先用水稀释。废纸屑 及其他固体废物和带渣滓的废物倒入废品缸内;不能倒入水槽或到处乱扔。 8.要精心使用和爱护仪器,如使用分光光度计时,不能将比色杯直接置于分光光度 计上,并注意拿放比色杯时,不要打碎。仪器损坏时,应如实向教师报告,并填写损坏仪 器登记表,然后补领。 9.实验室内一切物品,未经本室负责教师批准,严禁带出室外,借物必须办理登记 手续。 10.每次实验课由班长或课代表负责安排值日生。值日生的职责是负责当天实验室的 卫生、安全和一切服务性的工作

实验记录及实验报告 每次实验要做到课前认真预习,实验操作中仔细观察并如实记录实验现象与数据,课 后及时完成实验报告。 、课前预习 实验课前要将实验名称、目的和要求、实验内容与原理、操作方法和步骤等简单扼要 地写在记录本中,做到心中有数。 二、实验记录 从实验课开始就要培养严谨科学作风,养成良好习惯。实验条件下观察到的现象应仔 细地记录下来,实验中观测的每个结果和数据都应及时如实地直接记在记录本上,记录时 必须使用钢笔或圆珠笔,并做到原始记录准确、简练、详尽、清 。如称量试材样品的重 量、滴定管的读数、分光光度计的读数等,都应设计一定的表格准确记下正确的读数,并 根据仪器的精确度准确记录有效数字。例如,光密度值为0.050,不应写成0.05。每一个 结果至少要重复观测两次以上,当符合实验要求并确知仪器工作正常后再写在记录本上。 另外,实验中使用仪器的类型、编号以及试剂的规格、化学式、分子量、准确的浓度等, 都应记录清楚,以便总结实验完成报告时进行核对和作为查找成败原因的参考依据。如果 发现记录的结果有怀疑、遗满、丢失等,都必须重做实验。 三、实验报告 实验结束后,应及时整理和总结实验结果,写出实验报告。按照实验内容可分为定性 和定量两大类,实验报告的格式:实验序号,实验名称: (1)目的和要求 (2)内容与原理 (3)主要仪器及试剂配制 (4)操作方法与实验步骤 (5)结果与讨论 定性实验报告中的实验名称和目的要求是针对该次实验课的全部内容而必须达到的 目的和要求。在完成实验报告时,可以按照实验内容分别写原 、操作方法、结果与讨论 等。原理部分应简述基本原理。操作方法(或步骤)可以流程简图的方式或自行设计的表 格来表示。结果与讨论包括实验结果及观察现象的小结、对实验课遇到的问题和思考题进 行探讨以及对实验的改进意见等。 定量实验报告中,目的和要求、原理以及操作方法部分应简单扼要的叙述,但是对于 实验条件(试剂配制及仪器)和操作的关键环节必须写清楚。对于实验结果部分,应根掘 实验课的要求将一定实验条件下获得的实验结果和数据进行整理、归纳、分析和对比,并 尽量总结成各种图表,如原始数据及其处理的表格、标准曲线图以及比较实验组与对照组 实验结果的图表等。另外,还应针对实验结果进行必要的说明和分析。讨论部分可以包括: 关于实验方法(或操作技术)和有关实验的一些问题,如实验的正常结果和异常现象以及 思考题进行探讨,对于实验设计的认识、体会和建议,对实验课的改进意见等
2 实验记录及实验报告 每次实验要做到课前认真预习,实验操作中仔细观察并如实记录实验现象与数据,课 后及时完成实验报告。 一、课前预习 实验课前要将实验名称、目的和要求、实验内容与原理、操作方法和步骤等简单扼要 地写在记录本中,做到心中有数。 二、实验记录 从实验课开始就要培养严谨科学作风,养成良好习惯。实验条件下观察到的现象应仔 细地记录下来,实验中观测的每个结果和数据都应及时如实地直接记在记录本上,记录时 必须使用钢笔或圆珠笔,并做到原始记录准确、简练、详尽、清楚。如称量试材样品的重 量、滴定管的读数、分光光度计的读数等,都应设计一定的表格准确记下正确的读数,并 根据仪器的精确度准确记录有效数字。例如,光密度值为 0.050,不应写成 0.05。每一个 结果至少要重复观测两次以上,当符合实验要求并确知仪器工作正常后再写在记录本上。 另外,实验中使用仪器的类型、编号以及试剂的规格、化学式、分子量、准确的浓度等, 都应记录清楚,以便总结实验完成报告时进行核对和作为查找成败原因的参考依据。如果 发现记录的结果有怀疑、遗漏、丢失等,都必须重做实验。 三、实验报告 实验结束后,应及时整理和总结实验结果,写出实验报告。按照实验内容可分为定性 和定量两大类,实验报告的格式:实验序号,实验名称; (1)目的和要求 (2)内容与原理 (3)主要仪器及试剂配制 (4)操作方法与实验步骤 (5)结果与讨论 定性实验报告中的实验名称和目的要求是针对该次实验课的全部内容而必须达到的 目的和要求。在完成实验报告时,可以按照实验内容分别写原理、操作方法、结果与讨论 等。原理部分应简述基本原理。操作方法(或步骤)可以流程简图的方式或自行设计的表 格来表示。结果与讨论包括实验结果及观察现象的小结、对实验课遇到的问题和思考题进 行探讨以及对实验的改进意见等。 定量实验报告中,目的和要求、原理以及操作方法部分应简单扼要的叙述,但是对于 实验条件(试剂配制及仪器)和操作的关键环节必须写清楚。对于实验结果部分,应根据 实验课的要求将一定实验条件下获得的实验结果和数据进行整理、归纳、分析和对比,并 尽量总结成各种图表,如原始数据及其处理的表格、标准曲线图以及比较实验组与对照组 实验结果的图表等。另外,还应针对实验结果进行必要的说明和分析。讨论部分可以包括: 关于实验方法(或操作技术)和有关实验的一些问题,如实验的正常结果和异常现象以及 思考题进行探讨,对于实验设计的认识、体会和建议,对实验课的改进意见等

碳水化合物 实验一还原糖和总糖的测定 3,5-二硝基水杨酸比色法 一、目的 紫握还原糖和总糖测定的基本原理,学习出色法定还原糖的操作方法和分光光度计 的使用。 二、原理 还原糖的测定是糖定量测定的基本方法。还原糖是指含有自由醛基或酮基的糖类,单 糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是 利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取 没有还 可用酸水解法使其降解成有还原性的单糖进行测定,再分别求 出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。 还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5二硝基水杨酸则被还原为棕 红色的3氨基5-硝基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比 关系,利用分光光度计,在540m波长下测定光密度值,查对标准曲线并计算,便可求出 样品中还原糖和总糖的含量。由于多糖水解为单糖时,每斯裂 一个糖苷键需加入一分子水 所以在计算多糖含量时应乘以0.9。 COOH COOH H OH 加热 还原糖 碱性 +糖酸 NO2 02N NH2 3,5二硝基水杨酸(黄色) 3-氨基-5-硝基水杨酸(棕红色) 三、实验材料、主要仪器和试剂 1.实验材料 小麦面粉:精密pH试纸 2.主要仪器 (1)具塞玻璃刻度试管:20mL11 (2)大离心管:50m (3)烧杯:100mL】 (4)三角瓶:100mL1
3 碳水化合物 实验一 还原糖和总糖的测定 3,5-二硝基水杨酸比色法 一、目的 掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计 的使用。 二、原理 还原糖的测定是糖定量测定的基本方法。还原糖是指含有自由醛基或酮基的糖类,单 糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是 非还原糖。利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对 没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求 出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。 还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕 红色的 3-氨基-5-硝基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比 关系,利用分光光度计,在 540nm 波长下测定光密度值,查对标准曲线并计算,便可求出 样品中还原糖和总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水, 所以在计算多糖含量时应乘以 0.9。 COOH OH O2N NO2 3,5-二硝基水杨酸(黄色) 还原糖 COOH OH O2N NH2 加 热 碱 性 糖 酸 3-氨基-5-硝基水杨酸(棕红色) + + 三、实验材料、主要仪器和试剂 1. 实验材料 小麦面粉;精密 pH 试纸。 2. 主要仪器 (1)具塞玻璃刻度试管:20mL 11 (2)大离心管:50mL 2 (3)烧杯:100mL 1 (4)三角瓶:100mL 1

(5)容量瓶:100mL3 (6)刻度吸管:1mL1:2mL2:10mL1 (7)恒温水浴锅 (8)沸水浴 (9)离心机 (10)扭力天平 (11)分光光度计 3.试剂 (1)1mgmL葡萄糖标准液 准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后, 转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。 (2)3,5.二硝基水杨酸(DNS)试剂 将63gDNS和262mL2 M NaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液 中,再加5g结品酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于标 色瓶中备用 (3)碘-碘化钾溶液:称取5g碘和10g碘化钾,溶于100mL蒸馏水中。 (4)酚酞指示剂:称取0.1g酚酞,溶于250mL70%乙醇中。 (5)6MHC1和6 M NaOH各100mL。 四、操作步骤 1.制作葡萄糖标准曲线 取7支20mL具塞刻度试管编号,按表1分别加入浓度为1mgmL的葡萄糖标准液、 蒸馏水和3,5二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。 表1葡萄糖标准曲线制作 管号 1mgmL葡萄糖标准液 蒸馏水 DNS 葡萄糖含量 光密度值 (mL) (mL) (mL) (mg) (ODs40m) 0 0 2 1.5 0 1 0.2 1.8 1.5 0.2 0.4 1.5 0.4 3 0.6 1.4 1.5 0.6 0.8 12 1.5 0.8 5 1.0 1.0 1.5 1.0 6 12 0.8 15 12 将各管摇匀,在沸水浴中准确加热5min,取出,冷却至室温,用蒸馏水定容至20mL, 加寨后颠倒混匀,在分光光度计上进行比色。调波长540m,用0号管调零点,测出16
4 (5)容量瓶:100mL 3 (6)刻度吸管:1mL 1;2mL 2;10mL 1 (7)恒温水浴锅 (8)沸水浴 (9)离心机 (10)扭力天平 (11)分光光度计 3. 试剂 (1)1mg/mL 葡萄糖标准液 准确称取 80℃烘至恒重的分析纯葡萄糖 100mg,置于小烧杯中,加少量蒸馏水溶解后, 转移到 100mL 容量瓶中,用蒸馏水定容至 100mL,混匀,4℃冰箱中保存备用。 (2)3,5-二硝基水杨酸(DNS)试剂 将 6.3g DNS 和 262mL 2M NaOH 溶液,加到 500mL 含有 185g 酒石酸钾钠的热水溶液 中,再加 5g 结晶酚和 5g 亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至 1000mL,贮于棕 色瓶中备用。 (3)碘-碘化钾溶液:称取 5g 碘和 10g 碘化钾,溶于 100mL 蒸馏水中。 (4)酚酞指示剂:称取 0.1g 酚酞,溶于 250mL 70%乙醇中。 (5)6M HCl 和 6M NaOH 各 100mL。 四、操作步骤 1. 制作葡萄糖标准曲线 取 7 支 20mL 具塞刻度试管编号,按表 1 分别加入浓度为 1mg/mL 的葡萄糖标准液、 蒸馏水和 3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。 表 1葡萄糖标准曲线制作 管 号 1mg/mL 葡萄糖标准液 (mL) 蒸馏水 (mL) DNS (mL) 葡萄糖含量 (mg) 光密度值 (OD540nm) 0 0 2 1.5 0 1 0.2 1.8 1.5 0.2 2 0.4 1.6 1.5 0.4 3 0.6 1.4 1.5 0.6 4 0.8 1.2 1.5 0.8 5 1.0 1.0 1.5 1.0 6 1.2 0.8 1.5 1.2 将各管摇匀,在沸水浴中准确加热 5min,取出,冷却至室温,用蒸馏水定容至 20mL, 加塞后颠倒混匀,在分光光度计上进行比色。调波长 540nm,用 0 号管调零点,测出 1~6
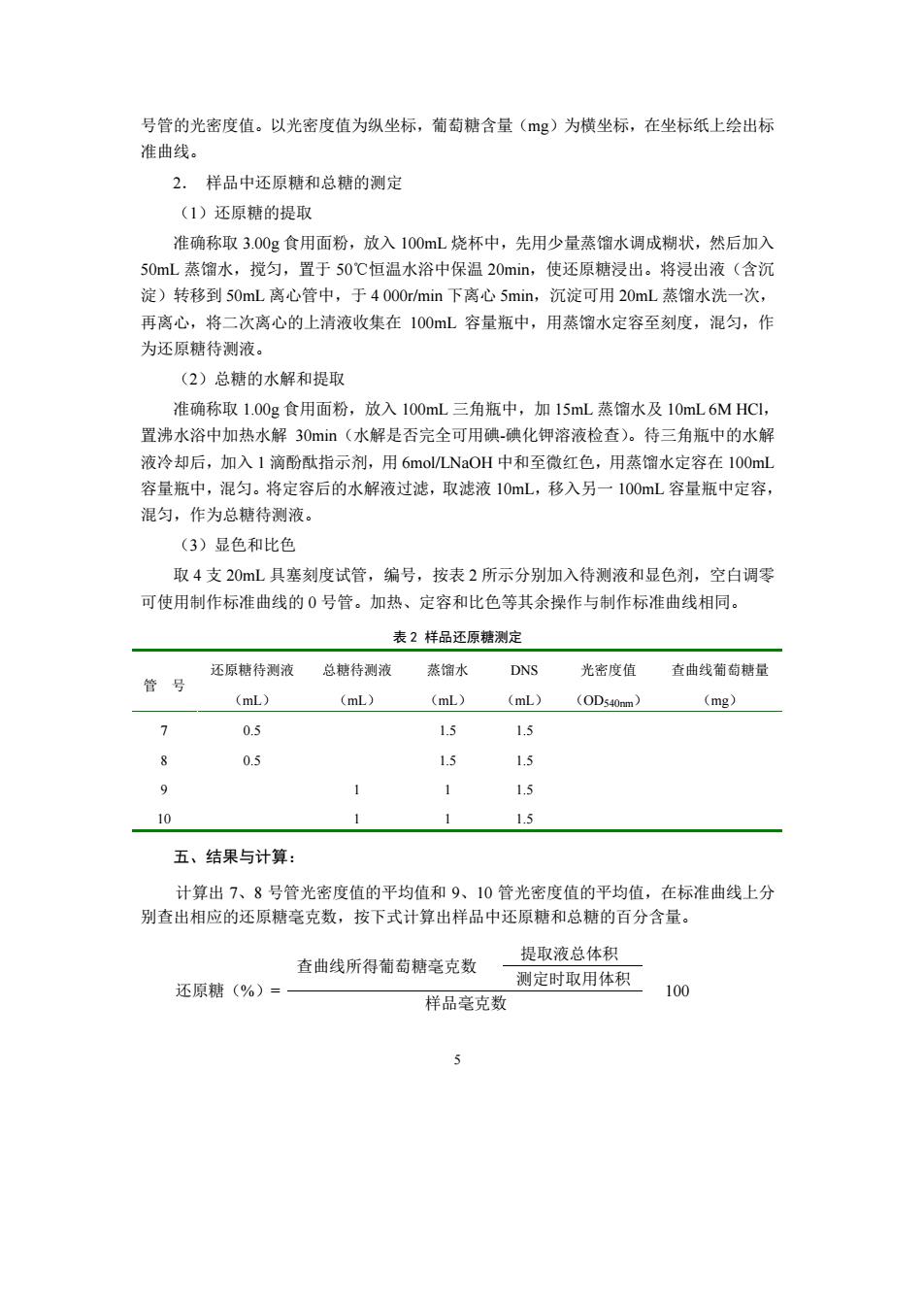
号管的光密度值。以光密度值为纵坐标,葡萄糖含量(g)为横坐标,在坐标纸上绘出标 曲线。 2.样品中还原糖和总糖的测定 (1)还原糖的提取 准确称取3.00g食用面粉,放入100mL烧杯中,先用少量蒸馏水调成糊状,然后加入 50mL蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。将浸出液(含沉 淀)转移到50mL离心管中,于4000rmin下离心5min,沉淀可用20mL蒸馏水洗一次, 再离心,将二次离心的上清液收集在100mL容量瓶中,用蒸馏水定容至刻度,混匀,作 为还原糖待测液。 (2)总糖的水解和提取 准确称取1.00g食用面粉,放入100mL三角瓶中,加15mL蒸馏水及10mL6MHCI 置沸水浴中加热水解30mn(水解是否完全可用碘-碘化钾溶液检查)。待三角瓶中的水解 液冷却后,加入1滴酚酞指示剂,用6 mol/LNaOH中和至微红色,用蒸馏水定容在100ml 容量瓶中,混匀。将定容后的水解液过滤,取滤液10mL,移入另一100mL容量瓶中定容, 混匀,作为总糖待测液。 (3)显色和比色 取4支20mL具塞刻度试管,编号,按表2所示分别加入待测液和显色剂,空白调零 可使用制作标准曲线的0号管。加热、定容和比色等其余操作与制作标准曲线相同。 表2样品还原糖测定 还原糖待测液总糖待测液蒸馏水DNS 查曲线萄萄糖量 管号 光密度值 (mL.) (mL) (mL) (mL)(0D540m) (mg) 03 0.5 1.5 9 1 1 1.5 10 1 15 五、结果与计算: 计算出7、8号管光密度值的平均值和9、10管光密度值的平均值,在标准曲线上分 别查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。 提取液总体积 查曲线所得葡萄糖毫克数 测定时取用体积 还原糖(%)= 样品毫克数 100
5 号管的光密度值。以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标 准曲线。 2. 样品中还原糖和总糖的测定 (1)还原糖的提取 准确称取 3.00g 食用面粉,放入 100mL 烧杯中,先用少量蒸馏水调成糊状,然后加入 50mL 蒸馏水,搅匀,置于 50℃恒温水浴中保温 20min,使还原糖浸出。将浸出液(含沉 淀)转移到 50mL 离心管中,于 4 000r/min 下离心 5min,沉淀可用 20mL 蒸馏水洗一次, 再离心,将二次离心的上清液收集在 100mL 容量瓶中,用蒸馏水定容至刻度,混匀,作 为还原糖待测液。 (2)总糖的水解和提取 准确称取 1.00g 食用面粉,放入 100mL 三角瓶中,加 15mL 蒸馏水及 10mL 6M HCl, 置沸水浴中加热水解 30min(水解是否完全可用碘-碘化钾溶液检查)。待三角瓶中的水解 液冷却后,加入 1 滴酚酞指示剂,用 6mol/LNaOH 中和至微红色,用蒸馏水定容在 100mL 容量瓶中,混匀。将定容后的水解液过滤,取滤液 10mL,移入另一 100mL 容量瓶中定容, 混匀,作为总糖待测液。 (3)显色和比色 取 4 支 20mL 具塞刻度试管,编号,按表 2 所示分别加入待测液和显色剂,空白调零 可使用制作标准曲线的 0 号管。加热、定容和比色等其余操作与制作标准曲线相同。 表 2样品还原糖测定 管 号 还原糖待测液 (mL) 总糖待测液 (mL) 蒸馏水 (mL) DNS (mL) 光密度值 (OD540nm) 查曲线葡萄糖量 (mg) 7 0.5 1.5 1.5 8 0.5 1.5 1.5 9 1 1 1.5 10 1 1 1.5 五、结果与计算: 计算出 7、8 号管光密度值的平均值和 9、10 管光密度值的平均值,在标准曲线上分 别查出相应的还原糖毫克数,按下式计算出样品中还原糖和总糖的百分含量。 提取液总体积 查曲线所得葡萄糖毫克数 测定时取用体积 还原糖(%)= 样品毫克数 100

总糖(%)。查曲线所得水解后还职糖毫克数稀释倍数0910 样品毫克数 六、附注 1.离心时对称位置的离心管必须配平。 2。标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点和比色。 3.面粉中还原糖含量较少,计算总糖时可将其合并入多糖一起考虑。 七、思考题 1.3,5二硝基水杨酸比色法是如何对总糖进行测定的? 2.如何正确绘制和使用标准曲线? 参考答案 1.植物中的总糖包括单糖、寡糖和多糖,单糖是还原糖,可直接测定。而没有还原 性的寡糖和多糖,需用高浓度的酸在加热的条件下水解成有还原性的单糖,还原糖在碱性 条件下加热被氧化成糖酸及其它产物,3,5二硝基水杨酸则被还原为棕红色的3-氨基5- 基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成一定比例关系,利用分 光光度计,在540m波长下测定光密度值,查对标准曲线并计算,可求出样品中还原糖和 总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需要加入一分子水,所以在计算 多糖含量时应垂以09 2.标准曲线应在坐标纸上绘制,横坐标轴距坐标纸底边1.5~2cm,标示出刻度和葡萄 糖的毫克数:纵坐标轴距坐标纸左边1.5~2cm,标示刻度和光密度值:曲线为过原点的直 线,测定点均匀分布在直线的两侧:标准曲线只能在测试条件完全相同的情况下,用于确 定样品中的物质含量。对于重复的测定,应取吸光度的平均值查标准曲线:测定数据不应 记在标准曲线上。 (任大明)
6 六、附 注 1. 离心时对称位置的离心管必须配平。 2. 标准曲线制作与样品测定应同时进行显色,并使用同一空白调零点和比色。 3. 面粉中还原糖含量较少,计算总糖时可将其合并入多糖一起考虑。 七、思考题 1.3,5-二硝基水杨酸比色法是如何对总糖进行测定的? 2.如何正确绘制和使用标准曲线? 参考答案 1.植物中的总糖包括单糖、寡糖和多糖,单糖是还原糖,可直接测定。而没有还原 性的寡糖和多糖,需用高浓度的酸在加热的条件下水解成有还原性的单糖,还原糖在碱性 条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的 3-氨基-5-硝 基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成一定比例关系,利用分 光光度计,在 540nm 波长下测定光密度值,查对标准曲线并计算,可求出样品中还原糖和 总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需要加入一分子水,所以在计算 多糖含量时应乘以 0.9。 2.标准曲线应在坐标纸上绘制,横坐标轴距坐标纸底边 1.5~2cm,标示出刻度和葡萄 糖的毫克数;纵坐标轴距坐标纸左边 1.5~2cm,标示刻度和光密度值;曲线为过原点的直 线,测定点均匀分布在直线的两侧;标准曲线只能在测试条件完全相同的情况下,用于确 定样品中的物质含量。对于重复的测定,应取吸光度的平均值查标准曲线;测定数据不应 记在标准曲线上。 (任大明) 查曲线所得水解后还原糖毫克数 稀释倍数 总糖(%)= 样品毫克数 0.9 100

实验二还原糖含量测定砷钼酸比色法 一、目的 植物体内的还原触主要是简萄糖、果糖和麦芽糖。它们在植物体内的分布,不仅反映 植物体内碳水化合物的运转情况,而且也是合成其它成分碳架来源和呼吸作用的基质。此 外,水果、蔬菜中含糖量的多少,也是鉴定其品质的重要指标。其它碳水化合物,如淀粉 蔗糖等,经水解也生成还原糖。因此,测定还原糖的方法在研究植物体内生理生化变化和 测定植物体内碳水化合物方面都是很重要的。 二,原理 还原糖是具有羰基(>C-0)的糖 能将其它物质还原而其本身被氧化 (1)还原糖在碱性条件及有酒石酸钾钠存在下加热,可以定量地还原二价铜离子为 价铜离子,产生砖红色的氧化亚铜沉淀,其本身被氧化。具体反应如下: CuSO,2NaOH -Naz(SOa)+Cu(OH)2 HO-CH-COONa O-CH-COONa Cu(OH +2H,0 HO-CH-COOK O-CH-COOK CHO H-C-OH Cu -CH-COONa HO-C-H + O-CH-COOK H-C-OH +2H,0 H-C-OH CH2OH COOH 90+2H0- H-COONa +Cu20, HO-CH-COOK (2)氧化亚铜在酸性条件下,可将钼酸铵还原,还原型的钼酸铵再与砷酸氢二钠起作 用,生成一种蓝色复合物神钼蓝,其颜色深浅在一定范围内与还原糖的含量(即被还 原的C20量)成正比,用标准葡萄糖与砷钼酸作用,比色后做标准,就可测得样品还原 糖含量 CuO+H2SO4 Cu' 2Cu+Mo0,2+S0,2→2Cu2+蓝色复合物
7 实验二 还原糖含量测定 砷钼酸比色法 一、目的 植物体内的还原糖主要是葡萄糖、果糖和麦芽糖。它们在植物体内的分布,不仅反映 植物体内碳水化合物的运转情况,而且也是合成其它成分碳架来源和呼吸作用的基质。此 外,水果、蔬菜中含糖量的多少,也是鉴定其品质的重要指标。其它碳水化合物,如淀粉、 蔗糖等,经水解也生成还原糖。因此,测定还原糖的方法在研究植物体内生理生化变化和 测定植物体内碳水化合物方面都是很重要的。 二,原理; 还原糖是具有羰基(>C=O)的糖,能将其它物质还原而其本身被氧化。 (1) 还原糖在碱性条件及有酒石酸钾钠存在下加热,可以定量地还原二价铜离子为一 价铜离子,产生砖红色的氧化亚铜沉淀,其本身被氧化。具体反应如下: CuSO4 + 2NaOH Na2(SO4) + Cu(OH)2 HO―CH―COONa O―CH―COONa Cu(OH)2 + ∣ u ∣ + 2H2O HO―CH―COOK O―CH―COOK CHO H―C―OH ∣ O―CH―COONa HO―C―H Cu ∣ + ∣ + 2H2O O―CH―COOK H―C―OH ∣ H―C―OH ∣ CH2OH COOH ∣ HO―CH―COONa (CHOH)4 + 2 ∣ + Cu2O↓ ∣ HO―CH―COOK CH2OH (2)氧化亚铜在酸性条件下,可将钼酸铵还原,还原型的钼酸铵再与砷酸氢二钠起作 用,生成一种蓝色复合物 砷钼蓝,其颜色深浅在一定范围内与还原糖的含量(即被还 原的 Cu2O 量)成正比,用标准葡萄糖与砷钼酸作用,比色后做标准,就可测得样品还原 糖含量。 Cu2O + H2SO4 Cu + 2Cu + + MoO4 2- + SO4 2- 2Cu 2+ + 蓝色复合物

三、实验材料、主要仪器和试剂 1。实验材料 苹果、面粉等 2.主要仪器 (1)分光光度计 (2)水浴锅 (3)具塞刻度试管:20ml10 (4)刻度吸管:1mL1,2ml4,5ml3 (5)容量瓶:100mL2 (6)漏斗 (7)研体 3.试剂 (1)铜试剂: 4%CuS045H,(0 B、称取24g无水碳酸钠,用850mL水溶于大烧杯中,加入2g含4分子结品水的酒 石酸钾钠,待全溶(应加热)后加入碳酸氢钠16g,再加入120g无水硫酸钠(加热),全 溶及冷却后加水至900mL,沉淀1~2d,取上清液(要求严格时过滤)备用。 使用前将A与B按1:9混匀即可使用。 (2)钼酸试剂:25g钼酸铵(NH)6M0, ,4H,0溶于450mL蒸馏水中(加热浴 解,但温度接近150℃时易分解),待冷却后再加入21mL浓HS0,混匀。另将3g砷酸氢 二钠Na,Has047H,O)溶解于25mL蒸馏水中,然后加到钼酸铵溶液中,室温下放置于棕 色瓶中可长期使用。 (3)200ug/mL标准简萄糖原液:准确称取分折纯简萄糖200mg,溶解定容到 1000mL. 四、操作步骤 1.标准曲线的制作: 在一系列刻度试管中,分别加入200μg/mL标准葡萄糖0、0.1、0.2、0.3、0.4、0.5 及0.6mL,再顺序加入蒸馏水2、1.9、18、1.7、16、1.5及14mL,配成浓度分别为0、 10、20、30、40、50及60“gmL的系列萄萄糖溶液。每试管加入铜试剂2mL,混匀后沸 水浴中加热10min,立即冷却,再加入2mL砷钼酸试剂,振荡两分钟后稀释到20mL,用 分光光度计在620nm波长下比色,测其光密度OD62m(做一式两份)。 以糖浓度微克数为横坐标,光密度OD6om为纵坐标,绘制标准曲线。 2。植物样品中还原糖的提取: 将样品洗净,吸干其表面水分,切碎混匀,称取1g放入研钵中,加入约0.5g石英砂 磨成匀浆,加水将样品由玻璃漏斗神入1O0mL容量瓶中,加水达70~80mL,摇匀后置于 80C恒温水浴上浸提0.5h
8 三、实验材料、主要仪器和试剂 1.实验材料 苹果、面粉等 2.主要仪器 (1)分光光度计 (2)水浴锅 (3)具塞刻度试管:20mL 10 (4)刻度吸管:1 mL 1,2 mL 4,5 mL 3 (5)容量瓶:100 mL 2 (6)漏斗 (7)研钵 3.试剂 (1)铜试剂: A、4%CuSO4 5H2O B、称取 24g 无水碳酸钠,用 850mL 水溶于大烧杯中,加入 2g 含 4 分子结晶水的酒 石酸钾钠,待全溶(应加热)后加入碳酸氢钠 16g,再加入 120g 无水硫酸钠(加热),全 溶及冷却后加水至 900mL,沉淀 1~2d,取上清液(要求严格时过滤)备用。 使用前将 A 与 B 按 1∶9 混匀即可使用。 (2)砷钼酸试剂:25g 钼酸铵 (NH4)6Mo7O24 4H2O 溶于 450mL 蒸馏水中(加热溶 解,但温度接近 150℃时易分解),待冷却后再加入 21mL 浓 H2SO4混匀。另将 3g 砷酸氢 二钠(Na2HasO4 7H2O)溶解于 25mL 蒸馏水中,然后加到钼酸铵溶液中,室温下放置于棕 色瓶中可长期使用。 (3)200μg/mL 标准葡萄糖原液:准确称取分析纯葡萄糖 200mg,溶解定容到 1000mL。 四、操作步骤 1.标准曲线的制作: 在一系列刻度试管中,分别加入 200μg/mL 标准葡萄糖 0、0.1、0.2、0.3、0.4、0.5 及 0.6 mL,再顺序加入蒸馏水 2、1.9、1.8、1.7、1.6、1.5 及 1.4 mL,配成浓度分别为 0、 10、20、30、40、50 及 60μg/mL 的系列葡萄糖溶液。每试管加入铜试剂 2mL,混匀后沸 水浴中加热 10min,立即冷却,再加入 2mL 砷钼酸试剂,振荡两分钟后稀释到 20mL,用 分光光度计在 620nm 波长下比色,测其光密度 OD620nm(做一式两份)。 以糖浓度微克数为横坐标,光密度 OD620nm为纵坐标,绘制标准曲线。 2.植物样品中还原糖的提取: 将样品洗净,吸干其表面水分,切碎混匀,称取 1g 放入研钵中,加入约 0.5g 石英砂, 磨成匀浆,加水将样品由玻璃漏斗冲入 100mL 容量瓶中,加水达 70~80mL,摇匀后置于 80℃恒温水浴上浸提 0.5h

待上述样品冷却后,沉淀蛋白质,加入5%硫酸锌5mL,再慢慢滴入0.3mol/LBa(OH), 5mL,以沉淀蛋白质。振荡后静置,至上层出现清液后再加一滴Ba(OH)2,直至无白色沉 淀时,向容量瓶加水至刻度。 还原糖含量的测定 过滤上述已定容的样品液,取5mL滤液,再定容到1O0mL(此步视样品的含糖量而 定)。取已稀释的溶液2mL,与标准葡萄糖显色法相同:加铜试剂2mL,煮沸10min,加 砷钼酸试剂2mL,振荡2mL,定容到15ml,620nm波长下比色,记下光密度OD6a0m(至 少重复两次)。 五,结果计算 还原糖含量(%= G稀释液倍数 W10° 式中:G 从标准曲线上查得含糖量(μg) 样品重(g) 六、思考题 举例说明哪些是还原糖? 参考答案: 还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原 糖,其中果糖、乳糖和麦芽糖是还原糖,蔗糖、淀粉和纤维素等是非还原糖。 (任大明) 脂类 实验三脂肪碘值的测定 一、目的 掌握测定脂肪碘值的原理和操作方法,了解测定脂肪碘值的意义。 二、原理
9 待上述样品冷却后,沉淀蛋白质,加入 5%硫酸锌 5mL,再慢慢滴入 0.3mol/L Ba(OH)2 5mL,以沉淀蛋白质。振荡后静置,至上层出现清液后再加一滴 Ba(OH)2,直至无白色沉 淀时,向容量瓶加水至刻度。 3.还原糖含量的测定: 过滤上述已定容的样品液,取 5mL 滤液,再定容到 100mL(此步视样品的含糖量而 定)。取已稀释的溶液 2mL,与标准葡萄糖显色法相同:加铜试剂 2mL,煮沸 10min,加 砷钼酸试剂 2mL,振荡 2mL,定容到 15ml,620nm 波长下比色,记下光密度 OD620nm(至 少重复两次)。 五,结果计算 G 稀释液倍数 还原糖含量(%)= W 10 6 式中:G 从标准曲线上查得含糖量(μg) W 样品重(g) 六、思考题 举例说明哪些是还原糖? 参考答案: 还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原 糖,其中果糖、乳糖和麦芽糖是还原糖,蔗糖、淀粉和纤维素等是非还原糖。 (任大明) 脂 类 实验三 脂肪碘值的测定 一、目的 掌握测定脂肪碘值的原理和操作方法,了解测定脂肪碘值的意义。 二、原理

不饱和脂肪酸碳链上含有不饱和键,可与卤素(C,B,上)进行加成反应。不饱 和健数目越多,加成的卤素量也越多,通常以“碘值”表示。在一定条件下,每100g脂 肪所吸收碘的克数称为该脂肪的碘值古碘值越高,表明不饱和脂肪酸的含量越高,它是 鉴定和鉴别油脂的一个重要常数 碘与脂肪的加成反应很慢,而氯及溴与脂肪的加成反应快,但常有取代和氧化等副反 应。本实验使用Br进行碘值的测定,这种试剂稳定,测定的结果接近理论值。溴化碘(B) 的一部分与油脂的不饱和脂肪酸起加成作用,剩余部分与碘化钾作用放出碘,放出的碘用 硫代硫酸钠滴定。 加成反应: H HC=CH-+HB 释放碘: IBr+Kl-KBr+2 滴定: →2Nal+NaSO 实验时取样多少决定于油脂样品的碘值。可参考表1与表2: 表1样品最适量和碘值的关系 礁值(g)30以下 30-6060-100100-140140-160160-210 样品数(g) 约1.1 0.50.6 0.3-0.4 02-0.3 0.15-0260.130.15 作用时间(h) 0.5 0.5 0.5 1.0 1.0 1.0 表2几种油脂的碘值 名称 重麻子油鱼肝油 棉子油 花生油 猪油 牛油 值(g)175210 154170 104-110 85100 48-64 2541 三、试剂和器材 1.试剂 (1)溴化碘溶液 取12.2g碘,放入1500mL锥形瓶内,缓慢加入1000mL冰乙酸(99.5%),边加边 摇,同时略温热,使碘溶解。冷却后,加溴约3mL。 注意:所用冰乙酸不应含有还原性物质。检查方法:取2mL冰乙酸,加少许重铬酸 钾及硫酸,若呈绿色,则证明有还原性物质存在 (2)0.1molL标准硫代硫酸钠溶液 取结晶硫代硫酸钠50g,溶在经煮沸后冷却的蒸馏水(无C0,存在)中。添加硼砂
10 不饱和脂肪酸碳链上含有不饱和键,可与卤素(Cl2,Br2,I2)进行加成反应。不饱 和键数目越多,加成的卤素量也越多,通常以“碘值”表示。在一定条件下,每 100g 脂 肪所吸收碘的克数称为该脂肪的¡°碘值¡±。碘值越高,表明不饱和脂肪酸的含量越高,它是 鉴定和鉴别油脂的一个重要常数。 碘与脂肪的加成反应很慢,而氯及溴与脂肪的加成反应快,但常有取代和氧化等副反 应。本实验使用 IBr 进行碘值的测定,这种试剂稳定,测定的结果接近理论值。溴化碘(IBr) 的一部分与油脂的不饱和脂肪酸起加成作用,剩余部分与碘化钾作用放出碘,放出的碘用 硫代硫酸钠滴定。 加成反应: 释放碘: IBr + KI KBr + I2 滴定: I2 + 2NaS2O3 2 NaI + Na2S4O6 实验时取样多少决定于油脂样品的碘值。可参考表 1 与表 2: 表 1样品最适量和碘值的关系 碘 值(g) 30 以下 30~60 60~100 100~140 140~160 160~210 样品数(g) 约 1.1 0.5~0.6 0.3~0.4 0.2~0.3 0.15~0.26 0.13~0.15 作用时间(h) 0.5 0.5 0.5 1.0 1.0 1.0 表 2几种油脂的碘值 名 称 亚麻子油 鱼肝油 棉子油 花生油 猪 油 牛 油 碘 值(g) 175~210 154~170 104~110 85~100 48~64 25~41 三、试剂和器材 1.试剂 (1)溴化碘溶液 取 12.2g 碘,放入 1 500mL 锥形瓶内,缓慢加入 1 000mL 冰乙酸(99.5%),边加边 摇,同时略温热,使碘溶解。冷却后,加溴约 3mL。 注意:所用冰乙酸不应含有还原性物质。检查方法:取 2mL 冰乙酸,加少许重铬酸 钾及硫酸,若呈绿色,则证明有还原性物质存在。 (2)0.1mol/L 标准硫代硫酸钠溶液 取结晶硫代硫酸钠 50g,溶在经煮沸后冷却的蒸馏水(无 CO2 存在)中。添加硼砂 HC CH C C Br H I H + HBr