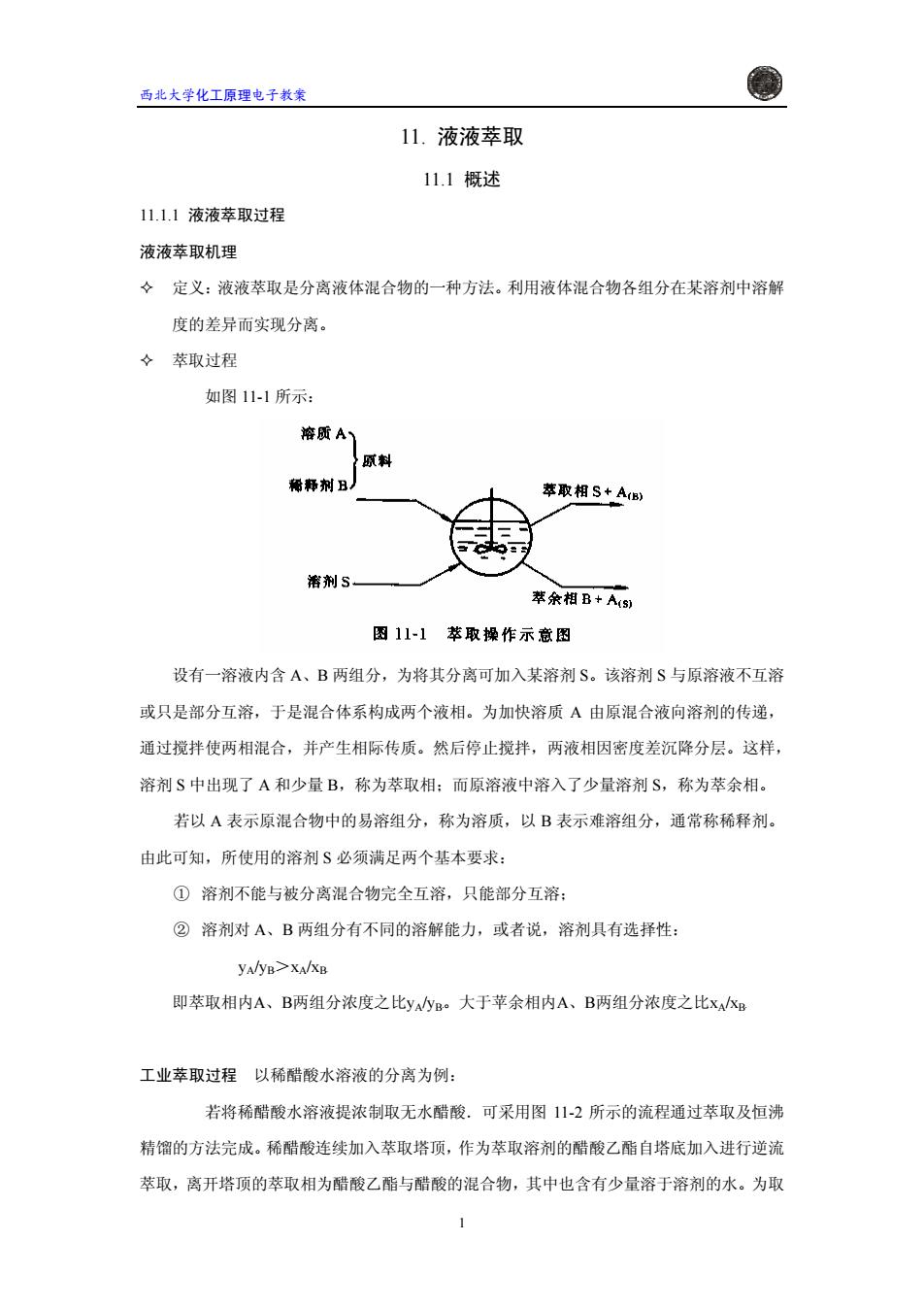
西北大学化工原理电子教案 11.液液萃取 11.1概述 11.1.1液液萃取过程 液液萃取机理 ◇定义:液液萃取是分离液体混合物的一种方法。利用液体混合物各组分在某溶剂中溶解 度的差异而实现分离。 女萃取过程 如图11-1所示: 溶质A、 原料 稀释剂B 萃取相S+AB) 溶剂S 萃余相B+A(s) 图11-1萃取操作示意图 设有一溶液内含A、B两组分,为将其分离可加入某溶剂S。该溶剂S与原溶液不互溶 或只是部分互溶,于是混合体系构成两个液相。为加快溶质A由原混合液向溶剂的传递, 通过搅拌使两相混合,并产生相际传质。然后停止搅拌,两液相因密度差沉降分层。这样, 溶剂S中出现了A和少量B,称为萃取相:而原溶液中溶入了少量溶剂S,称为萃余相。 若以A表示原混合物中的易溶组分,称为溶质,以B表示难溶组分,通常称稀释剂。 由此可知,所使用的溶剂S必须满足两个基本要求: ①溶剂不能与被分离混合物完全互溶,只能部分互溶: ②溶剂对A、B两组分有不同的溶解能力,或者说,溶剂具有选择性: yA/yB>XA/XB 即萃取相内A、B两组分浓度之比yayB。大于苹余相内A、B两组分浓度之比xAkg 工业萃取过程以稀醋酸水溶液的分离为例: 若将稀醋酸水溶液提浓制取无水醋酸.可采用图11-2所示的流程通过萃取及恒沸 精馏的方法完成。稀醋酸连续加入萃取塔顶,作为萃取溶剂的醋酸乙酯自塔底加入进行逆流 萃取,离开塔顶的萃取相为醋酸乙酯与醋酸的混合物,其中也含有少量溶于溶剂的水。为取
西北大学化工原理电子教案 11. 液液萃取 11.1 概述 11.1.1 液液萃取过程 液液萃取机理 定义:液液萃取是分离液体混合物的一种方法。利用液体混合物各组分在某溶剂中溶解 度的差异而实现分离。 萃取过程 如图 11-1 所示: 设有一溶液内含 A、B 两组分,为将其分离可加入某溶剂 S。该溶剂 S 与原溶液不互溶 或只是部分互溶,于是混合体系构成两个液相。为加快溶质 A 由原混合液向溶剂的传递, 通过搅拌使两相混合,并产生相际传质。然后停止搅拌,两液相因密度差沉降分层。这样, 溶剂 S 中出现了 A 和少量 B,称为萃取相;而原溶液中溶入了少量溶剂 S,称为萃余相。 若以 A 表示原混合物中的易溶组分,称为溶质,以 B 表示难溶组分,通常称稀释剂。 由此可知,所使用的溶剂 S 必须满足两个基本要求: ① 溶剂不能与被分离混合物完全互溶,只能部分互溶; ② 溶剂对 A、B 两组分有不同的溶解能力,或者说,溶剂具有选择性: yA/yB>B xA/xBB 即萃取相内A、B两组分浓度之比yA/yB。大于苹余相内 B A、B两组分浓度之比xA/xBB 工业萃取过程 以稀醋酸水溶液的分离为例: 若将稀醋酸水溶液提浓制取无水醋酸.可采用图 11-2 所示的流程通过萃取及恒沸 精馏的方法完成。稀醋酸连续加入萃取塔顶,作为萃取溶剂的醋酸乙酯自塔底加入进行逆流 萃取,离开塔顶的萃取相为醋酸乙酯与醋酸的混合物,其中也含有少量溶于溶剂的水。为取 1��
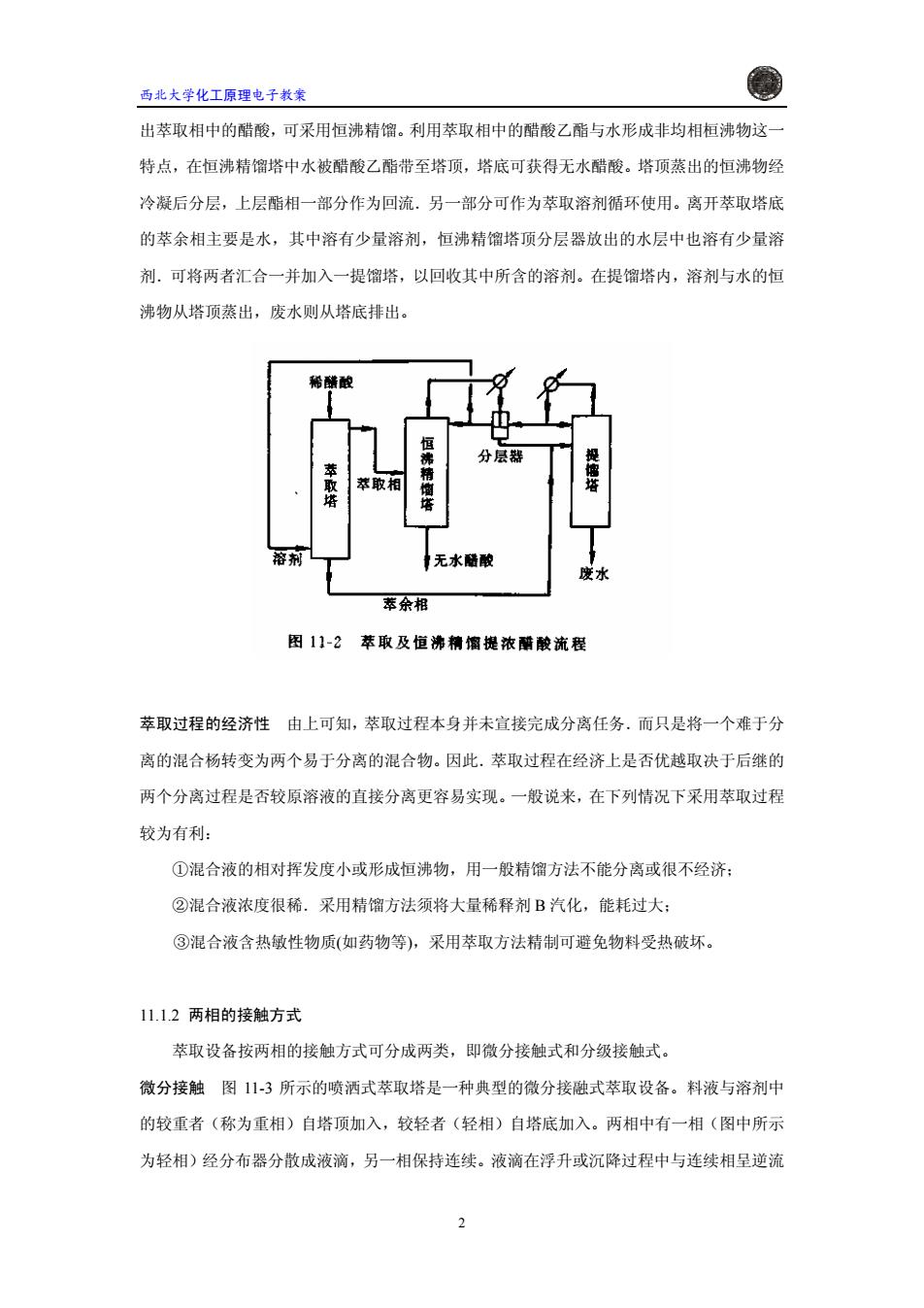
西北大学化工原理电子教案 出萃取相中的醋酸,可采用恒沸精馏。利用萃取相中的醋酸乙酯与水形成非均相桓沸物这一 特点,在恒沸精馏塔中水被醋酸乙酯带至塔顶,塔底可获得无水醋酸。塔顶蒸出的恒沸物经 冷凝后分层,上层酯相一部分作为回流.另一部分可作为萃取溶剂循环使用。离开萃取塔底 的萃余相主要是水,其中溶有少量溶剂,恒沸精馏塔顶分层器放出的水层中也溶有少量溶 剂.可将两者汇合一并加入一提馏塔,以回收其中所含的溶剂。在提馏塔内,溶剂与水的恒 沸物从塔顶蒸出,废水则从塔底排出。 稀醋酸 分层器 萃取塔 萃取相 精馆 提馆塔 溶剂 无水酷酸 废水 萃余相 图11-2萃取及恒沸精馏提浓醋酸流程 萃取过程的经济性由上可知,萃取过程本身并未宣接完成分离任务.而只是将一个难于分 离的混合杨转变为两个易于分离的混合物。因此.萃取过程在经济上是否优越取决于后继的 两个分离过程是否较原溶液的直接分离更容易实现。一般说来,在下列情况下采用萃取过程 较为有利: ①混合液的相对挥发度小或形成恒沸物,用一般精馏方法不能分离或很不经济: ②混合液浓度很稀.采用精馏方法须将大量稀释剂B汽化,能耗过大: ③混合液含热敏性物质(如药物等),采用萃取方法精制可避免物料受热破坏。 11.1.2两相的接触方式 萃取设备按两相的接触方式可分成两类,即微分接触式和分级接触式。 微分接触图11-3所示的喷洒式萃取塔是一种典型的微分接融式萃取设备。料液与溶剂中 的较重者(称为重相)自塔顶加入,较轻者(轻相)自塔底加入。两相中有一相(图中所示 为轻相)经分布器分散成液滴,另一相保持连续。液滴在浮升或沉降过程中与连续相呈逆流 2
西北大学化工原理电子教案 出萃取相中的醋酸,可采用恒沸精馏。利用萃取相中的醋酸乙酯与水形成非均相桓沸物这一 特点,在恒沸精馏塔中水被醋酸乙酯带至塔顶,塔底可获得无水醋酸。塔顶蒸出的恒沸物经 冷凝后分层,上层酯相一部分作为回流.另一部分可作为萃取溶剂循环使用。离开萃取塔底 的萃余相主要是水,其中溶有少量溶剂,恒沸精馏塔顶分层器放出的水层中也溶有少量溶 剂.可将两者汇合一并加入一提馏塔,以回收其中所含的溶剂。在提馏塔内,溶剂与水的恒 沸物从塔顶蒸出,废水则从塔底排出。 萃取过程的经济性 由上可知,萃取过程本身并未宣接完成分离任务.而只是将一个难于分 离的混合杨转变为两个易于分离的混合物。因此.萃取过程在经济上是否优越取决于后继的 两个分离过程是否较原溶液的直接分离更容易实现。一般说来,在下列情况下采用萃取过程 较为有利: ①混合液的相对挥发度小或形成恒沸物,用一般精馏方法不能分离或很不经济; ②混合液浓度很稀.采用精馏方法须将大量稀释剂 B 汽化,能耗过大; ③混合液含热敏性物质(如药物等),采用萃取方法精制可避免物料受热破坏。 11.1.2 两相的接触方式 萃取设备按两相的接触方式可分成两类,即微分接触式和分级接触式。 微分接触 图 11-3 所示的喷洒式萃取塔是一种典型的微分接融式萃取设备。料液与溶剂中 的较重者(称为重相)自塔顶加入,较轻者(轻相)自塔底加入。两相中有一相(图中所示 为轻相)经分布器分散成液滴,另一相保持连续。液滴在浮升或沉降过程中与连续相呈逆流 2

西北大学化工原理电子教案 接触进行物质传递,最后轻重两相分别从塔顶与塔底排出。 轻相出口 分层界面 料液 溶剂 相 混和器 沉降槽 轻相 轻相 重相出口 图11-3喷酒萃取培 图11-4单级混和沉降槽 级式接触级式萃取设备常采用混和沉降槽。图11-4为单级连续萃取装置,它包括混合器 和沉降槽两个部分,常称为混和沉降槽。料液和溶剂连续加入混合器,在搅拌浆作用下,一 相被分散成小液滴,均匀的分布于另一相中。自混和器流出的两相混合物在沉降槽内分层并 分别排出。 11.2液液相平衡衡 11.2.1三角形相图 溶液组成的表示方法在双组分溶液的萃取分离中,萃取相及萃余相一般都是三组分溶液。 表示三组分溶液的组成可用三角形相图。如图11-6所示的三角形范围内可表示任何三元溶 液的组成。三角形的三个顶点分别表示三个 纯组分,而三条边上的任何一点则表示相应 的双组分溶液。表示溶液组成的三角形图可 以是等腰的或等边的,也可以是非等腰的。 当萃取操作中溶质A的质量分数很低时, 7 常将AB边的比例放大,以提高图示的准确 度。 s 0.28s 0.4ys 0.6 .òS 物料衡算与杠杆定律设有组成为XA.XB.XS 图11-6溶液组成的表示法
西北大学化工原理电子教案 接触进行物质传递,最后轻重两相分别从塔顶与塔底排出。 级式接触 级式萃取设备常采用混和沉降槽。图 11-4 为单级连续萃取装置,它包括混合器 和沉降槽两个部分,常称为混和沉降槽。料液和溶剂连续加入混合器,在搅拌浆作用下,一 相被分散成小液滴,均匀的分布于另一相中。自混和器流出的两相混合物在沉降槽内分层并 分别排出。 11.2 液液相平衡 11.2.1 三角形相图 溶液组成的表示方法 在双组分溶液的萃取分离中,萃取相及萃余相一般都是三组分溶液。 表示三组分溶液的组成可用三角形相图。如图 11-6 所示的三角形范围内可表示任何三元溶 液的组成。三角形的三个顶点分别表示三个 纯组分,而三条边上的任何一点则表示相应 的双组分溶液。表示溶液组成的三角形图可 以是等腰的或等边的,也可以是非等腰的。 当萃取操作中溶质 A 的质量分数很低时, 常将 AB 边的比例放大,以提高图示的准确 度。 物料衡算与杠杆定律 设有组成为xA、xB、xS 3

西北大学化工原理电子教案 (R点)的溶液Rkg及组成为yA、yB、ys(E点)溶液Ekg,若将两溶液互相混合,形成的混 合物总量为Mkg,组成为zA、ZB、Zs,此组成可用图11-6总的M点表示。对该体系进行物料 衡算,可得衡算式如下: M-R+E MxA=RxA十EyA (11-2) Mgs=Rxs十E% 由此可以导出 景-头-君 (11-3) 式11-3表明,表示混合液组成的M点的位置必在R点与E点的联线上,且 线段RM与ME之比与混合前两溶液的质量成反比,即 E RM 反E羽 (11-4) 式(11-4)为物料街算的简捷图示方法,称为扛杆定律。根据杠杆定律,可较方便地在 图上定出M点的位置,从而确定混合液的组成。 混合物的和点与差点图11-6中的点M可表示溶液R与溶液E混合之后的数量与组成,称 为R、E两溶液的和点。反之,当从混合物M中移去一定量组成为E的液体,表示余下的 溶液组成的点R必在EM联线的延长线上,其具体位置同样可由杠杆定律确定: E/M=RM/RE (11-5) 因R点可表示余下溶液的数量和组成,故称为溶液M溶液E的差点。 11.2.2部分互溶物系的相平衡 萃取操作中的溶剂S必须与原溶液中的组分B不相溶或部分互溶。在全部操作范围内。 物系必包含以溶剂S为主的萃取相及组分B为主的萃余相。现讨论溶质A在此两相中的分 配,即当两相互成平衡时.溶质A在两相中的浓度关系。 萃取操作常按混合液中的A、B、S各组分互溶度的不同而将混合液分成两类: 第I类物系:溶质A可完全溶解于B及S中,而B、S为一对部分互溶的组分: 第Ⅱ类物系:溶质A、B可完全互溶,而B中,而B、S及A、S为两对部分互溶的组 分。 以下主要讨论第I类物系的液-液相平衡
西北大学化工原理电子教案 (R点)的溶液R kg及组成为yA、yB、B yS(E点)溶液E kg,若将两溶液互相混合,形成的混 合物总量为M kg,组成为zA、zBB、zS,此组成可用图 11-6 总的M点表示。对该体系进行物料 衡算,可得衡算式如下: 式(11-4)为物料街算的简捷图示方法,称为扛杆定律。根据杠杆定律,可较方便地在 图上定出 M 点的位置,从而确定混合液的组成。 混合物的和点与差点 图 11-6 中的点 M 可表示溶液 R 与溶液 E 混合之后的数量与组成,称 为 R、E 两溶液的和点。反之,当从混合物 M 中移去一定量组成为 E 的液体,表示余下的 溶液组成的点 R 必在 EM 联线的延长线上,其具体位置同样可由杠杆定律确定: E/M=RM/RE (11-5) 因 R 点可表示余下溶液的数量和组成,故称为溶液 M 溶液 E 的差点。 11.2.2 部分互溶物系的相平衡 萃取操作中的溶剂 S 必须与原溶液中的组分 B 不相溶或部分互溶。在全部操作范围内。 物系必包含以溶剂 S 为主的萃取相及组分 B 为主的萃余相。现讨论溶质 A 在此两相中的分 配,即当两相互成平衡时.溶质 A 在两相中的浓度关系。 萃取操作常按混合液中的 A、B、S 各组分互溶度的不同而将混合液分成两类: 第 I 类物系:溶质 A 可完全溶解于 B 及 S 中,而 B、S 为一对部分互溶的组分; 第Ⅱ类物系:溶质 A、B 可完全互溶,而 B 中,而 B、S 及 A、S 为两对部分互溶的组 分。 以下主要讨论第 I 类物系的液-液相平衡。 4

西北大学化工原理电子教案 溶解度曲线在三角形烧瓶中称取一定量的纯组分B,逐渐滴加溶剂S,不断摇动使其溶解。 由于B中仅能溶解少量溶剂S,故滴加至一定数量后混合液开始发生混浊,即出现了溶剂相。 记取所滴加的溶剂量,即为溶剂S在组分B中的饱和溶解度。此饱和溶解度可用直角三角 形相图(图11-8)中的点R表示.该点称为分层点。在上述溶液中滴加少量溶质A。溶质 的存在增加了B与S的互溶度,使混合液变成透明,此时混合液的组成在AR联线上的H 点。如再滴加数滴S,溶液再次呈现混浊,从而可算出新的分层点R1的组成,此R1必在 SH的联线上。 在溶液中文替滴加A与S,重复上述实验.可获得若干分层点R2、R3.等。同样.在 另一烧瓶中称取一定量的纯溶剂S,逐步滴加组分B可获得分层点E。再交替滴加溶质A 与B,亦可得若于分层点。将所有分层点联成一条光滑的曲线,称为溶解度曲线。因B、S 的互溶度与温度有关,上述全部实验均须在恒定温度下进行。 平衡联结线利用所获得的溶解度曲线。可以方便地确定溶质A在互成平衡的两液相中的 组成关系。现取组分B与溶剂S的双组分溶液,其组成以图11-9中的M1点表示,该溶液 必分为两层,其组成分别为E1和R1。 在此混合液中滴加少量溶质A。混合液的组 成将沿联线AM1移至点M2。 充分摇动,使溶质A在两相中的组成达到 平衡。静置分层后.取两相试样进行分析.其 11 R 1 组成分别在点E2、R2。互成平衡的两相称为共 H 扼相,E2、R2的联线称为平衡联结线,M2点 必在此平衡联结线上。 图11-8溶解度曲线 在上述两相混合液中逐次加入溶质A,重复上述实验,可得若干条平衡联结线,每一条 平衡联结线的两端为互成平衡的共扼相。 因11-9中溶解度曲线将三角形相图分成两个区。该曲线与底边R1EI所围的区域为分层 区或两相区,曲线以外是均相区。若某三组分物系的组成位于两相区内的M点,该混合液可 分为互成平衡的共扼相R及E,故溶解度曲线以内是萃取过程的可操作范围。 同一曲系的平衡联结线的倾斜方向一般相同。少数物系,在不同浓度范围内平衡联结线 的倾斜方向不同,图11-10所示的吡啶一氯苯一水系统即为一例。 5
西北大学化工原理电子教案 溶解度曲线 在三角形烧瓶中称取一定量的纯组分 B,逐渐滴加溶剂 S,不断摇动使其溶解。 由于 B 中仅能溶解少量溶剂 S,故滴加至一定数量后混合液开始发生混浊,即出现了溶剂相。 记取所滴加的溶剂量,即为溶剂 S 在组分 B 中的饱和溶解度。此饱和溶解度可用直角三角 形相图(图 11-8)中的点 R 表示.该点称为分层点。在上述溶液中滴加少量溶质 A。溶质 的存在增加了 B 与 S 的互溶度,使混合液变成透明,此时混合液的组成在 AR 联线上的 H 点。如再滴加数滴 S,溶液再次呈现混浊,从而可算出新的分层点 R1 的组成,此 R1 必在 SH 的联线上。 在溶液中文替滴加 A 与 S,重复上述实验.可获得若干分层点 R2、R3……等。同样.在 另一烧瓶中称取一定量的纯溶剂 S,逐步滴加组分 B 可获得分层点 E。再交替滴加溶质 A 与 B,亦可得若于分层点。将所有分层点联成一条光滑的曲线,称为溶解度曲线。因 B、S 的互溶度与温度有关,上述全部实验均须在恒定温度下进行。 平衡联结线 利用所获得的溶解度曲线。可以方便地确定溶质 A 在互成平衡的两液相中的 组成关系。现取组分 B 与溶剂 S 的双组分溶液,其组成以图 11-9 中的 M1 点表示,该溶液 必分为两层,其组成分别为 E1 和 R1。 在此混合液中滴加少量溶质 A。混合液的组 成将沿联线 AM1 移至点 M2。 充分摇动,使溶质 A 在两相中的组成达到 平衡。静置分层后.取两相试样进行分析.其 组成分别在点 E2、R2。互成平衡的两相称为共 扼相,E2、R2 的联线称为平衡联结线,M2 点 必在此平衡联结线上。 在上述两相混合液中逐次加入溶质 A,重复上述实验,可得若干条平衡联结线,每一条 平衡联结线的两端为互成平衡的共扼相。 因 11-9 中溶解度曲线将三角形相图分成两个区。该曲线与底边 R1EI 所围的区域为分层 区或两相区,曲线以外是均相区。若某三组分物系的组成位于两相区内的 M 点,该混合液可 分为互成平衡的共扼相 R 及 E,故溶解度曲线以内是萃取过程的可操作范围。 同一曲系的平衡联结线的倾斜方向一般相同。少数物系,在不同浓度范围内平衡联结线 的倾斜方向不同,图 11-10 所示的吡啶-氯苯-水系统即为一例。 5

西北大学化工原理电子教案 香 A(吡啶) 联结线 M R M: 图11-9平衡联结线 图11-10吡啶-氯苯-水系统的平衡联结线 相平衡关系的数学描述 由上可知,液液相平衡给出如下两种关系。 (1)分配曲线平衡联结线的两个端点表示液液平衡两相之间的组成关系。 A在两相中的平衡组成也可用下式表示: kA= 萃取相中A的质量分数=ya 萃余相中A的质量分数xA (11-6) k称为组分A的分配系数。同样,对组分B也可写出类似的表达式: kB=yp/XB (11-7) k称为组分B的分配系数。分配系数一般不是常数,其值随组成和温度而异。类似于气 (汽)液相平衡,可将组分A在液液平衡两相中的组成yA、XA之间的关系在直角坐标中表示, 如图11-12所示,该曲线称为分配曲线。图示的分配曲线可用 某种函数形式表示。即:ya=fxA)(I1-8) 此即为组分A的相平衡方程。由于实验的困难,直接获得 平衡两相的组成值其实验点数目有限,分配曲线是离散的。在 使用时,可采用各种内插方法以求得指定yA的平衡组成xA。 图11-12分配曲线 (2)溶解度曲线 临界混溶点右方的溶解度曲线表示平衡状态下萃取相中溶质yA与溶剂ys之间的关系, 即: yS=φ(yA) 类似地将临界混溶点左方的溶解度曲线表示为: XS=U(XA) 11.2.3液液相平衡与萃取操作的关系 溶剂的选择性系数同为单级萃取,若所用的溶剂能使萃取液与萃余液的溶质A含量差别 6
西北大学化工原理电子教案 相平衡关系的数学描述 由上可知,液液相平衡给出如下两种关系。 (1)分配曲线 平衡联结线的两个端点表示液液平衡两相之间的组成关系。 A 在两相中的平衡组成也可用下式表示: kA称为组分A的分配系数。同样,对组分B也可写出类似的表达式: kB=B yBB/xB (11-7) B kB称为组分B的分配系数。分配系数一般不是常数,其值随组成和温度而异。类似于气 (汽)液相平衡,可将组分A在液液平衡两相中的组成y B A、xA之间的关系在直角坐标中表示, 如图 11-12 所示,该曲线称为分配曲线。图示的分配曲线可用 某种函数形式表示。即:ya=f(xA) (11-8) 此即为组分A的相平衡方程。由于实验的困难,直接获得 平衡两相的组成值其实验点数目有限,分配曲线是离散的。在 使用时,可采用各种内插方法以求得指定yA的平衡组成xA。 (2)溶解度曲线 临界混溶点右方的溶解度曲线表示平衡状态下萃取相中溶质yA与溶剂ys之间的关系, 即: ys=φ(yA) 类似地将临界混溶点左方的溶解度曲线表示为: xs=ψ(xA) 11.2.3 液液相平衡与萃取操作的关系 溶剂的选择性系数 同为单级萃取,若所用的溶剂能使萃取液与萃余液的溶质 A 含量差别 6

西北大学化工原理电子教案 越大,则萃取效果越佳。溶质A在两液体中含量的差异可用选择性系数阝表示,其定义为: B=4/= ZA/Z8 kB (11-11) 在萃取液及萃余液中,y哈=1一y8,x8=1一xR,式(11-12)可写成 Bak y=1+(8-1)x (11-13) 可见,选择性系数阝相当于精馏操作中的相对挥发度。其值与平衡联结线的斜率有关。 当某一平衡联结线延长恰好通过S点,此时阝=1,这一对共扼相不能用萃取方法进行分离, 此种情况恰似精馏中的恒沸物。因此,萃取溶剂的选择应在操作范围内使选择性系数β>I。 当组分B不溶解于溶剂时,阝为无穷大。 11.3萃取过程计算 本节主要介绍级式萃取过程的计算。 11.3.1萃取级内过程的数学描述 和精馏过程一样,级式萃取过程的数学描述也应以每一个萃取级作为考察单元,即原则 上应对每一级写出物料衡算式,热量衡算式及表示级内传递过程的特征方程式。但是,物质 在两相之间传递所产生的热效应一般较小,萃取过程基本上是等温的,故无须作热量街算及 传热速率计算。只需对单一萃取级进行物料衡算即可。 在级式萃取设备内任取第级(从原料液入口端算起)作为考察对象,进、出该级的各物 料流量及组成如图11-17所示。对此萃取级作物料衡算可得: 总物料衡算式 Rm-1十Em+:=Rm十Em (11-14) 溶质A衡算式 R-IZm-1,A十E附+1ya+1.A=RnIm.A十Enym.A (11-15) 溶剂S衡算式 Rm-1xt-1.s十Em+1ym+1.s=Rmxm.s十Ewym.S (11-16) R-1小Xm-1A八=13 R清、不,A、工附,S Ea、yak、yn5 E。ya+1Ay=13 图11-17萃取级的物料衡算 >
西北大学化工原理电子教案 越大,则萃取效果越佳。溶质 A 在两液体中含量的差异可用选择性系数 β 表示,其定义为; 可见,选择性系数 β 相当于精馏操作中的相对挥发度。其值与平衡联结线的斜率有关。 当某一平衡联结线延长恰好通过 S 点,此时 β=l,这一对共扼相不能用萃取方法进行分离, 此种情况恰似精馏中的恒沸物。因此,萃取溶剂的选择应在操作范围内使选择性系数 β>I。 当组分 B 不溶解于溶剂时,β 为无穷大。 11.3 萃取过程计算 本节主要介绍级式萃取过程的计算。 11.3.1 萃取级内过程的数学描述 和精馏过程一样,级式萃取过程的数学描述也应以每一个萃取级作为考察单元,即原则 上应对每一级写出物料衡算式,热量衡算式及表示级内传递过程的特征方程式。但是,物质 在两相之间传递所产生的热效应一般较小,萃取过程基本上是等温的,故无须作热量街算及 传热速率计算。只需对单一萃取级进行物料衡算即可。 在级式萃取设备内任取第 m 级(从原料液入口端算起)作为考察对象,进、出该级的各物 料流量及组成如图 11-17 所示。对此萃取级作物料衡算可得: 7

西北大学化工原理电子教案 11.3.2单级萃取 单级萃取的解析计算单级萃取可以连续操作,也可以间歇操作。进、出萃取器的各股物料 与组成如图11-18a所示,则物料衡算式(11-14)至式(11-16)可表达为: F十S=R十E (11-20) FxFA十SzA=RxA十EyA (11-21) 0+Sxs=Rxs十Eys (11-22) 假设萃取器相当于一个理论级,离开该级的萃取相E与萃余相R成平衡,两 相的组成满足相平衡方程式(11-17)~式(11-19),即 ys=yA) (11-23) xs=中xA) (11-24) y=f(IA) (11-25) F,工A,x路=0 R.A Es 5,A E.yAys 图11-18单级萃取 在设计型问题中.料液流量F及组成XA、物系的相平衡数据为己知,萃余相溶质含量XA 由工艺要求所规定,可选择溶剂组成zA与zs(在回收溶剂中往往含有少量被分离组分A与B), 联立求解式(11-20)至式(11-25)可计算溶剂需用量$、萃取相流量E及其组成yA与ys、萃 余相流量R及及其中溶剂含量x共6个未知数。 在操作型问题中,原料及溶剂的流星和组成为己知,联立求解以上诸式,可以计算萃 取、萃余两相的流量和组成。 单级萃取的图解计算用解析方法计算萃取问题将溶解度曲线及分配曲线拟合成熟学表达 式,而且所得到的数学表达式皆为非线性b联立求解时必须通过试差逐步通近。但在三角形 相图上,采用图解的方法可以很方便地完成以上的求解步骤。 如图11-18b所示,图解计算时。可首先由规定的萃余相含量x4在溶解度曲线上找到萃余 相的组成点R,过点R用内插法作一平衡联结线丽与溶解度曲线相交,进而定出萃取相的组
西北大学化工原理电子教案 11.3.2 单级萃取 单级萃取的解析计算 单级萃取可以连续操作,也可以间歇操作。进、出萃取器的各股物料 与组成如图 11-18a 所示,则物料衡算式(11-14)至式(11-16)可表达为: 在设计型问题中.料液流量F及组成xFA、物系的相平衡数据为已知,萃余相溶质含量xA 由工艺要求所规定,可选择溶剂组成zA与zS (在回收溶剂中往往含有少量被分离组分A与B), 联立求解式(11-20)至式(11-25)可计算溶剂需用量S、萃取相流量E及其组成yA与yS、萃 余相流量R及及其中溶剂含量xA共 6 个未知数。 在操作型问题中,原料及溶剂的流星和组成为已知,联立求解以上诸式,可以计算萃 取、萃余两相的流量和组成。 单级萃取的图解计算 用解析方法计算萃取问题将溶解度曲线及分配曲线拟合成熟学表达 式,而且所得到的数学表达式皆为非线性 b 联立求解时必须通过试差逐步通近。但在三角形 相图上,采用图解的方法可以很方便地完成以上的求解步骤。 如图 11-18b所示,图解计算时。可首先由规定的萃余相含量xA在溶解度曲线上找到萃余 相的组成点R,过点R用内插法作一平衡联结线丽与溶解度曲线相交,进而定出萃取相的组 8

西北大学化工原理电子教案 成点E。然后根据己知的原料组成与溶剂组成,可以确定原料与溶剂的组成点F及$(图中所 示S点为纯溶剂)。 由物料衡算可知、进人萃取器的总物料量及其总组成应等于流出萃取器的总物料量及其 总组成。因此,总物料的组成点M必同时位于FS和RE两条联线上,即为两联线之交点。 根据杠杆定律,溶剂用量S与料液流量F之比为 S FM F-SM (11-26) 此比值称为溶剂比。根据溶剂比可由已知料液流量F求出溶剂流量S。 进入萃取器的总物料量与溶剂流量之和,即 M=F+S (11-27) 萃取相流量 E-M (11-28) 萃余相流量 R=M一E (11-29) 11.3.3多级错流萃取 为进一步降低萃余相中的溶质含量,可在上述单级萃取获得的萃余相中,再次加入新鲜 溶剂进行萃取,如此多次操作即为图11-20a所示的多级错流萃取。 多级错流萃取的计算只是单级萃取的多次重复。图11-20b表示了这一图解计算过程。 多级错流操作最终可得组分A含量很低的萃余相,但溶剂用量较多。 图11-20多级带流萃取 11.3.4多级逆流萃取 由于逆流操作的优越性,当料液中两个组分均为过程的产物,而且需要较完全地加以分 离时,一般均用多级逆流萃取。逆流操作可将萃余相溶质含量降至很低,同时在第1级出口 处所得到的萃取相中溶质A的含量亦较高。在级数足够多的情况下,多级逆流操作的最终 萃余相中A的最低含量受溶剂中A的含量及平衡条件所限制,而最终所得萃取相中A的最
西北大学化工原理电子教案 成点E。然后根据己知的原料组成与溶剂组成,可以确定原料与溶剂的组成点F及S(图中所 示S点为纯溶剂)。 由物料衡算可知、进人萃取器的总物料量及其总组成应等于流出萃取器的总物料量及其 总组成。因此,总物料的组成点 M 必同时位于 FS 和 RE 两条联线上,即为两联线之交点。 11.3.3 多级错流萃取 为进一步降低萃余相中的溶质含量,可在上述单级萃取获得的萃余相中,再次加入新鲜 溶剂进行萃取,如此多次操作即为图 11-20a 所示的多级错流萃取。 多级错流萃取的计算只是单级萃取的多次重复。图 11-20b 表示了这一图解计算过程。 多级错流操作最终可得组分 A 含量很低的萃余相,但溶剂用量较多。 11.3.4 多级逆流萃取 由于逆流操作的优越性,当料液中两个组分均为过程的产物,而且需要较完全地加以分 离时,一般均用多级逆流萃取。逆流操作可将萃余相溶质含量降至很低,同时在第 1 级出口 处所得到的萃取相中溶质 A 的含量亦较高。在级数足够多的情况下,多级逆流操作的最终 萃余相中 A 的最低含量受溶剂中 A 的含量及平衡条件所限制,而最终所得萃取相中 A 的最 9
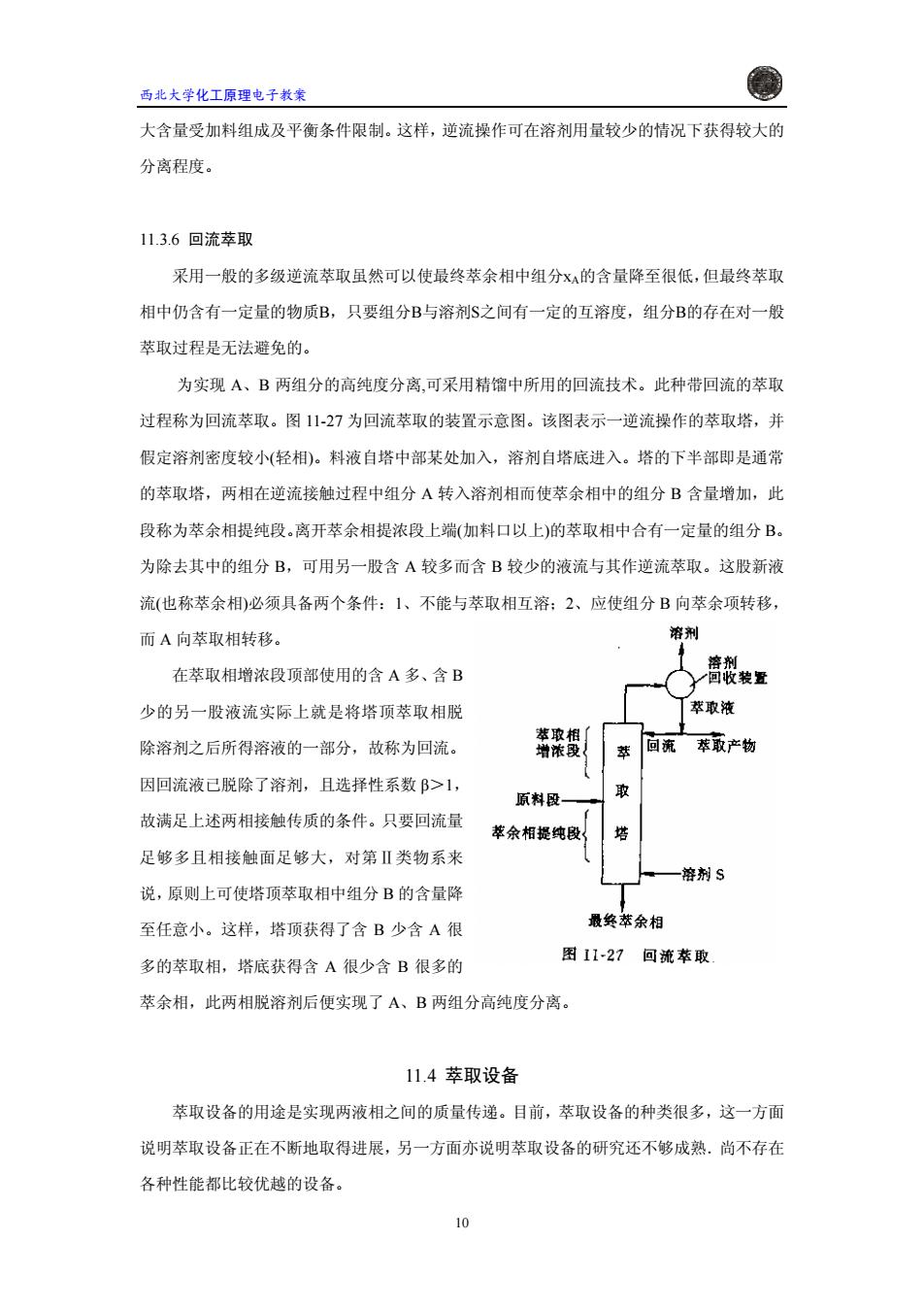
西北大学化工原理电子教案 大含量受加料组成及平衡条件限制。这样,逆流操作可在溶剂用量较少的情况下获得较大的 分离程度。 11.3.6回流萃取 采用一般的多级逆流萃取虽然可以使最终萃余相中组分X的含量降至很低,但最终萃取 相中仍含有一定量的物质B,只要组分B与溶剂$之间有一定的互溶度,组分B的存在对一般 萃取过程是无法避免的。 为实现A、B两组分的高纯度分离,可采用精馏中所用的回流技术。此种带回流的萃取 过程称为回流萃取。图11-27为回流萃取的装置示意图。该图表示一逆流操作的萃取塔,并 假定溶剂密度较小(轻相)。料液自塔中部某处加入,溶剂自塔底进入。塔的下半部即是通常 的萃取塔,两相在逆流接触过程中组分A转入溶剂相而使萃余相中的组分B含量增加,此 段称为萃余相提纯段。离开萃余相提浓段上瑞(加料口以上)的萃取相中合有一定量的组分B。 为除去其中的组分B,可用另一股含A较多而含B较少的液流与其作逆流萃取。这股新液 流(也称萃余相)必须具备两个条件:1、不能与萃取相互溶:2、应使组分B向萃余项转移, 而A向萃取相转移。 溶刑 溶剂 在萃取相增浓段顶部使用的含A多、含B 回收装置 少的另一股液流实际上就是将塔顶萃取相脱 萃取液 萃取相了 除溶剂之后所得溶液的一部分,故称为回流。 增浓段 萃 回流萃取产物 因回流液已脱除了溶剂,且选择性系数β>1, 原料段 取 故满足上述两相接触传质的条件。只要回流量 萃余相提纯段 塔 足够多且相接触面足够大,对第Ⅱ类物系来 溶剂S 说,原则上可使塔顶萃取相中组分B的含量降 至任意小。这样,塔顶获得了含B少含A很 最终萃余相 多的萃取相,塔底获得含A很少含B很多的 图11-27回流萃取 萃余相,此两相脱溶剂后便实现了A、B两组分高纯度分离。 11.4萃取设备 萃取设备的用途是实现两液相之间的质量传递。目前,萃取设备的种类很多,这一方面 说明萃取设备正在不断地取得进展,另一方面亦说明萃取设备的研究还不够成熟.尚不存在 各种性能都比较优越的设备。 o
西北大学化工原理电子教案 大含量受加料组成及平衡条件限制。这样,逆流操作可在溶剂用量较少的情况下获得较大的 分离程度。 11.3.6 回流萃取 采用一般的多级逆流萃取虽然可以使最终萃余相中组分xA的含量降至很低,但最终萃取 相中仍含有一定量的物质B,只要组分B与溶剂S之间有一定的互溶度,组分B的存在对一般 萃取过程是无法避免的。 为实现 A、B 两组分的高纯度分离,可采用精馏中所用的回流技术。此种带回流的萃取 过程称为回流萃取。图 11-27 为回流萃取的装置示意图。该图表示一逆流操作的萃取塔,并 假定溶剂密度较小(轻相)。料液自塔中部某处加入,溶剂自塔底进入。塔的下半部即是通常 的萃取塔,两相在逆流接触过程中组分 A 转入溶剂相而使萃余相中的组分 B 含量增加,此 段称为萃余相提纯段。离开萃余相提浓段上端(加料口以上)的萃取相中合有一定量的组分 B。 为除去其中的组分 B,可用另一股含 A 较多而含 B 较少的液流与其作逆流萃取。这股新液 流(也称萃余相)必须具备两个条件:1、不能与 而 A 向萃取相转移。 在萃取相增浓段顶部使用的含 萃取相互溶;2、应使组分 B 向萃余项转移, A 多、含 B 少的 11.4 萃取设备 萃取设备的用途是实现两液相之 前,萃取设备的种类很多,这一方面 说明 另一股液流实际上就是将塔顶萃取相脱 除溶剂之后所得溶液的一部分,故称为回流。 因回流液已脱除了溶剂,且选择性系数 β>1, 故满足上述两相接触传质的条件。只要回流量 足够多且相接触面足够大,对第Ⅱ类物系来 说,原则上可使塔顶萃取相中组分 B 的含量降 至任意小。这样,塔顶获得了含 B 少含 A 很 多的萃取相,塔底获得含 A 很少含 B 很多的 萃余相,此两相脱溶剂后便实现了 A、B 两组分高纯度分离。 间的质量传递。目 萃取设备正在不断地取得进展,另一方面亦说明萃取设备的研究还不够成熟.尚不存在 各种性能都比较优越的设备。 10