
第四章单克隆抗体 第四章单克隆抗体 单克隆抗体技术自1975年问世以来,在生命科学研究及临床医学诊断中发挥着越来越 重要的作用,每年与单克隆抗体相关的研究论文数以万计,生物产品数以千计,用于临床诊 断的单抗试剂日益增多。随着人类基因组计划的完成及蛋白质组计划的开始,单克隆抗体在 蛋白质功能研究、基因表达谱分析、临床疾病检测及治疗等方面的应用将更为广泛。本章主 要讨论鼠源性单克隆抗体制备的有关理论及在实际中经常碰到及需要注意的问题,并简述了 单克隆抗体技术的发展背景、原理和应用。单克隆抗体技术的问世,使免疫学研究迈向更高 和更精细的水平,单克隆抗体现已成为生物科学中最精细的探针之一。 第一节单克隆抗体的产生历史与原理 1975年Kohler和Milstein 以“分泌预定特异性抗体融合细胞的持续培养”(Continuous Culture of Fused Cells Secreting Antibody of Predefined Specificity)为题,在《自然》杂志首 次报道用仙台病毒使小鼠骨髓瘤细胞和经羊红细胞免疫的小鼠脾细胞融合产生的杂交瘤细 胞,既具有脾细胞分泌抗羊红细胞抗体的能力,又具有小鼠骨髓瘤细胞永生的特性,这一划 时代开创性工作翻开了人类利用杂交瘤抗体技术制备各类不同抗体广泛用于生命科学研究 及临床疾病诊断治疗的历史篇章,是生物技术发展史上的重要里程碑,Kohler和Milstein亦 因此获得1984年诺贝尔医学奖。 事实上在此之前,1970年Sinkovics等人已经报导过产生特异性病毒抗体的淋巴细胞和 由病毒引起的肿瘤细胞可以自然地在体内形成杂交瘤分泌特异性抗体。1973年Schwaber与 Coken首次报导了鼠一人杂交瘤的成功。1974年Bloom与Nakamura首次应用人的B细胞 与人的骨髓瘤细胞融合产生淋巴因子。以后于1980年Luben与Molle证明,在体外培养10 天的小鼠胸腺细胞能够产生淋巴因子,并能代替在体外培养中产生初次免疫(primary immunization,也称原发性免疫)反应所需要的免疫T细胞。他们应用这种胸腺细胞培养液 (称为条件培养液)加到小鼠脾细胞培养物中,并加入抗原(淋巴因子一破骨细胞激活因子) 刺激脾细胞产生免疫反应,随后用这种细胞与鼠骨髓瘤细胞杂交而产生破骨细胞激活因子的 单克隆抗体,建立了体外初次免疫反应,缩短了在体内免疫的时间。1978年Miller与Lipman 应用EB病毒转染人的B淋巴细胞产生单克隆抗体,使杂交瘤单克隆抗体技术向前迈进了一 步。 生物体产生抗体的最基本特点是抗体的多样性和不均质性,它们是针对众多不同抗原决 定簇(epitope)的混合性抗体。20世纪50年代以前对此现象一直没有满意的解释,1957年 Burnet创造性地提出了抗体产生的细胞系选择学说(即克隆选择学说),认为每个B细胞只 产生一种抗体,它以独特受体的形式存在于细胞表面,只能与一种抗原决定簇特异性地反应, 由此反应激活的这一淋巴细胞系,只能产生针对这一抗原决定簇的结构与功能完全相同的免 -49-
第四章 单克隆抗体 - 49 - 第四章 单克隆抗体 单克隆抗体技术自 1975 年问世以来,在生命科学研究及临床医学诊断中发挥着越来越 重要的作用,每年与单克隆抗体相关的研究论文数以万计,生物产品数以千计,用于临床诊 断的单抗试剂日益增多。随着人类基因组计划的完成及蛋白质组计划的开始,单克隆抗体在 蛋白质功能研究、基因表达谱分析、临床疾病检测及治疗等方面的应用将更为广泛。本章主 要讨论鼠源性单克隆抗体制备的有关理论及在实际中经常碰到及需要注意的问题,并简述了 单克隆抗体技术的发展背景、原理和应用。单克隆抗体技术的问世,使免疫学研究迈向更高 和更精细的水平,单克隆抗体现已成为生物科学中最精细的探针之一。 第一节 单克隆抗体的产生历史与原理 1975 年 Kohler 和 Milstein 以“分泌预定特异性抗体融合细胞的持续培养”(Continuous Culture of Fused Cells Secreting Antibody of Predefined Specificity)为题,在《自然》杂志首 次报道用仙台病毒使小鼠骨髓瘤细胞和经羊红细胞免疫的小鼠脾细胞融合产生的杂交瘤细 胞,既具有脾细胞分泌抗羊红细胞抗体的能力,又具有小鼠骨髓瘤细胞永生的特性,这一划 时代开创性工作翻开了人类利用杂交瘤抗体技术制备各类不同抗体广泛用于生命科学研究 及临床疾病诊断治疗的历史篇章,是生物技术发展史上的重要里程碑,Kohler 和 Milstein 亦 因此获得 1984 年诺贝尔医学奖。 事实上在此之前,1970 年 Sinkovics 等人已经报导过产生特异性病毒抗体的淋巴细胞和 由病毒引起的肿瘤细胞可以自然地在体内形成杂交瘤分泌特异性抗体。1973 年 Schwaber 与 Coken 首次报导了鼠-人杂交瘤的成功。1974 年 Bloom 与 Nakamura 首次应用人的 B 细胞 与人的骨髓瘤细胞融合产生淋巴因子。以后于 1980 年 Luben 与 Molle 证明,在体外培养 10 天的小鼠胸腺细胞能够产生淋巴因子,并能代替在体外培养中产生初次免疫(primary immunization,也称原发性免疫)反应所需要的免疫 T 细胞。他们应用这种胸腺细胞培养液 (称为条件培养液)加到小鼠脾细胞培养物中,并加入抗原(淋巴因子-破骨细胞激活因子) 刺激脾细胞产生免疫反应,随后用这种细胞与鼠骨髓瘤细胞杂交而产生破骨细胞激活因子的 单克隆抗体,建立了体外初次免疫反应,缩短了在体内免疫的时间。1978 年 Miller 与 Lipman 应用 EB 病毒转染人的 B 淋巴细胞产生单克隆抗体,使杂交瘤单克隆抗体技术向前迈进了一 步。 生物体产生抗体的最基本特点是抗体的多样性和不均质性,它们是针对众多不同抗原决 定簇(epitope)的混合性抗体。20 世纪 50 年代以前对此现象一直没有满意的解释,1957 年 Burnet 创造性地提出了抗体产生的细胞系选择学说(即克隆选择学说),认为每个 B 细胞只 产生一种抗体,它以独特受体的形式存在于细胞表面,只能与一种抗原决定簇特异性地反应, 由此反应激活的这一淋巴细胞系,只能产生针对这一抗原决定簇的结构与功能完全相同的免

第四章单克隆杭保 疫球蛋白(单克隆抗体)。随后,Nossal和edbers采用两种不同的抗原兔疫大白鼠,结果发 现,抗体生成细胞自始至终只能产生针对一个抗原的抗体,证明并支特了Bt的细胞系 选择学说。一个淋巴细胞只接受一个抗原决定族刺激及经刺激后扩增的淋巴细胞产生均一的 同质抗体,此即单克降抗体技术的理论基础。 制备单克隆抗体的基本过程是B细胞与骨髓瘤细胞的融合,在此基础上利用骨髓瘤细 胞的生化代谢缺陷在选择培养基中筛选培养,获得融合的杂交瘤细胞,因此,细胞融合和融 合细胞的筛选是杂交瘤抗体技术的基础,而理想的生化缺陷型骨髓瘤细胞系的建立是筛选融 合细胞的必需前提。一个浆细胞无限制增殖,导致产生一种均一的免疫球蛋白,称骨髓痴或 浆细胞瘤(plasmacytoma)。小鼠自发骨髓瘤极为罕见,需经人工诱导建立,1965年Sachs 等用矿物油刺激BALB/c小鼠诱生出骨髓瘤,并在体外培养成功,称为P3.1972年Milstein 等用8-杂氮鸟嘌呤(8-a2 guanine)对其进行诱导培养,从中筛选出缺乏次黄嘌吟.鸟嘌呤磷 酸核糖转移酶(hypoxanthine-guanine-,简称HGPRT)的新细胞系。 称为P3-X63-Ags。P3-X63-Ags因缺乏HGPRT而不能在HAT培养基中生长,但仍具分泌小 鼠1gGK轻链的能力,这显然不利于同B细胞融合后均一性抗体的产生。以后陆续诱导出的 一些新的突变株,如NS1,虽能合成K轻链,但无分泌能力,又如P3-X63-Ag8-653和SP20, 既不合成免疫球蛋白,也不分泌免疫球蛋白,从而保证了B细胞与骨髓瘤细胞融合后抗体 立生的均一性 细胞融合是杂交瘤抗体技术的基础。人们早就观察到在某些情况下或在体外培养中偶有 少数细胞可发生自发融合。早在1958年冈田等用高浓度的仙台病毒使小限艾氏腹水癌细胞 发生融合,其机制是病毒神经氨酸酶可降解细胞膜上的糖蛋白,使细胞膜局部凝集在病毒颗 粒的周用,在高pH及钙离子条件下,局部细胞质膜发生融合。1975年,Kao和Chavluk提 出用聚乙二醇作为细胞融合剂,其融合率较使用仙台病毒高出数百倍。目前己知的细胞融合 剂有数十种,而作为杂交瘤的融合剂主要是PG的行生物。EG是目前实验室制备杂交瘤 最常用的融合剂,其确切机制不清,可能因PEG的亲水性使细胞表面极性降低,导致脂双 层不稳定而引起细胞膜的融合。80年代末,Zimmermana报道了电融合技术,其原理是在电 场中沿电力线排列的细胞在高脉冲电场的作用下,细胞膜局部区域的双层脂分子结构遭到破 坏,出现微孔,细胞膜的通透性增加,继而产生相邻细胞的融合。电融合的融合率与PEG 相比有几何级数的增加,可减少B细胞的用量,如能利用一些亲和物质使B细胞与骨髓瘤 细胞在融合前配对接触,则可大大提高杂交细胞的产出率。 从上述不同技术及理论的发展历史可以看出,在20世纪70年代,免疫细胞的克隆选择 学说已被普遍接受,仙台病毒作为细胞融合剂已被成功使用,缺陷型小鼠骨髓瘤细胞系及融 合细胞的筛选方法均己建立,为单抗杂交瘤技术的出现奠定了理论及技术基础。1973年, Milstein等在研究抗体合成的遗传控制时,试图观察抗体合成的等位基因排斥规律能否在杂 交细胞上被打破。他们将大鼠的骨随瘤细胞和小鼠的骨随瘤细胞相融合,融合产生的杂交细 胞能分泌大鼠免疫球蛋白、小鼠免疫球蛋白和轻、重链分别来自大、小鼠两个亲代的杂交免 疫球蛋白,表明杂交细胞合成抗体不存在“等位基因排斥”现象,它们能共显地表达两个亲代 抗体信息。随后Kohler和Milstein用绵羊红细胞免疫小鼠,取脾淋巴细胞与小鼠骨随瘤细 胞P3-X63-Ag通过仙台病毒进行融合,然后于HAT培养基中选择培养,获得了能产生与绵 -50-
第四章 单克隆抗体 - 50 - 疫球蛋白(单克隆抗体)。随后,Nossal 和 edbers 采用两种不同的抗原免疫大白鼠,结果发 现,抗体生成细胞自始至终只能产生针对一个抗原的抗体,证明并支持了 Burnet 的细胞系 选择学说。一个淋巴细胞只接受一个抗原决定簇刺激及经刺激后扩增的淋巴细胞产生均一的 同质抗体,此即单克隆抗体技术的理论基础。 制备单克隆抗体的基本过程是 B 细胞与骨髓瘤细胞的融合,在此基础上利用骨髓瘤细 胞的生化代谢缺陷在选择培养基中筛选培养,获得融合的杂交瘤细胞,因此,细胞融合和融 合细胞的筛选是杂交瘤抗体技术的基础,而理想的生化缺陷型骨髓瘤细胞系的建立是筛选融 合细胞的必需前提。一个浆细胞无限制增殖,导致产生一种均一的免疫球蛋白,称骨髓瘤或 浆细胞瘤 (plasmacytoma)。小鼠自发骨髓瘤极为罕见,需经人工诱导建立,1965 年 Sachs 等用矿物油刺激 BALB/c 小鼠诱生出骨髓瘤,并在体外培养成功,称为 P3。1972 年 Milstein 等用 8-杂氮鸟嘌呤(8-azaguanine)对其进行诱导培养,从中筛选出缺乏次黄嘌呤-鸟嘌呤磷 酸核糖转移酶(hypoxanthine-guanine-phosphoribosyl transferase,简称 HGPRT)的新细胞系, 称为 P3-X63-Ags。P3-X63-Ags 因缺乏 HGPRT 而不能在 HAT 培养基中生长,但仍具分泌小 鼠 IgGκ轻链的能力,这显然不利于同 B 细胞融合后均一性抗体的产生。以后陆续诱导出的 一些新的突变株,如 NS1,虽能合成κ轻链,但无分泌能力,又如 P3-X63-Ag8-653 和 SP2/0, 既不合成免疫球蛋白,也不分泌免疫球蛋白,从而保证了 B 细胞与骨髓瘤细胞融合后抗体 产生的均一性。 细胞融合是杂交瘤抗体技术的基础。人们早就观察到在某些情况下或在体外培养中偶有 少数细胞可发生自发融合。早在 1958 年冈田等用高浓度的仙台病毒使小鼠艾氏腹水癌细胞 发生融合,其机制是病毒神经氨酸酶可降解细胞膜上的糖蛋白,使细胞膜局部凝集在病毒颗 粒的周围,在高 pH 及钙离子条件下,局部细胞质膜发生融合。1975 年,Kao 和 Chayluk 提 出用聚乙二醇作为细胞融合剂,其融合率较使用仙台病毒高出数百倍。目前已知的细胞融合 剂有数十种,而作为杂交瘤的融合剂主要是 PEG 的衍生物。PEG 是目前实验室制备杂交瘤 最常用的融合剂,其确切机制不清,可能因 PEG 的亲水性使细胞表面极性降低,导致脂双 层不稳定而引起细胞膜的融合。80 年代末,Zimmermana 报道了电融合技术,其原理是在电 场中沿电力线排列的细胞在高脉冲电场的作用下,细胞膜局部区域的双层脂分子结构遭到破 坏,出现微孔,细胞膜的通透性增加,继而产生相邻细胞的融合。电融合的融合率与 PEG 相比有几何级数的增加,可减少 B 细胞的用量,如能利用一些亲和物质使 B 细胞与骨髓瘤 细胞在融合前配对接触,则可大大提高杂交细胞的产出率。 从上述不同技术及理论的发展历史可以看出,在 20 世纪 70 年代,免疫细胞的克隆选择 学说已被普遍接受,仙台病毒作为细胞融合剂已被成功使用,缺陷型小鼠骨髓瘤细胞系及融 合细胞的筛选方法均已建立,为单抗杂交瘤技术的出现奠定了理论及技术基础。1973 年, Milstein 等在研究抗体合成的遗传控制时,试图观察抗体合成的等位基因排斥规律能否在杂 交细胞上被打破。他们将大鼠的骨髓瘤细胞和小鼠的骨髓瘤细胞相融合,融合产生的杂交细 胞能分泌大鼠免疫球蛋白、小鼠免疫球蛋白和轻、重链分别来自大、小鼠两个亲代的杂交免 疫球蛋白,表明杂交细胞合成抗体不存在“等位基因排斥”现象,它们能共显地表达两个亲代 抗体信息。随后 Kohler 和 Milstein 用绵羊红细胞免疫小鼠,取脾淋巴细胞与小鼠骨髓瘤细 胞 P3-X63-Ags 通过仙台病毒进行融合,然后于 HAT 培养基中选择培养,获得了能产生与绵

第四章单克隆杭体 羊红细胞特异结合的抗体的杂交细胞克隆。将这种杂交细胞注入同种小鼠腹腔内可形成肘 瘤,故称为杂交瘤。 单克隆抗体技术的主要优点:正如Milstein所说,首先,它是由一个独立的细胞克隆产 生的抗体,是一种十分明确的化学制品,而不是一种可随每个免疫动物,甚至同一动物不同 次免疫而变化的、不明确的非同质混合物,杂交细胞的永久培养可无限制地提供结构与性质 完全相同的单克降抗体:其次,该技术提供了用不纯抗原制备纯抗体的理想方法。因此单克 隆抗体技术一问世,就立即引起了生命科学研究领域的极大重视及广泛兴趣,相应技术迅速 在全球范围内得到了广泛的开展与应用,数以万计分泌单抗的杂交瘤细胞在实验室产生。 与此同时,杂交瘤技术也有了充分的发展,为适应临床应用的需要,杂交瘤细胞与B 淋巴细胞的隘合或杂交瘤细胞与杂交瘤细胞的融合以产生双功能抗体,鼠骨髓瘤细胞与人B 淋巴细胞的融合或人骨髓瘤细胞与人B淋巴细胞的融合以产生人单克降抗体的技术相继出 现。 1984年开始利用DNA重组技术改造鼠单克隆抗体使之人源化,以便降低在人体内应用 的免疫原性。 I989年出现的噬菌体展示抗体库(phage display antibody library)技术,使获得完全人 源的单克隆抗体成为可能。 而转基因小鼠(transgenetic mice)的出现把分子生物学技术与鼠单克隆抗体技术的结合 推向了顶峰,该技术将人抗体基因导入小鼠胚胎干细胞,使小鼠B淋巴细胞能产生人源抗 体,然后再经常规小鼠杂交瘤单克隆抗体技术制备人单克隆抗体,解决了用人B淋巴细胞 融合难以获得人单克隆抗体杂交瘤的难题。 毫无疑问,鼠单克隆抗体杂交瘤技术及在此基础上衍生出来的不同种类抗体制备技术, 在今后的生命科学研究中将发挥越来越多的作用。 图4-1是单克隆抗体的制备流程。 -51
第四章 单克隆抗体 - 51 - 羊红细胞特异结合的抗体的杂交细胞克隆。将这种杂交细胞注入同种小鼠腹腔内可形成肿 瘤,故称为杂交瘤。 单克隆抗体技术的主要优点:正如 Milstein 所说,首先,它是由一个独立的细胞克隆产 生的抗体,是一种十分明确的化学制品,而不是一种可随每个免疫动物,甚至同一动物不同 次免疫而变化的、不明确的非同质混合物,杂交细胞的永久培养可无限制地提供结构与性质 完全相同的单克隆抗体;其次,该技术提供了用不纯抗原制备纯抗体的理想方法。因此单克 隆抗体技术一问世,就立即引起了生命科学研究领域的极大重视及广泛兴趣,相应技术迅速 在全球范围内得到了广泛的开展与应用,数以万计分泌单抗的杂交瘤细胞在实验室产生。 与此同时,杂交瘤技术也有了充分的发展,为适应临床应用的需要,杂交瘤细胞与 B 淋巴细胞的融合或杂交瘤细胞与杂交瘤细胞的融合以产生双功能抗体,鼠骨髓瘤细胞与人 B 淋巴细胞的融合或人骨髓瘤细胞与人 B 淋巴细胞的融合以产生人单克隆抗体的技术相继出 现。 1984 年开始利用 DNA 重组技术改造鼠单克隆抗体使之人源化,以便降低在人体内应用 的免疫原性。 1989 年出现的噬菌体展示抗体库(phage display antibody library)技术,使获得完全人 源的单克隆抗体成为可能。 而转基因小鼠(transgenetic mice)的出现把分子生物学技术与鼠单克隆抗体技术的结合 推向了顶峰,该技术将人抗体基因导入小鼠胚胎干细胞,使小鼠 B 淋巴细胞能产生人源抗 体,然后再经常规小鼠杂交瘤单克隆抗体技术制备人单克隆抗体,解决了用人 B 淋巴细胞 融合难以获得人单克隆抗体杂交瘤的难题。 毫无疑问,鼠单克隆抗体杂交瘤技术及在此基础上衍生出来的不同种类抗体制备技术, 在今后的生命科学研究中将发挥越来越多的作用。 图 4-1 是单克隆抗体的制备流程
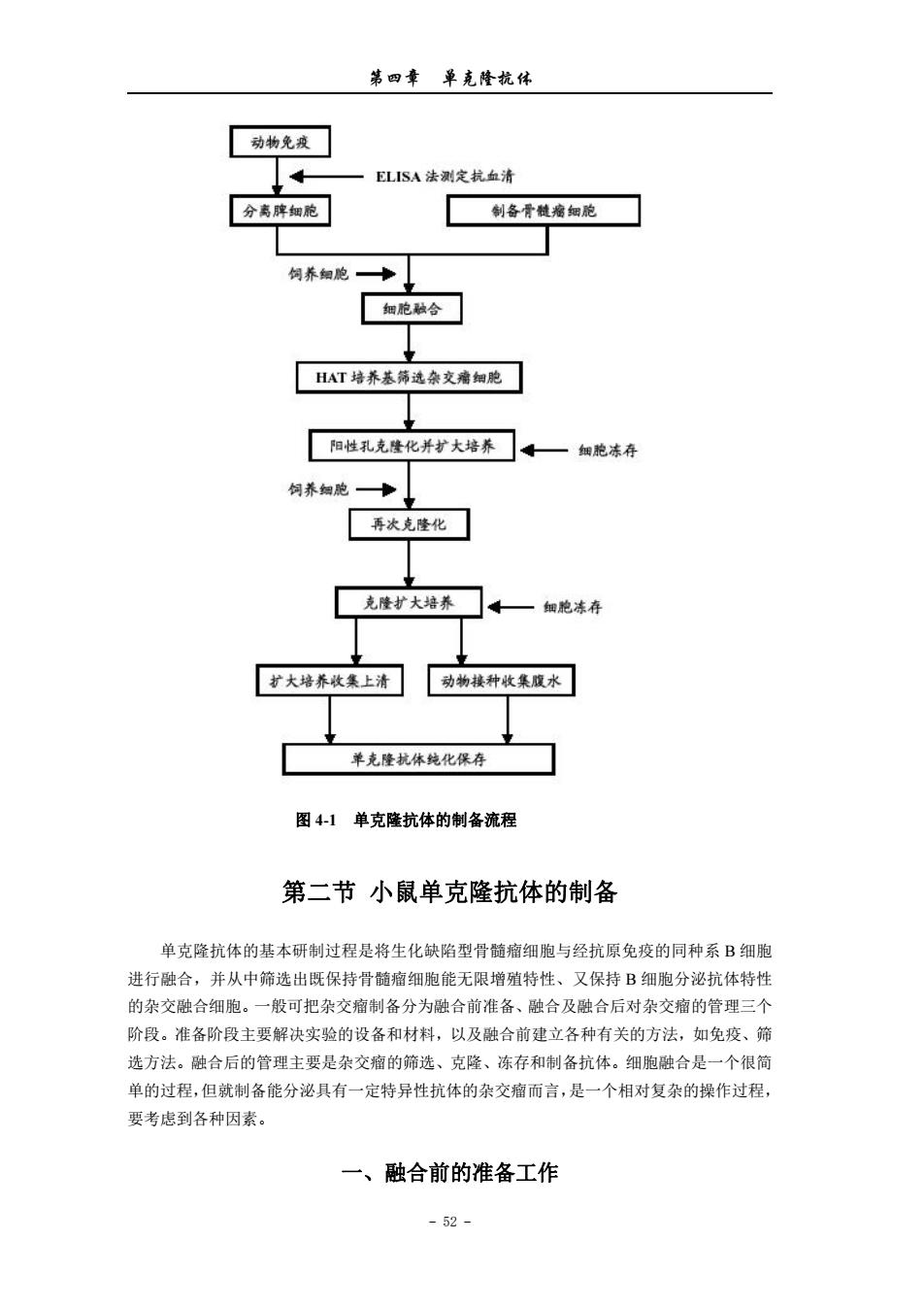
第四章单克隆杭体 动物免 ELISA法测定杭血清 分离脾细胞 制备骨髓瘤细胞 饲养细胞 HAT培养基选杂瘤细胞 阳性孔克隆化并扩大培养。一细胞冻行 饲养蜘胞—】 弄次克隆化 克隆扩大培养 扩大培养集上清动物楼种收集腹水 单克隆抗体纯化保存 图41单克隆抗体的制备流程 第二节小鼠单克隆抗体的制备 单克隆抗体的基本研制过程是将生化缺陷型骨髓痛细胞与经抗原免疫的同种系B细胞 进行融合,并从中筛选出既保持骨髓瘤细胞能无限增殖特性、又保持B细胞分泌抗体特性 的杂交融合细胞。一般可把杂交瘤制备分为融合前准备、融合及融合后对杂交瘤的管理三个 阶段。准备阶段主要解决实验的设备和材料,以及融合前建立各种有关的方法,如免疫、筛 选方法。融合后的管理主要是杂交瘤的筛选、克隆、冻存和制备抗体。细胞融合是一个很简 单的过程,但就制备能分泌具有一定特异性抗体的杂交瘤而言,是一个相对复杂的操作过程, 要考虑到各种因素。 一、融合前的准备工作 -52-
第四章 单克隆抗体 - 52 - 图 4-1 单克隆抗体的制备流程 第二节 小鼠单克隆抗体的制备 单克隆抗体的基本研制过程是将生化缺陷型骨髓瘤细胞与经抗原免疫的同种系 B 细胞 进行融合,并从中筛选出既保持骨髓瘤细胞能无限增殖特性、又保持 B 细胞分泌抗体特性 的杂交融合细胞。一般可把杂交瘤制备分为融合前准备、融合及融合后对杂交瘤的管理三个 阶段。准备阶段主要解决实验的设备和材料,以及融合前建立各种有关的方法,如免疫、筛 选方法。融合后的管理主要是杂交瘤的筛选、克隆、冻存和制备抗体。细胞融合是一个很简 单的过程,但就制备能分泌具有一定特异性抗体的杂交瘤而言,是一个相对复杂的操作过程, 要考虑到各种因素。 一、融合前的准备工作

第四章单克隆杭体 (一)组织培养材料的准备 1,主要设备 一般有组织培养能力的实验室均具有研制杂交瘤的基本条件。主要的仪器设备包括:超 净工作台、C02恒温培养箱、倒置光学显微镜、普通显微镜、离心机、液氨储存器、水浴恒 温装置、冰箱、培养液过滤装置、多孔培养板、塑料器皿及其它实验室常用的材料。 2.组织培养用水 一般都采用去离子水,将蒸馏水经超滤装置过滤后,即可除去其中的绝大部分离子。在 整个实验过程中都应该使用符合规格的用水。 3.培养基 制备单克隆抗体最常用的培养基有两种, 一种是改良的Dulbecco's Modified Eagle Medium(DMEM)。DMEM又有高糖(4500mgL)和低糖(1000mgL)两种。用于小鼠融 合的常为高糖DMEM。另一种为RPM-I64O。配制时干粉制剂搅全溶后,加水到需要的 体积,这样可以保证培养液的渗透压。经除菌过滤分装之后,即可保存于冰箱中,同时取少 量培养液进行培养证明其无茵,使用前根据需要再加入适量的牛血清、抗生素、碳酸氢钠、 丙酮酸盐和谷氨酰胺等成分,制备完全培养基所添加的各种成分都需要事先检菌。 4。血清 常用胎牛血清,但国内多数实验室常使用新生小牛血清,原因是新生小牛血清比胎牛血 清更便宜。不同来源及批号的血清对杂交瘤细胞的生长有明显差异。因此在实验前必须对不 同来源及批号的血清进行仔细的筛选检查,筛选出能支持单细胞生长或使细胞迅速增殖的血 清。在外观上稍有溶血而使血清中含有少量的血红蛋白并不影响其质量。常用的方法是用 株骨髓瘤细胞及两株杂交瘤细胞按有限稀释法(limited dilution)将细跑接种于若干个平行 孔,细胞培养液为含20%胎牛血清的DMEM或RPM-1640完全培养液,并于培养后3d、 7d、10d观察细胞增殖的情况,择优选用。 胎牛血清中球蛋白含量很低,一般不会影响杂交瘤细胞抗体分泌或抗体特异性的筛选。 此外胎生血清还含有一些生长刺激因子能促讲杂交瘤细胞的生长。如补充一些马血清,融合 细胞可迅速生长,同时又可节省一些胎牛血清。对于融合亲代细胞的培养一般采用含10% 胎牛血清培养基。但在融合、筛选及随后的克隆中一般用含20%的胎牛血清培养基。一旦 筛选出所需要的杂交瘤细胞后,可以将胎牛血清浓度逐步降低到10%或低至5%,使细胞缓 慢生长,以作为常规维持培养 根据需要在用前可以将胎牛血清灭活,即放在56℃水浴中温有30mi,以破坏血清中 补体的活性。也有报道在56℃加温45mn可以杀伤支原体。灭活前将在-20℃冻存的胎牛 血清取出,放在室温或4℃冰箱中待其自然解冻,将解冻的胎牛血清充分混匀后再放到56℃ 的恒温水浴中,温热30m,其间将血清瓶摇动混匀数次。将筛选灭活的牛血清或其它血清 分装成每次需要的数量,20℃保存。反复冻融会影响血清的质量。 5.抗生素 由于杂交瘤制备步骤多,持续培养的时间长,加之操作的误差和环境条件的不良常常会 -53
第四章 单克隆抗体 - 53 - (一) 组织培养材料的准备 1. 主要设备 一般有组织培养能力的实验室均具有研制杂交瘤的基本条件。主要的仪器设备包括:超 净工作台、CO2恒温培养箱、倒置光学显微镜、普通显微镜、离心机、液氮储存器、水浴恒 温装置、冰箱、培养液过滤装置、多孔培养板、塑料器皿及其它实验室常用的材料。 2. 组织培养用水 一般都采用去离子水,将蒸馏水经超滤装置过滤后,即可除去其中的绝大部分离子。在 整个实验过程中都应该使用符合规格的用水。 3. 培养基 制备单克隆抗体最常用的培养基有两种,一种是改良的 Dulbecco’s Modified Eagle Medium(DMEM)。DMEM 又有高糖(4500mg/L)和低糖(1000mg/L)两种。用于小鼠融 合的常为高糖 DMEM。另一种为 RPMI-1640。配制时干粉制剂搅拌全溶后,加水到需要的 体积,这样可以保证培养液的渗透压。经除菌过滤分装之后,即可保存于冰箱中,同时取少 量培养液进行培养证明其无菌,使用前根据需要再加入适量的牛血清、抗生素、碳酸氢钠、 丙酮酸盐和谷氨酰胺等成分,制备完全培养基所添加的各种成分都需要事先检菌。 4. 血清 常用胎牛血清,但国内多数实验室常使用新生小牛血清,原因是新生小牛血清比胎牛血 清更便宜。不同来源及批号的血清对杂交瘤细胞的生长有明显差异。因此在实验前必须对不 同来源及批号的血清进行仔细的筛选检查,筛选出能支持单细胞生长或使细胞迅速增殖的血 清。在外观上稍有溶血而使血清中含有少量的血红蛋白并不影响其质量。常用的方法是用一 株骨髓瘤细胞及两株杂交瘤细胞按有限稀释法(limited dilution)将细胞接种于若干个平行 孔,细胞培养液为含 20%胎牛血清的 DMEM 或 RPMI-1640 完全培养液,并于培养后 3d、 7d、10d 观察细胞增殖的情况,择优选用。 胎牛血清中球蛋白含量很低,一般不会影响杂交瘤细胞抗体分泌或抗体特异性的筛选。 此外胎牛血清还含有一些生长刺激因子能促进杂交瘤细胞的生长。如补充一些马血清,融合 细胞可迅速生长,同时又可节省一些胎牛血清。对于融合亲代细胞的培养一般采用含 10% 胎牛血清培养基。但在融合、筛选及随后的克隆中一般用含 20%的胎牛血清培养基。一旦 筛选出所需要的杂交瘤细胞后,可以将胎牛血清浓度逐步降低到 10%或低至 5%,使细胞缓 慢生长,以作为常规维持培养。 根据需要在用前可以将胎牛血清灭活,即放在 56℃水浴中温育 30 min,以破坏血清中 补体的活性。也有报道在 56 ℃加温 45 min 可以杀伤支原体。灭活前将在-20℃冻存的胎牛 血清取出,放在室温或 4℃冰箱中待其自然解冻,将解冻的胎牛血清充分混匀后再放到 56 ℃ 的恒温水浴中,温热 30 min,其间将血清瓶摇动混匀数次。将筛选灭活的牛血清或其它血清 分装成每次需要的数量,-20 ℃保存。反复冻融会影响血清的质量。 5. 抗生素 由于杂交瘤制备步骤多,持续培养的时间长,加之操作的误差和环境条件的不良常常会

第四章单克隆杭保 使整个工作由于污染而功亏一篑。因此,避免污染是组织培养实验工作中不可轻视的一环, 常见的微生物污染丰要来自病臺、细菌、直菌及支原体。污染源主要来自于原代培养、血洁 实验室工作人员、污染的培养物及实验环境。避免污染的最好方法莫过于建立一个严格的实 验室管理制度和良好的无南操作技术,这包括对任何引入新细胞系进行仔细的检测,对所有 的组织培养试剂在使用前都应作细菌及真菌检查。 细菌的污染可以用抗生素来控制,然而常规在培养体系中加人抗生素会导致耐药株的选 择性繁殖,从而有可能使实验环境处于耐药株的污染中。尽管如此,培养体系中仍然常规地 加入青霉素100Uml和链莓素100μgml。当有青、链霉素耐药株出现时,则可加入庆大霉 素(entamycin)0.2mg/ml或卡那霉素(kanamycin)50Oug/ml,但这种处理的效果并不好。 真菌的污染是难以防范的。这主要是由于温热湿润的条件是霉菌生长的良好环境。定期 清洁有助于控制真南的污染。虽然在培养中加入两性霉素B(fungizone,ampholericin B, 5~10ugml)或制霉菌素(mycostatin,100μgml)可以控制某些真菌的生长,然而一旦发 生真菌污染,往往也无能为力。这是因为真菌生长迅速,这两种抗生素的用量稍大也会影响 杂交瘤细胞的生长,所以当发现有真菌污染时最好的方法是将其销毁,也可以在有真菌的孔 中加入lmoL氢氧化钠或2molL硫酸铜溶液,或者隔离重要的培养皿,并制备出复制品, 尤其对具有重要意义的杂交瘤细胞更应采取备份培养的方法。 细菌或真菌的污染可用肉眼或显微镜看到,而另一种更隐蔽的污染是支原体污染。支原 体是一种比病毒颗粒大、比细菌小的微生物,大小为0.22μm左右,约有1%可以通过0.22μm 滤菌器。常见的支原体主要来自人体及血清。支原体污染细胞后,培养基中除酚红指示剂显 示偏酸外,并不发生浑浊,细胞病理变化轻微,所以很难发现。用作融合亲代细胞的骨髓瘤 细胞在体外长期培养传代时,很容易受到这种难以察觉的污染,导致细胞增殖减缓。融合时, 杂交瘤的产生会受到明显影响,在融合后1周左右即可发现许多融合细胞突然崩解。由于支 原体污染是在不易观察的情况下发生的,其预防较为困难。良好的实验环境、良好的无菌操 作技术及优质的胎牛血清和试剂等仍然是很重要的环节。另外在引入新的细胞系时,应检测 细胞是否污染支原体,如果无支原体污染,细胞生长良好,应先培养冻存一批,以供备用。 用作融合的骨髓瘤细胞不宜长期在体外培养,一旦发现细胞生长变慢,支原体检查阳性,应 立即废弃。支原体不尉热,也可以在41C恒温培养讨夜,但这种方法需要了解细胞对热处 理的耐受程度。如果具有重要价值的杂交瘤细胞被支原体污染,不仅影响抗体的分泌特性, 而且也影响其应用。这时可采取的补救办法是将杂交瘤细胞或骨篇痴细胞接种于小鼠腹腕 内,利用机体的免疫系统来清除细胞的支原体。近年来采用BM-cycline等试剂处理被污染 的细胞获得相当良好的结果,而且操作方法也简便。 (二)小眼免疫 1.抗原 任何能引起免疫反应的物质都可以作为抗原。抗原在体内引起的兔疫反应与机体对抗原 的识别有关。抗原的初次免疫能使机体产生多价的低亲和力的gM。随着相同抗原的反复免 疫,机体产生抗体的反应加速,主要产生二价的gG。抗体的亲和力和血清中的滴度也随着 免疫次数的增多而增强。在杂交瘤的制备过程中,免疫的目的是使B细胞在抗原的刺激下 -54
第四章 单克隆抗体 - 54 - 使整个工作由于污染而功亏一篑。因此,避免污染是组织培养实验工作中不可轻视的一环, 常见的微生物污染主要来自病毒、细菌、真菌及支原体。污染源主要来自于原代培养、血清、 实验室工作人员、污染的培养物及实验环境。避免污染的最好方法莫过于建立一个严格的实 验室管理制度和良好的无菌操作技术,这包括对任何引入新细胞系进行仔细的检测,对所有 的组织培养试剂在使用前都应作细菌及真菌检查。 细菌的污染可以用抗生素来控制,然而常规在培养体系中加人抗生素会导致耐药株的选 择性繁殖,从而有可能使实验环境处于耐药株的污染中。尽管如此,培养体系中仍然常规地 加入青霉素 100U/ml 和链霉素 100μg/ml。当有青、链霉素耐药株出现时,则可加入庆大霉 素(gentamycin)0.2mg/ml 或卡那霉素(kanamycin)500μg/ml,但这种处理的效果并不好。 真菌的污染是难以防范的。这主要是由于温热湿润的条件是霉菌生长的良好环境。定期 清洁有助于控制真菌的污染。虽然在培养中加入两性霉素 B(fungizone,ampholericin B, 5~10μg/ml)或制霉菌素(mycostatin,100μg/ml )可以控制某些真菌的生长,然而一旦发 生真菌污染,往往也无能为力。这是因为真菌生长迅速,这两种抗生素的用量稍大也会影响 杂交瘤细胞的生长,所以当发现有真菌污染时最好的方法是将其销毁,也可以在有真菌的孔 中加入 lmol/L 氢氧化钠或 2mol/L 硫酸铜溶液,或者隔离重要的培养皿,并制备出复制品, 尤其对具有重要意义的杂交瘤细胞更应采取备份培养的方法。 细菌或真菌的污染可用肉眼或显微镜看到,而另一种更隐蔽的污染是支原体污染。支原 体是一种比病毒颗粒大、比细菌小的微生物,大小为 0.22μm 左右,约有 1%可以通过 0.22μm 滤菌器。常见的支原体主要来自人体及血清。支原体污染细胞后,培养基中除酚红指示剂显 示偏酸外,并不发生浑浊,细胞病理变化轻微,所以很难发现。用作融合亲代细胞的骨髓瘤 细胞在体外长期培养传代时,很容易受到这种难以察觉的污染,导致细胞增殖减缓。融合时, 杂交瘤的产生会受到明显影响,在融合后 1 周左右即可发现许多融合细胞突然崩解。由于支 原体污染是在不易观察的情况下发生的,其预防较为困难。良好的实验环境、良好的无菌操 作技术及优质的胎牛血清和试剂等仍然是很重要的环节。另外在引入新的细胞系时,应检测 细胞是否污染支原体,如果无支原体污染,细胞生长良好,应先培养冻存一批,以供备用。 用作融合的骨髓瘤细胞不宜长期在体外培养,一旦发现细胞生长变慢,支原体检查阳性,应 立即废弃。支原体不耐热,也可以在 41℃恒温培养过夜,但这种方法需要了解细胞对热处 理的耐受程度。如果具有重要价值的杂交瘤细胞被支原体污染,不仅影响抗体的分泌特性, 而且也影响其应用。这时可采取的补救办法是将杂交瘤细胞或骨髓瘤细胞接种于小鼠腹腔 内,利用机体的免疫系统来清除细胞的支原体。近年来采用 BM-cycline 等试剂处理被污染 的细胞获得相当良好的结果,而且操作方法也简便。 (二) 小鼠免疫 1. 抗原 任何能引起免疫反应的物质都可以作为抗原。抗原在体内引起的免疫反应与机体对抗原 的识别有关。抗原的初次免疫能使机体产生多价的低亲和力的 IgM。随着相同抗原的反复免 疫,机体产生抗体的反应加速,主要产生二价的 IgG。抗体的亲和力和血清中的滴度也随着 免疫次数的增多而增强。在杂交瘤的制备过程中,免疫的目的是使 B 细胞在抗原的刺激下

第四章单克隆杭体 分化、增殖,有利于细胞融合形成杂交瘤,尤其是增加获得分泌特异性抗体的杂交瘤的几率。 因此,免疫的效果是关系到能否获得特异性单抗的重要一环。 当需要免疫的抗原和动物确定之后,就应认真设计免疫方案,对抗原的质量、免疫途径、 次数、间隔及是否应用佐剂都应有一个总体考虑,甚至包括动物对抗原的免疫应答的检测都 应事先有所安排。 抗原的免疫包括体内免疫和体外免疫,本文主要叙述体内免疫的一些方法。为便于实验 操作,在动物的免疫过程中,我们常将抗原分为可溶性抗原和颗粒性抗原。前者如蛋白质、 碳水化合物或核酸等,后者如病毒、细菌和细胞等。一般颗粒性抗原都具有较强的免疫原性, 可以不加佐剂,而可溶性蛋白抗原在免疫时应添加佐剂。 用1g的可溶性蛋白抗原免疫小鼠,即可产生强烈的免疫反应。但一般在初次免疫中都 用10一20ug的抗原量。当有足够的抗原时,可以一次注射50ug。很少有一次超过200ug, 即使抗原不够纯时,总的注射量一般也不超过500ug。没有免疫原性的半抗原分子可与钥孔 成蓝蛋白或白蛋白等大分子蛋白偶合在一起,赋予其免疫原性。 颗粒性抗原由于能很快地被吞噬,所以是非常好的免疫原。利用可溶性抗原自身的多聚 效应可将其固相化在琼脂上而成为颗粒性抗原。由于重组DNA技术的进展,易于制备出重 组蛋白抗原。这些重组蛋白有极好的抗原性,在单抗的制备中十分有用。而且这些蛋白可以 纯化,以可溶性或固相化的形式进行免疫。 另一种免疫原是根据编码序列在体外合成多肽。当合成肽与牛血清蛋白或钥孔戚蓝蛋白 等载体蛋白交联后,即可成为强兔疫原。用多肽抗原免疫制备抗体的主要问题是所获抗体能 否与天然蛋白相结合。 活细胞也可以作为免疫原以制备针对细胞表面或内部抗原的单抗。在制备抗肿瘤细胞的 单克隆抗体时应尽可能保证肿瘤组织细胞的纯度。 核酸的抗原性很弱,通常是将其作为半抗原交联到载体蛋自上。分子量超过50000、大 而复杂的碳水化合物会引起中等程度的免疫反应,但重复免疫并不总能产生继发反应,大剂 量又会引起耐受,所以注射剂量应加以严格的控制。 2.动物选择 在开始设计免疫方案之前要选择合适的动物品系。应考虑动物的耐受性、可利用的抗原 数量及所制备抗体的特性(包括是否容易纯化)。一般选择6周龄的雌性BLB小鼠免疫。 因融合所用骨髓瘤细胞多来自该品系的小鼠,所获杂交瘤细胞可接种于BALB/c小鼠,制备 含抗体的腹水。当受检的免疫动物的血清中出现所需要的抗体时才开始做融合,如果抗血清 的效价较低,会增加获得理想单克隆抗体杂交瘤细胞的难度。 3.兔疫途径 兔疫的效果除决定于抗原的性质和宿主反应外,亦与兔疫途径有关。不同的抗原可经不 同的途径免疫。常用的免疫途径为皮下、腹腔、淋巴结及静脉,亦可经皮内或肌肉内注射。 为了增加抗原的免疫原性,可以将抗原交联到琼脂珠或聚丙烯酰胺等一些载体上,以利 吞噬细胞的吞噬。将蛋白抗原固相化到硝酸纤维膜上也可增加其免疫原性。也可将含有抗原 的硝酸纤维膜直接移植到小鼠皮下,或将含有抗原的硝酸纤维膜研碎之后悬浮于PBS中, 或用二甲基亚砜或丙酮溶解硝酸纤维膜之后,再悬浮于PBS或加入完全福氏佐剂乳化后进 -55
第四章 单克隆抗体 - 55 - 分化、增殖,有利于细胞融合形成杂交瘤,尤其是增加获得分泌特异性抗体的杂交瘤的几率。 因此,免疫的效果是关系到能否获得特异性单抗的重要一环。 当需要免疫的抗原和动物确定之后,就应认真设计免疫方案,对抗原的质量、免疫途径、 次数、间隔及是否应用佐剂都应有一个总体考虑,甚至包括动物对抗原的免疫应答的检测都 应事先有所安排。 抗原的免疫包括体内免疫和体外免疫,本文主要叙述体内免疫的一些方法。为便于实验 操作,在动物的免疫过程中,我们常将抗原分为可溶性抗原和颗粒性抗原。前者如蛋白质、 碳水化合物或核酸等,后者如病毒、细菌和细胞等。一般颗粒性抗原都具有较强的免疫原性, 可以不加佐剂,而可溶性蛋白抗原在免疫时应添加佐剂。 用 l μg 的可溶性蛋白抗原免疫小鼠,即可产生强烈的免疫反应。但一般在初次免疫中都 用 10~20μg 的抗原量。当有足够的抗原时,可以一次注射 50μg。很少有一次超过 200μg, 即使抗原不够纯时,总的注射量一般也不超过 500μg。没有免疫原性的半抗原分子可与钥孔 戚蓝蛋白或白蛋白等大分子蛋白偶合在一起,赋予其免疫原性。 颗粒性抗原由于能很快地被吞噬,所以是非常好的免疫原。利用可溶性抗原自身的多聚 效应可将其固相化在琼脂上而成为颗粒性抗原。由于重组 DNA 技术的进展,易于制备出重 组蛋白抗原。这些重组蛋白有极好的抗原性,在单抗的制备中十分有用。而且这些蛋白可以 纯化,以可溶性或固相化的形式进行免疫。 另一种免疫原是根据编码序列在体外合成多肽。当合成肽与牛血清蛋白或钥孔戚蓝蛋白 等载体蛋白交联后,即可成为强免疫原。用多肽抗原免疫制备抗体的主要问题是所获抗体能 否与天然蛋白相结合。 活细胞也可以作为免疫原以制备针对细胞表面或内部抗原的单抗。在制备抗肿瘤细胞的 单克隆抗体时应尽可能保证肿瘤组织细胞的纯度。 核酸的抗原性很弱,通常是将其作为半抗原交联到载体蛋白上。分子量超过 50000、大 而复杂的碳水化合物会引起中等程度的免疫反应,但重复免疫并不总能产生继发反应,大剂 量又会引起耐受,所以注射剂量应加以严格的控制。 2. 动物选择 在开始设计免疫方案之前要选择合适的动物品系。应考虑动物的耐受性、可利用的抗原 数量及所制备抗体的特性(包括是否容易纯化)。一般选择 6 周龄的雌性 BALB/c 小鼠免疫, 因融合所用骨髓瘤细胞多来自该品系的小鼠,所获杂交瘤细胞可接种于 BALB/c 小鼠,制备 含抗体的腹水。当受检的免疫动物的血清中出现所需要的抗体时才开始做融合,如果抗血清 的效价较低,会增加获得理想单克隆抗体杂交瘤细胞的难度。 3. 免疫途径 免疫的效果除决定于抗原的性质和宿主反应外,亦与免疫途径有关。不同的抗原可经不 同的途径免疫。常用的免疫途径为皮下、腹腔、淋巴结及静脉,亦可经皮内或肌肉内注射。 为了增加抗原的免疫原性,可以将抗原交联到琼脂珠或聚丙烯酰胺等一些载体上,以利 吞噬细胞的吞噬。将蛋白抗原固相化到硝酸纤维膜上也可增加其免疫原性。也可将含有抗原 的硝酸纤维膜直接移植到小鼠皮下,或将含有抗原的硝酸纤维膜研碎之后悬浮于 PBS 中, 或用二甲基亚砜或丙酮溶解硝酸纤维膜之后,再悬浮于 PBS 或加入完全福氏佐剂乳化后进

第四章单克隆杭保 行免疫。 皮下局部注射可以将可溶性或不溶性抗原注射到淋巴结引流区。一般皮下注射的总量不 超过1OO如l,而且皮下多点注射有利于增加免疫效果。皮下注射可以应用完全福氏佐剂,但 由于其可能的毒性,在制备及注射中要十分谨慎。 融合前一般都需要进行抗原冲击,静脉注射是最常用的途径。抗原经静脉进入血液循环 之后,讯谏被脾时、肝脏成肺中的后邀细南所吞磁、加工,从而产生强列的反应。但反应的 时间较短促。静脉注射一般不作为初次免疫的途径,尤其是不应作为大颗粒性抗原的免疫途 径,因为很可能引起血栓,损伤主要脏器,引起过敏反应,也容易诱发免疫耐受。在注射的 溶液中不应含有高浓度的变性剂或叠复钠一类有毒的防腐剂。 在进行次级免疫或抗原冲击时,理论上最好的方法是将这类抗原直接注射到淋巴样器官 中,如牌脏或足垫中。当抗原量少至纳克(g)时,用脾内免疫仍能获得良好的免疫效果。 微量抗原的脾内免疫较其他注入途径有更多的技术要求。打开麻醉的小鼠腹腔,用最小号的 注射针头经脾脏尾端刺入脾脏,将抗原悬液慢慢的注入脾内(约20如),轻轻压迫针孔待不 再渗出血液或液体时,即可缝合关闭腹腔。如果埋入吸附有抗原的硝酸纤维膜,则将约 2mm×3mm的三角形膜片经小切口插入到脾脏远端,将它埋植到脾脏组织中。脾脏可被重复 进行免疫。但使用微量抗原脾内免疫通常不会产生明显的血清抗体,所以即使没有明显的阳 性血清反应时,也可进行细胞融合。 4.截体 除了白蛋白、钥孔或蓝蛋白等大分子外,任何一种小的、情性的、无毒性、能固定抗原 并可使抗原缓慢释放的物质都可作为载体。抗原与载体的结合可以是特异性的或非特异性 的。载体的选择取决于抗原的种类,在交联或其它操作过程中应避免抗原构型改变而失活。 常用的载体可分为珠体和膜两类,珠体能与配基如蛋白A或G共价交联,而配基与免 疫原可有特异的亲和力。连接暴露的氨基、羟基、羟基、或巯基的衍生物珠体可制成珠体 配基抗原复合物。 脂质体是由磷脂化合物构成的多层囊泡,各种免疫原可包裹嵌在脂质体的多层膜间。由 于它在体内能被巨噬细胞迅速吞噬,在细胞内被缓慢地逐步释放,因而具有较强的增强免疫 原性的作用。硝酸纤维膜、尼龙膜和阳离子尼龙膜也可以分别与亲水性蛋白质、疏水物质、 以及寡核苷酸、DNA和RNA结合,可以直接将抗原滴于膜上,亦可在电泳后印迹转移到膜 上,取抗原区带用于免疫。 二、细胞融合 细胞融合是杂交瘤产生的中心环节,这一步关系到全部工作的成败。操作的全部过程沙 须在严格无菌的条件下进行。细胞融合要准备两种细胞,骨髓瘤细胞和脾细胞。 (一)主要试剂 1.培养基 完全RPM-1640(含20%FCS)或完全DMEM培养基(含20%FCS,20 nmol/LHEPES -56-
第四章 单克隆抗体 - 56 - 行免疫。 皮下局部注射可以将可溶性或不溶性抗原注射到淋巴结引流区。一般皮下注射的总量不 超过 100μl,而且皮下多点注射有利于增加免疫效果。皮下注射可以应用完全福氏佐剂,但 由于其可能的毒性,在制备及注射中要十分谨慎。 融合前一般都需要进行抗原冲击,静脉注射是最常用的途径。抗原经静脉进入血液循环 之后,迅速被脾脏、肝脏或肺中的巨噬细胞所吞噬、加工,从而产生强烈的反应。但反应的 时间较短促。静脉注射一般不作为初次免疫的途径,尤其是不应作为大颗粒性抗原的免疫途 径,因为很可能引起血栓,损伤主要脏器,引起过敏反应,也容易诱发免疫耐受。在注射的 溶液中不应含有高浓度的变性剂或叠氮钠一类有毒的防腐剂。 在进行次级免疫或抗原冲击时,理论上最好的方法是将这类抗原直接注射到淋巴样器官 中,如脾脏或足垫中。当抗原量少至纳克(ng)时,用脾内免疫仍能获得良好的免疫效果。 微量抗原的脾内免疫较其他注入途径有更多的技术要求。打开麻醉的小鼠腹腔,用最小号的 注射针头经脾脏尾端刺入脾脏,将抗原悬液慢慢的注入脾内(约 20μl),轻轻压迫针孔待不 再渗出血液或液体时,即可缝合关闭腹腔。如果埋入吸附有抗原的硝酸纤维膜,则将约 2mm×3mm 的三角形膜片经小切口插入到脾脏远端,将它埋植到脾脏组织中。脾脏可被重复 进行免疫。但使用微量抗原脾内免疫通常不会产生明显的血清抗体,所以即使没有明显的阳 性血清反应时,也可进行细胞融合。 4. 载体 除了白蛋白、钥孔戚蓝蛋白等大分子外,任何一种小的、惰性的、无毒性、能固定抗原 并可使抗原缓慢释放的物质都可作为载体。抗原与载体的结合可以是特异性的或非特异性 的。载体的选择取决于抗原的种类,在交联或其它操作过程中应避免抗原构型改变而失活。 常用的载体可分为珠体和膜两类,珠体能与配基如蛋白 A 或 G 共价交联,而配基与免 疫原可有特异的亲和力。连接暴露的氨基、羟基、羟基、或巯基的衍生物珠体可制成珠体- 配基-抗原复合物。 脂质体是由磷脂化合物构成的多层囊泡,各种免疫原可包裹嵌在脂质体的多层膜间。由 于它在体内能被巨噬细胞迅速吞噬,在细胞内被缓慢地逐步释放,因而具有较强的增强免疫 原性的作用。硝酸纤维膜、尼龙膜和阳离子尼龙膜也可以分别与亲水性蛋白质、疏水物质、 以及寡核苷酸、DNA 和 RNA 结合,可以直接将抗原滴于膜上,亦可在电泳后印迹转移到膜 上,取抗原区带用于免疫。 二、细胞融合 细胞融合是杂交瘤产生的中心环节,这一步关系到全部工作的成败。操作的全部过程必 须在严格无菌的条件下进行。细胞融合要准备两种细胞,骨髓瘤细胞和脾细胞。 (一) 主要试剂 1. 培养基 完全 RPMI-1640(含 20%FCS)或完全 DMEM 培养基(含 20%FCS,20mmol/L HEPES

第四章单克隆杭体 及ImmoVL丙酮酸钠),不完全RPM-I640或DMEM培养基(不含血清) 2.HAT培养液 ()HAT100倍贮存液称取136.1mg的次黄嘌吟(H),1.9mg的氨基碟吟(A)和38.8mg 的胸腺嘧啶核苷(T),略偏碱,以促进溶解。贮存液过滤除菌,20℃冻存备用。现在实验 室一般都用商品化的现成贮存液 (2)HAT应用液每1O0ml完全培养基加入1ml上述HAT贮存液。 3.HT培养液 ()HT100倍贮存液称取136.mg次黄嘌岭(H)和38.8mg胸腺嘧啶核苷(T)溶于 100ml双蒸水,过滤除菌,-20C冻存备用。现在实验室一般都用商品化的现成贮存液。 (2)HT应用液每100ml完全培养基中加入Iml上述HT贮存液。 4.50%PEG溶液 在玻璃瓶中高压10g分子量为4000的PEG(15si15分钟),使之溶化为液体,冷却, 在其凝固之前(约55℃)加入10ml不完全DMEM培养液(可以供20次融合使用,可以在 室温存几个月之久)。 注:不能用含有蛋白的培养基配制PEG溶液。浓度低于30%的PEG融合成功率低:高 于50%的PEG对细胞毒性大。 (仁)骨髓瘤细胞的准备 1,骨髓瘤细胞的选择 目前可供应用的骨萄南系来自小鼠、大鼠和人等。由于对骨髓瘤的诱发过程高度敏感的 只有BALB和N2B品系小鼠,所以来自两种品系的骨髓瘤细胞较多,人类尚无广泛成熟 应用的细胞系。下表为几种可选用的鼠骨髓指细胞系(表41)。 表41几种常用的鼠骨随瘤细胞系 细胞系 物种(品系) 特性 P3-X63-Ag8 小鼠BALB/c 分泌gG,现在很少应用 P3-NS1/1-Ag4-1 小鼠BALB/e 合成轻链,HAT选择 P3-X63-Ag8.653 小鼠BALB/C 不合成Ig,较广泛应用,HAT选择 SP2/0-Ag14 小鼠BALB/c 不合成Ig,广泛应用,HAT选择 小鼠BALB/C 不合成g,HAT选择 S194/5 XXO BU 1 小鼠BALB/ 不合成Ig,HAT选择 210-CRY3-Agl 大鼠Lou/c 分泌K轻链,HAT选择 YB2/3Ag20 大鼠Louc 不合成Ig,HAT选择 IK983F 大鼠Lou/C 不合成Ig,HAT选择 由于在细胞融合过程中,骨髓瘤细胞与脾细胞的轻重链可能会随机地相互结合。为了避 -57
第四章 单克隆抗体 - 57 - 及 1mmol/L 丙酮酸钠),不完全 RPMI-1640 或 DMEM 培养基(不含血清)。 2.HAT 培养液 (1) HAT 100 倍贮存液 称取 136.1mg 的次黄嘌呤(H),1.9mg 的氨基碟呤(A)和 38.8mg 的胸腺嘧啶核苷(T),略偏碱,以促进溶解。贮存液过滤除菌,-20℃冻存备用。现在实验 室一般都用商品化的现成贮存液。 (2) HAT 应用液 每 100ml 完全培养基加入 1 ml 上述 HAT 贮存液。 3.HT 培养液 (1) HT 100 倍贮存液 称取 136.mg 次黄嘌呤(H)和 38.8mg 胸腺嘧啶核苷(T)溶于 100ml 双蒸水,过滤除菌,-20℃冻存备用。现在实验室一般都用商品化的现成贮存液。 (2) HT 应用液 每 100ml 完全培养基中加入 l ml 上述 HT 贮存液。 4.50%PEG 溶液 在玻璃瓶中高压 10g 分子量为 4000 的 PEG(15psi/15 分钟),使之溶化为液体,冷却, 在其凝固之前(约 55℃)加入 10ml 不完全 DMEM 培养液(可以供 20 次融合使用,可以在 室温存几个月之久)。 注:不能用含有蛋白的培养基配制 PEG 溶液。浓度低于 30%的 PEG 融合成功率低;高 于 50%的 PEG 对细胞毒性大。 (二) 骨髓瘤细胞的准备 1. 骨髓瘤细胞的选择 目前可供应用的骨髓瘤系来自小鼠、大鼠和人等。由于对骨髓瘤的诱发过程高度敏感的 只有 BALB/c 和 N2B 品系小鼠,所以来自两种品系的骨髓瘤细胞较多,人类尚无广泛成熟 应用的细胞系。下表为几种可选用的鼠骨髓瘤细胞系(表 4-1)。 表 4-1 几种常用的鼠骨髓瘤细胞系 细 胞 系 物种(品系) 特 性 P3-X63-Ag8 小鼠 BALB/c 分泌 IgG,现在很少应用 P3-NS1/1-Ag4-1 小鼠 BALB/c 合成κ轻链,HAT 选择 P3-X63-Ag8.653 小鼠 BALB/c 不合成 Ig,较广泛应用,HAT 选择 SP2/0-Ag14 小鼠 BALB/c 不合成 Ig,广泛应用,HAT 选择 FO 小鼠 BALB/c 不合成 Ig,HAT 选择 S194/5 XXO.BU.1 小鼠 BALB/c 不合成 Ig,HAT 选择 210-CRY3-Ag1 大鼠 Lou/c 分泌κ轻链,HAT 选择 YB2/3Ag20 大鼠 Lou/c 不合成 Ig,HAT 选择 IK983F 大鼠 Lou/c 不合成 Ig,HAT 选择 由于在细胞融合过程中,骨髓瘤细胞与脾细胞的轻重链可能会随机地相互结合。为了避

第四章单克隆杭保 免骨髓瘤细胞本身g轻重链的干扰,以便获得更纯一的抗体,最好选用自身不合成免疫球 蛋白轻重链的骨髓疝细胞。目前常用SP2/0-Ag14作为亲本细胞与脾细胞融合。 2.融合前骨髓瘤细胞的准备 融合前一周用完全培养液扩增SP20-Ag14骨髓疝细胞,到融合的当天,必须得到以下 数目的骨髓瘤细胞:与小鼠脾细胞融合约需1x10个骨随瘤细胞:与仓鼠脾细胞融合约周 2x103个骨髓瘤细胞:与大鼠脾融合约需5~10x103个骨髓瘤细胞。融合前一天,用新鲜培养 基将细胞传代。 注意:用于细胞融合的骨骑离细胞,必须处在对数生长期,细胞形态要规则,机能要活 跃,活细胞数在90%一95%以上。细胞不能生长过度,培养基不应变浊(黄色)。骨髓瘤细 胞偶尔会“回复”成能在HAT培养液中生长的细胞,这种情况下,可用含有诱导剂8-氨杂鸟 嘌吟(20ugml)或6-巯基鸟嘌吟(40ug/ml)的完全DMEM培养基进行培养。 (三)脾细胞悬液的制备 1.动物加强免疫融合前3天进行加强免疫,方法见前。 2.无菌取出动物脾脏。注意:不要用麻醉剂处死动物。小鼠可拉颈处死,C0室息可 用于小鼠、仓鼠和大鼠,这样可以防止麻醉剂通过血液而进入培养系统。 3.将脾脏放入直径10cm、盛有10ml无血清培养基的平皿中。 4.用小弯镊子剥去脾脏外的脂肪及结缔组织,将脾置于圆形不锈钢丝网上,用剪刀剪 碎,再用注射器针芯挤压,使脾细胞通过网眼成为单细胞悬液。 5.脾细胞悬液移入50ml离心管,加满无血清培养基,500×g室温离心5min,弃去上 清。 注:不要使用含有PEG、蛋白和HEPES的培养基,PEG会沉淀蛋白,而HEPES在融 合时对细胞有毒性。 6。用5 I NHC1溶液重悬细胞,室温放置5min以溶解红细胞。 7.加入45ml无血清DMEM培养液,500g室温离心5min,弃上清。 8.每次用50ml无血清DMEM培养液离心洗涤两次。 9.洗涤脾细胞同时,将骨髓瘤细胞移入50ml离心管,离心洗涤3次。 10.分别用1Oml无血清DMEM培养液重悬脾细胞和骨髓瘤细胞,计算细胞数量并用 台盼蓝或伊红染色计数活细胞比例。两种细胞的活细胞比例均应接近100%。 IL.根据两种细胞的总数,计算按2.5x10ml重悬细胞所用完全DMEM/HEPES培养 基的量,将这一体积的培养基预温于37℃。 (四)融合细胞 1.按细胞数1:1的比例将SP20-Ag14细胞和脾细胞混合于50ml离心管中,加满无血 清DMEM培养液。 注:细胞比例要求不是很严,骨髓瘤细胞和脾细胞的比例降至1:20也有成功融合的报 道。 2.500×g室温离心5min.弃去上清,尽可能除干净液体 -58
第四章 单克隆抗体 - 58 - 免骨髓瘤细胞本身 Ig 轻重链的干扰,以便获得更纯一的抗体,最好选用自身不合成免疫球 蛋白轻重链的骨髓瘤细胞。目前常用 SP2/0-Ag14 作为亲本细胞与脾细胞融合。 2. 融合前骨髓瘤细胞的准备 融合前一周用完全培养液扩增 SP2/0-Ag14 骨髓瘤细胞,到融合的当天,必须得到以下 数目的骨髓瘤细胞:与小鼠脾细胞融合约需 1×10 8 个骨髓瘤细胞;与仓鼠脾细胞融合约需 2×10 8个骨髓瘤细胞;与大鼠脾融合约需 5~10×10 8个骨髓瘤细胞。融合前一天,用新鲜培养 基将细胞传代。 注意:用于细胞融合的骨髓瘤细胞,必须处在对数生长期,细胞形态要规则,机能要活 跃,活细胞数在 90%~95%以上。细胞不能生长过度,培养基不应变浊(黄色)。骨髓瘤细 胞偶尔会“回复”成能在 HAT 培养液中生长的细胞,这种情况下,可用含有诱导剂 8-氮杂鸟 嘌呤(20μg/ml)或 6-巯基鸟嘌呤(40μg/ml)的完全 DMEM 培养基进行培养。 (三)脾细胞悬液的制备 1.动物加强免疫 融合前 3 天进行加强免疫,方法见前。 2.无菌取出动物脾脏。注意:不要用麻醉剂处死动物。小鼠可拉颈处死,CO2窒息可 用于小鼠、仓鼠和大鼠,这样可以防止麻醉剂通过血液而进入培养系统。 3.将脾脏放入直径 10cm、盛有 10ml 无血清培养基的平皿中。 4.用小弯镊子剥去脾脏外的脂肪及结缔组织,将脾置于圆形不锈钢丝网上,用剪刀剪 碎,再用注射器针芯挤压,使脾细胞通过网眼成为单细胞悬液。 5.脾细胞悬液移入 50ml 离心管,加满无血清培养基,500×g 室温离心 5min,弃去上 清。 注:不要使用含有 PEG、蛋白和 HEPES 的培养基,PEG 会沉淀蛋白,而 HEPES 在融 合时对细胞有毒性。 6.用 5ml NH4C1 溶液重悬细胞,室温放置 5min 以溶解红细胞。 7.加入 45ml 无血清 DMEM 培养液,500g 室温离心 5min,弃上清。 8.每次用 50ml 无血清 DMEM 培养液离心洗涤两次。 9.洗涤脾细胞同时,将骨髓瘤细胞移入 50ml 离心管,离心洗涤 3 次。 10.分别用 10ml 无血清 DMEM 培养液重悬脾细胞和骨髓瘤细胞,计算细胞数量并用 台盼蓝或伊红染色计数活细胞比例。两种细胞的活细胞比例均应接近 100%。 11.根据两种细胞的总数,计算按 2.5×10 6 /ml 重悬细胞所用完全 DMEM/ HEPES 培养 基的量,将这一体积的培养基预温于 37℃。 (四) 融合细胞 1.按细胞数 1:1 的比例将 SP2/0-Ag14 细胞和脾细胞混合于 50ml 离心管中,加满无血 清 DMEM 培养液。 注:细胞比例要求不是很严,骨髓瘤细胞和脾细胞的比例降至 1:20 也有成功融合的报 道。 2.500×g 室温离心 5min,弃去上清,尽可能除干净液体