
抗体相关技术 王德海 检验与生物枝术学院抗体工程研宪所
抗体相关技术 王穗海 检验与生物技术学院抗体工程研究所

抗体相关技术 如何获得目标抗体! 1,抗体的结构、分类和性质 2,抗体的分离纯化和储存 3,抗体的应用
1,抗体的结构、分类和性质 2,抗体的分离纯化和储存 3,抗体的应用 抗体相关技术

第一节 抗体的结构、分美和性质
第一节 抗体的结构、分类和性质
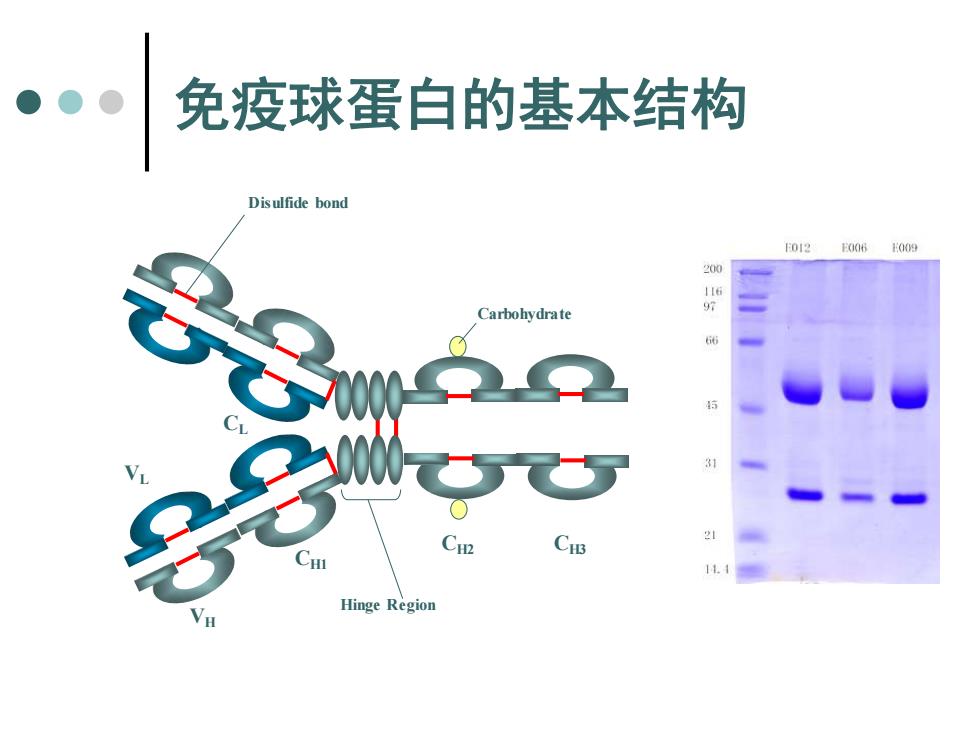
免疫球蛋白的基本结构 Disulfide bond 10120061009 Carbohydrate Hinge Region
免疫球蛋白的基本结构 CH1 VL CL VH CH2 CH3 Hinge Region Carbohydrate Disulfide bond
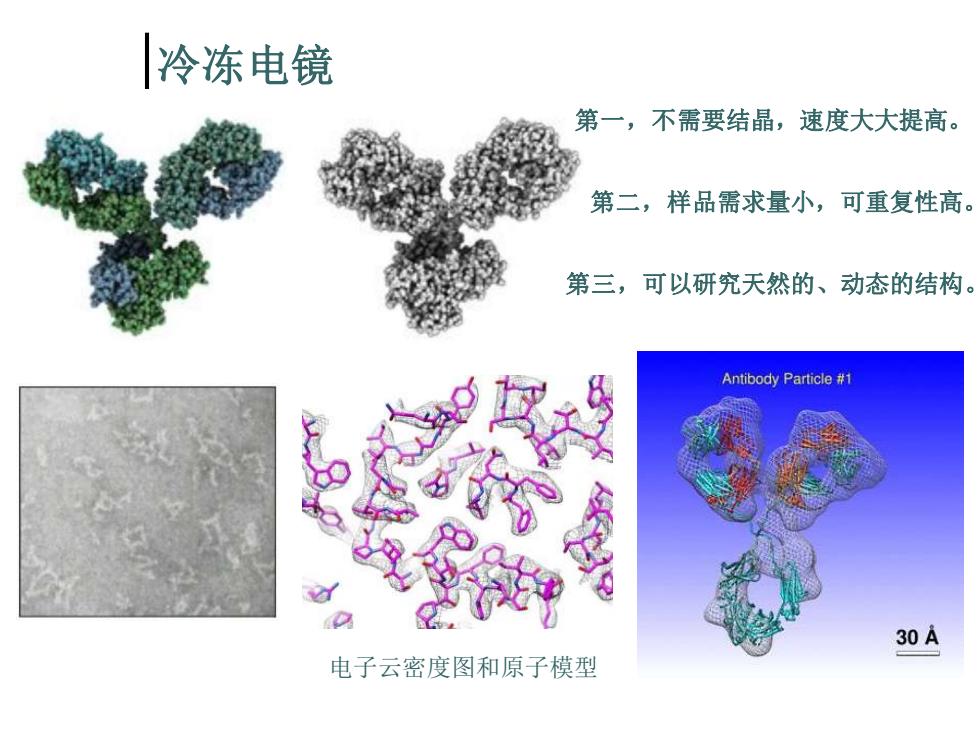
冷冻电镜 第一,不需要结晶,速度大大提高。 第二,样品需求量小,可重复性高。 第三,可以研究天然的、动态的结构。 Antibody Particle #1 30A 电子云密度图和原子模型
冷冻电镜 电子云密度图和原子模型 第一,不需要结晶,速度大大提高。 第二,样品需求量小,可重复性高。 第三,可以研究天然的、动态的结构
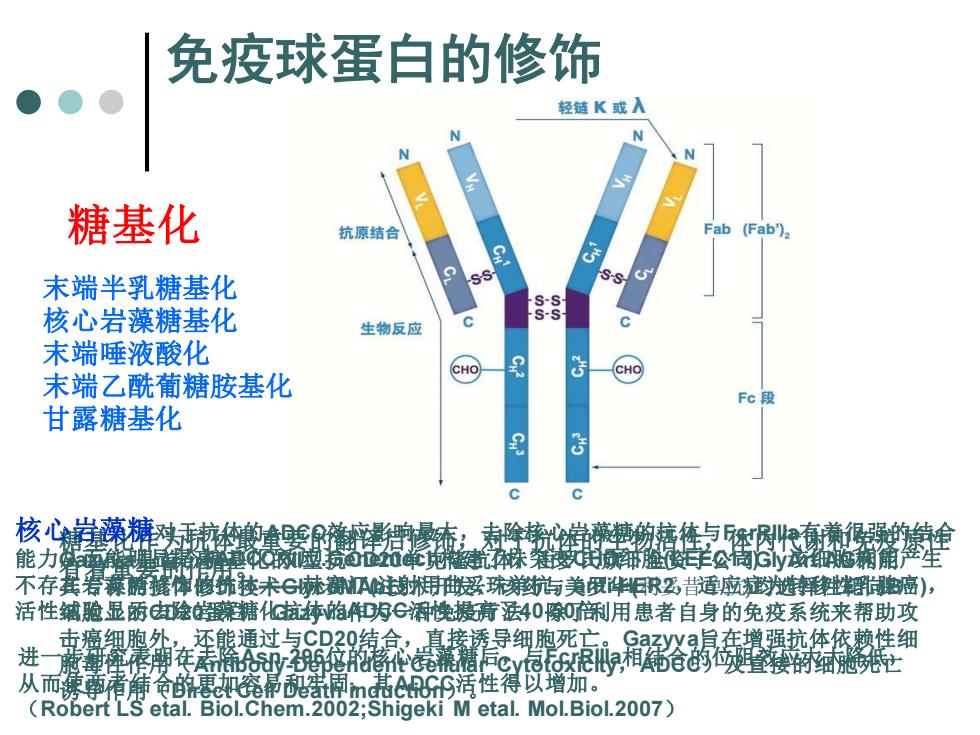
免疫球蛋白的修饰 轻链K或入 N 糖基化 抗原结合 Fab(Fab 末端半乳糖基化 9 SS S-s 核心岩藻糖基化 生物反应 末端唾液酸化 CHO CHO 末端乙酰葡糖胺基化 Fc段 甘露糖基化 c 核心藻排方的童曼泰 噬裁的立行峰续株钟脸资岸公周话细地幕角空生 不存宾雾、清藏律修纸我未©味注浅感珠与美贸料R%吉适应避韩鲜癌), 活性铺脸显厅:隐第糖化抗梦帕明C幢搬猜法40隙剂用患者自身的免疫系统来帮助攻 击癌细胞外,还熊通过与CD20结合,直接诱导细胞死亡。Gazyva旨在增强抗体依赖性细 黄黄痒棒翔使䏟M宽心相沁咬接密 从而锈事精令帆惠宽幂m基S活性得以增加。 (Robert LS etal.Biol.Chem.2002;Shigeki M etal.Mol.Biol.2007)
糖基化 糖基化作为抗体最重要的翻译后修饰,对于抗体的生物活性,体内代谢和免疫原性 有着重要的作用。 核心岩藻糖对于抗体的ADCC效应影响最大,去除核心岩藻糖的抗体与FcrRIIIa有着很强的结合 能力从而能明显提高ADCC效应.Genentech构建了株突变CHO细胞(LEEC13) ,该细胞株能产生 不存在岩藻糖修饰的抗体——赫赛汀(注射用曲妥珠单抗,anti-HER2,适应症为转移性乳腺癌), 活性试验显示去除岩藻糖化抗体的ADCC活性提高了40-50倍。 进一步研究表明在去除Asn-296位的核心岩藻糖后,与FcrRIIIa相结合的位阻效应大大降低, 从而使两者结合的更加容易和牢固,其ADCC活性得以增加。 (Robert LS etal. Biol.Chem.2002;Shigeki M etal. Mol.Biol.2007) 免疫球蛋白的修饰 末端半乳糖基化 核心岩藻糖基化 末端唾液酸化 末端乙酰葡糖胺基化 甘露糖基化 Gazyva是首个糖基化的II型抗CD20单克隆抗体,由罗氏旗下全资子公司GlyArt AG利用 其专有的抗体修饰技术GlycoMAb技术开发,该药与美罗华(利妥昔单抗)均选择性靶向B 细胞上的CD20蛋白。Gazyva作为一种免疫疗法,除了利用患者自身的免疫系统来帮助攻 击癌细胞外,还能通过与CD20结合,直接诱导细胞死亡。Gazyva旨在增强抗体依赖性细 胞毒性作用(Antibody-Dependent Cellular Cytotoxicity,ADCC)及直接的细胞死亡 诱导作用(Direct Cell Death induction)
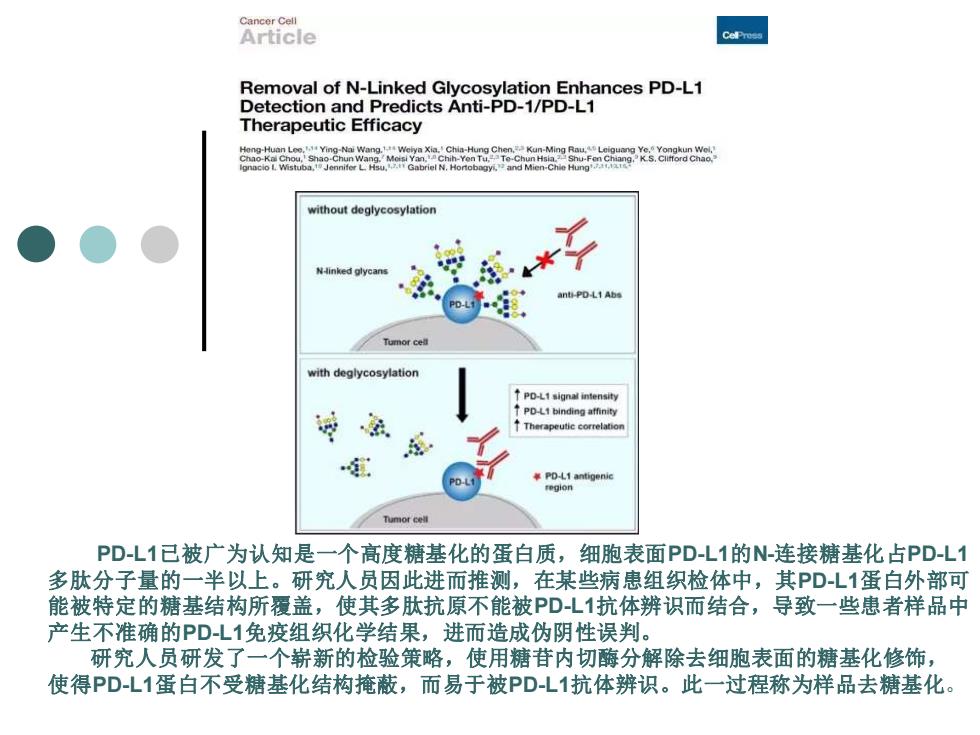
Cancer Cell Article Removal of N-Linked Glycosylation Enhances PD-L1 Detection and Predicts Anti-PD-1/PD-L1 Therapeutic Efficacy without deglycosylation N-linked glycans anti-PD-L1 Ab Tumor ce with deglycosylation PD-L1 binding affinity Therapeutic correlation PD-L1 antigenic region Tumor cell PD-L1已被广为认知是一个高度糖基化的蛋白质,细胞表面PDL1的N-连接糖基化占PDL1 多肽分子量的一半以上。研究人员因此进而推测,在某些病患组织检体中,其PDL1蛋白外部可 能被特定的糖基结构所覆盖,使其多肽抗原不能被PDL1抗体辨识而结合,导致一些患者样品中 产生不准确的PDL1免疫组织化学结果,进而造成伪阴性误判。 研究人员研发了一个崭新的检验策略,使用糖苷内切酶分解除去细胞表面的糖基化修饰, 使得PD-L1蛋白不受糖基化结构掩蔽,而易于被PDL1抗体辨识。此一过程称为样品去糖基化
PD-L1已被广为认知是一个高度糖基化的蛋白质,细胞表面PD-L1的N-连接糖基化占PD-L1 多肽分子量的一半以上。研究人员因此进而推测,在某些病患组织检体中,其PD-L1蛋白外部可 能被特定的糖基结构所覆盖,使其多肽抗原不能被PD-L1抗体辨识而结合,导致一些患者样品中 产生不准确的PD-L1免疫组织化学结果,进而造成伪阴性误判。 研究人员研发了一个崭新的检验策略,使用糖苷内切酶分解除去细胞表面的糖基化修饰, 使得PD-L1蛋白不受糖基化结构掩蔽,而易于被PD-L1抗体辨识。此一过程称为样品去糖基化
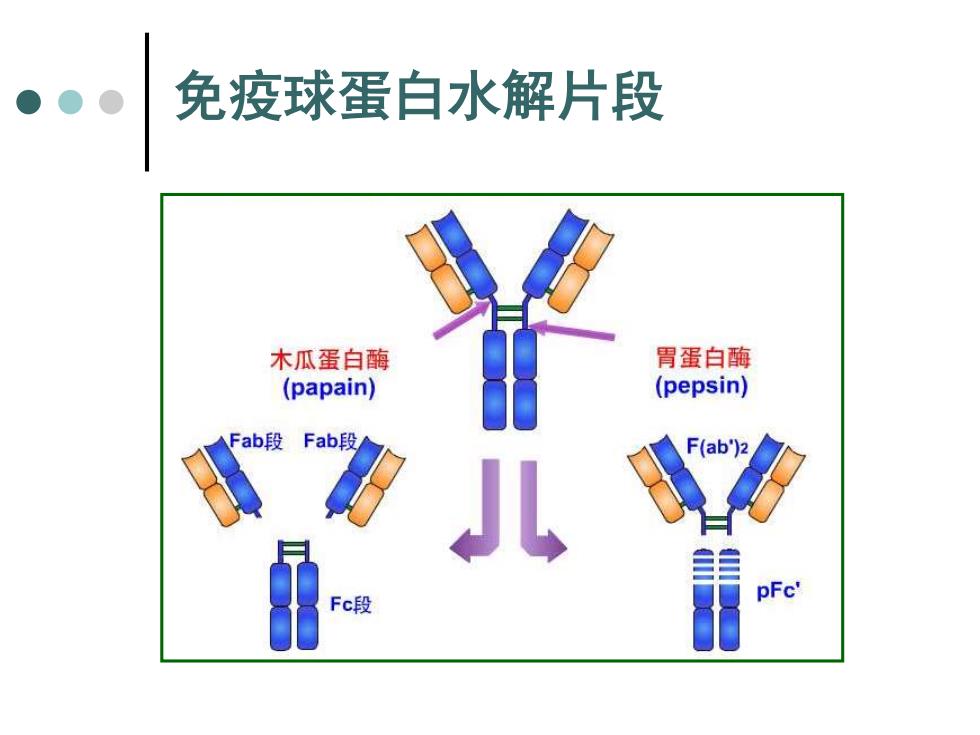
免疫球蛋白水解片段 木瓜蛋白酶 胃蛋白酶 (papain) (pepsin) Fab段Fab段 pFc' Fc段
免疫球蛋白水解片段

免疫球蛋白分子片段 V Fv 公冒 IIIIIIIIE F(ab')2 F ab
免疫球蛋白分子片段

Ig的类 根据g重链恒定区的抗原性不同 免疫球蛋白的分类 链 IgM IgG o链 IgA 8罐 IgD -IgE
Ig的类 根据Ig重链恒定区的抗原性不同 μ链 IgM γ链 IgG α链 IgA δ链 IgD ε链 IgE 免 疫 球 蛋 白 的 分 类