
第九章 紫外吸收光谱分析(Ultraviolet Spectrophotometry, UV ) §9-1 紫外吸收光谱法的基本特点 一、分子吸收光谱 1.分子吸收光谱的产生——由能级间的跃迁引起 能级:电子能级、振动能级、转动能级 跃迁:电子受激发,从低能级转移到高 能级的过程 E 分 = E 电 + E 振 + E 转 c 能级差 E = h = h
第九章 紫外吸收光谱分析(Ultraviolet Spectrophotometry, UV ) §9-1 紫外吸收光谱法的基本特点 一、分子吸收光谱 1.分子吸收光谱的产生——由能级间的跃迁引起 能级:电子能级、振动能级、转动能级 跃迁:电子受激发,从低能级转移到高 能级的过程 E 分 = E 电 + E 振 + E 转 c 能级差 E = h = h

2.分子吸收光谱的分类: 分子内运动涉及三种跃迁能级,所需能量大 小顺序 3.紫外-可见吸收光谱的产生 由于分子吸收中每个电子能级上耦合有许多 的振-转能级,所以处于紫外-可见光区的电子跃 迁而产生的吸收光谱具有 “带状吸收” 的特点。 E 电 E 振 E 转 远红外吸收光谱 红外吸收光谱 紫外 可见吸收光谱 转 振 电 = = = = = = − E e v m E e v m E e v m 0.005 ~ 0.05 250 ~ 25 0.05 ~1 25 ~1.25 1~ 20 0.06 ~1.25
2.分子吸收光谱的分类: 分子内运动涉及三种跃迁能级,所需能量大 小顺序 3.紫外-可见吸收光谱的产生 由于分子吸收中每个电子能级上耦合有许多 的振-转能级,所以处于紫外-可见光区的电子跃 迁而产生的吸收光谱具有 “带状吸收” 的特点。 E 电 E 振 E 转 远红外吸收光谱 红外吸收光谱 紫外 可见吸收光谱 转 振 电 = = = = = = − E e v m E e v m E e v m 0.005 ~ 0.05 250 ~ 25 0.05 ~1 25 ~1.25 1~ 20 0.06 ~1.25
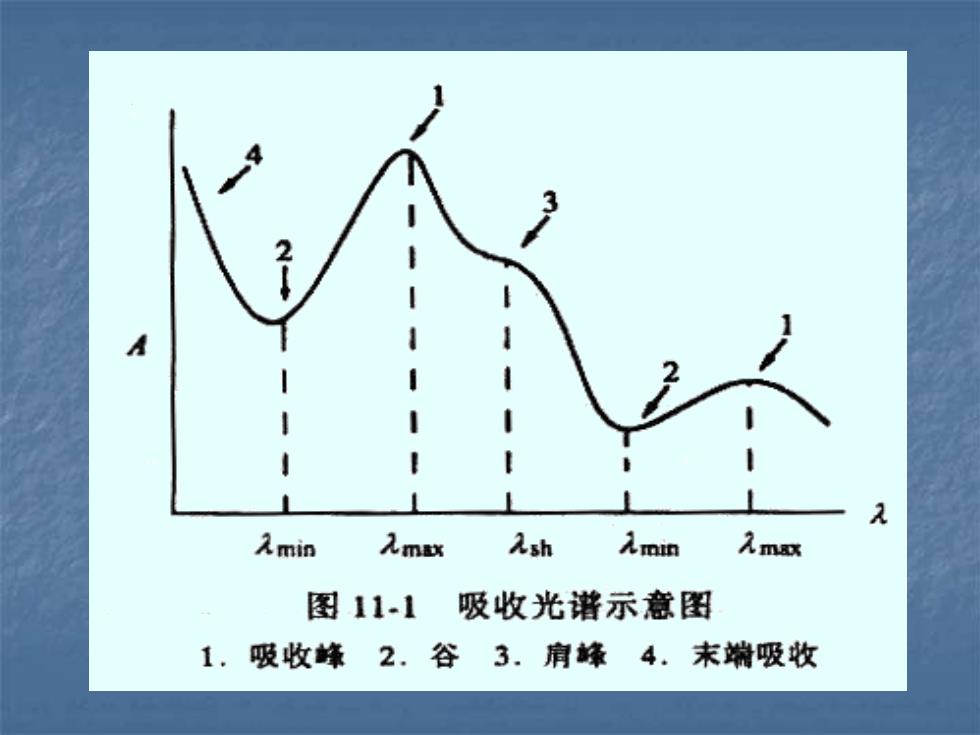
Amin 入mx Ash 入min 入mx 图11-1 吸收光谱示意图 1.吸收峰2.谷3.肩峰4.末端吸收
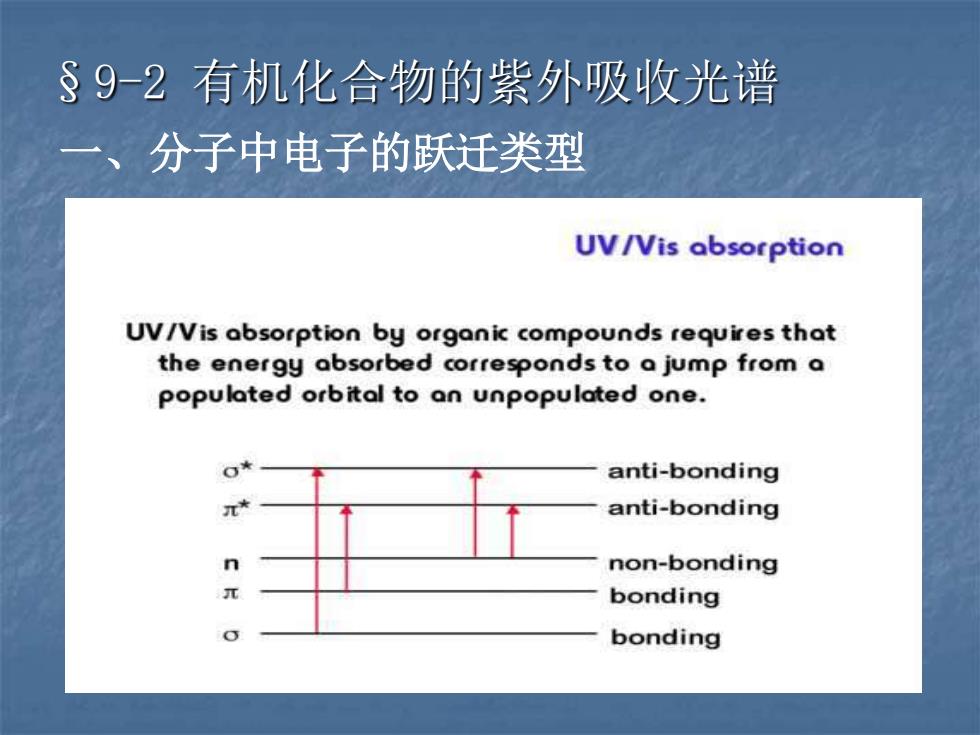
§9-2 有机化合物的紫外吸收光谱 一、分子中电子的跃迁类型
§9-2 有机化合物的紫外吸收光谱 一、分子中电子的跃迁类型

价电子: σ电子 → 饱和的σ键 π电子 → 不饱和的π键 n 电子 → 孤对电子 分子中分子轨道有成键轨道与反键轨道: 它们的能级高低为:σ n → σ* > π→ π* > n→ π*
价电子: σ电子 → 饱和的σ键 π电子 → 不饱和的π键 n 电子 → 孤对电子 分子中分子轨道有成键轨道与反键轨道: 它们的能级高低为:σ n → σ* > π→ π* > n→ π*

电子跃迁类型: ● N→V transitions include →* transitions in saturated organic compounds andπ→π* transitions in unsaturated compounds. ● N→Q transitions: a kind of transitions arise from the electron excitation from nonbonding orbital to anti-bonding orbital. ● N→R transition: electron is excited to a higher level until it is ionized to molecular ion. ● Charge transfer transitions: charge (electron) transfers between different parts of the compound due to charge redistribution of the compound excited by a radiation
电子跃迁类型: ● N→V transitions include →* transitions in saturated organic compounds andπ→π* transitions in unsaturated compounds. ● N→Q transitions: a kind of transitions arise from the electron excitation from nonbonding orbital to anti-bonding orbital. ● N→R transition: electron is excited to a higher level until it is ionized to molecular ion. ● Charge transfer transitions: charge (electron) transfers between different parts of the compound due to charge redistribution of the compound excited by a radiation
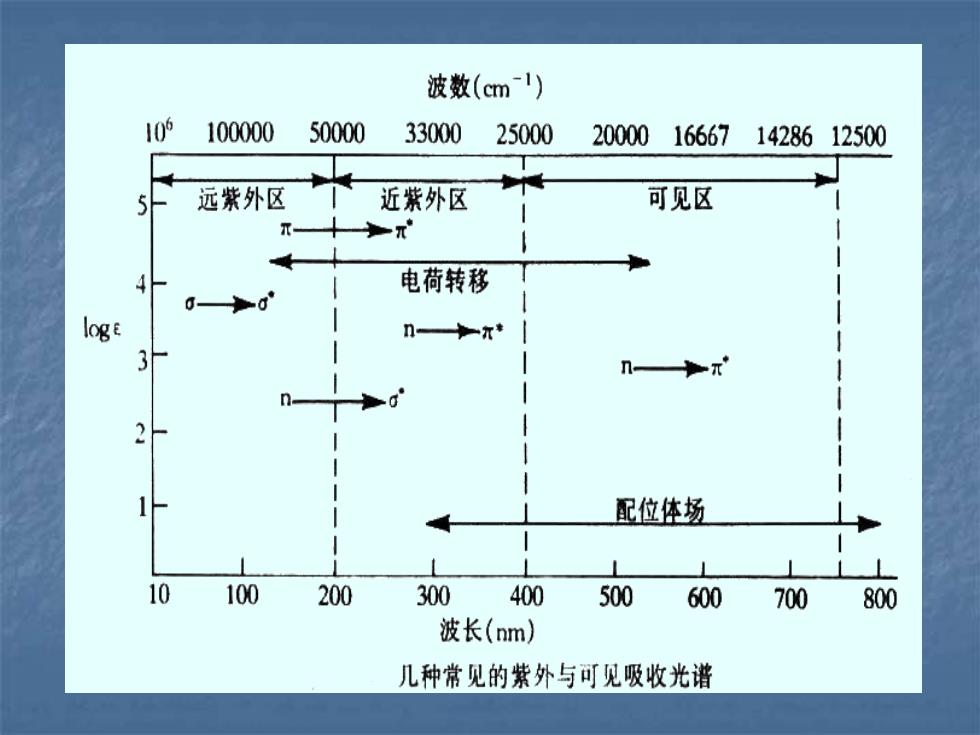
波数(cml) 10 100000 50000 33000 25000 20000 166671428612500 远紫外区 近紫外区 可见区 电荷转移 logE n-t 配位体场 10 100 200 300 400 500 600 700 800 波长(nm) 几种常见的紫外与可见吸收光谱

1. σ→ σ* 跃迁: 饱和烃(甲烷,乙烷) 能量很高,λ<150nm(远紫外区) 2. n → σ* 跃迁: 含杂原子饱和基团(—OH,—NH2) 能量较大,λ150~250nm(真空紫外区) 3. π→ π*跃迁: 不饱和基团(—C=C—,—C = O ) 能量较小,λ~ 200nm 体系共轭,E更小,λ更大 4. n→ π*跃迁: 含杂原子不饱和基团(—C ≡N ,C= O ) 能量最小,λ 200~400nm(近紫外区)
1. σ→ σ* 跃迁: 饱和烃(甲烷,乙烷) 能量很高,λ<150nm(远紫外区) 2. n → σ* 跃迁: 含杂原子饱和基团(—OH,—NH2) 能量较大,λ150~250nm(真空紫外区) 3. π→ π*跃迁: 不饱和基团(—C=C—,—C = O ) 能量较小,λ~ 200nm 体系共轭,E更小,λ更大 4. n→ π*跃迁: 含杂原子不饱和基团(—C ≡N ,C= O ) 能量最小,λ 200~400nm(近紫外区)

二、生色团与助色团 生色团:能吸收紫外-可见光的基团叫生色团。 对有机化合物:主要为具有不饱和键和未成对 电子的基团。 例: C=C;C=O;C=N;—N=N— 注:当出现几个发色团共轭,则几个发色团所产生的 吸收带将消失,代之出现新的共轭吸收带,其波 长将比单个发色团的吸收波长长,强度也增强。 助色团:本身无紫外吸收,但可以使生色团吸收 峰加 强同时使吸收峰长移的基团。 对有机化合物:主要为连有杂原子的饱和基团 例:—OH,—OR,—NH—,—NR2—,—X
二、生色团与助色团 生色团:能吸收紫外-可见光的基团叫生色团。 对有机化合物:主要为具有不饱和键和未成对 电子的基团。 例: C=C;C=O;C=N;—N=N— 注:当出现几个发色团共轭,则几个发色团所产生的 吸收带将消失,代之出现新的共轭吸收带,其波 长将比单个发色团的吸收波长长,强度也增强。 助色团:本身无紫外吸收,但可以使生色团吸收 峰加 强同时使吸收峰长移的基团。 对有机化合物:主要为连有杂原子的饱和基团 例:—OH,—OR,—NH—,—NR2—,—X

三、红移和蓝移 由于化合物结构变化(共轭、引入助色团取代 基)或采用不同溶剂后 吸收峰位置向长波方向的移动,叫红移 吸收峰位置向短波方向移动,叫蓝移 四、增色效应和减色效应 增色效应:吸收强度增强的效应 减色效应:吸收强度减小的效应 五、强带和弱带: εmax > 105 → 强带 εmin < 103 → 弱带
三、红移和蓝移 由于化合物结构变化(共轭、引入助色团取代 基)或采用不同溶剂后 吸收峰位置向长波方向的移动,叫红移 吸收峰位置向短波方向移动,叫蓝移 四、增色效应和减色效应 增色效应:吸收强度增强的效应 减色效应:吸收强度减小的效应 五、强带和弱带: εmax > 105 → 强带 εmin < 103 → 弱带