
第四章 电位分析法(Potentiometry) §4-1 电化学分析法概述 一、电化学分析( electrochemical analysis ) 根据物质在溶液中的电化学性质及其变 化来进行分析的方法称电化学分析。 它是以溶液电导、电位、电流和电量等 电化学参数与被测物质含量之间的关系作为计量 基础。电化学分析方法主要有下面几类: 1.电导分析法: 测定电阻参量 2.电位分析法: 测定电压参量 3.电解分析法: 测定电量参量 4.库仑分析法: 测定电流-时间参量 5.极谱法和伏安: 测定电压-电流参量
第四章 电位分析法(Potentiometry) §4-1 电化学分析法概述 一、电化学分析( electrochemical analysis ) 根据物质在溶液中的电化学性质及其变 化来进行分析的方法称电化学分析。 它是以溶液电导、电位、电流和电量等 电化学参数与被测物质含量之间的关系作为计量 基础。电化学分析方法主要有下面几类: 1.电导分析法: 测定电阻参量 2.电位分析法: 测定电压参量 3.电解分析法: 测定电量参量 4.库仑分析法: 测定电流-时间参量 5.极谱法和伏安: 测定电压-电流参量

二、电化学电池( electrochemical cell ) 它是由一对电极、电解质和外电路三部分 组成,它常分为原电池和电解池两类。 原电池(primary cell):自发的将电池 内部进行的化学反应所产生的能量转化成电能 的化学电池。 电解池(electrolytic cell):实现电 化学反应的能量由外电源供给的化学电池,它 是将电能转变为化学能
二、电化学电池( electrochemical cell ) 它是由一对电极、电解质和外电路三部分 组成,它常分为原电池和电解池两类。 原电池(primary cell):自发的将电池 内部进行的化学反应所产生的能量转化成电能 的化学电池。 电解池(electrolytic cell):实现电 化学反应的能量由外电源供给的化学电池,它 是将电能转变为化学能

三、电池的电动势( E电池 ) 电池的电动势:是指当流过电池的电流为零 或接近于零时两极间的电位差。 其中E 0’代表氧化或还原半反应的电极电 位、ΔE相间电位 代表电池中的液接电位(来源于 浓度差或盐桥)和膜电位。 E电池 = E 正极 − E 负极 + E相间电位 0 0
三、电池的电动势( E电池 ) 电池的电动势:是指当流过电池的电流为零 或接近于零时两极间的电位差。 其中E 0’代表氧化或还原半反应的电极电 位、ΔE相间电位 代表电池中的液接电位(来源于 浓度差或盐桥)和膜电位。 E电池 = E 正极 − E 负极 + E相间电位 0 0

四、电极上半反应的电极电位(E’ ) 电池中发生的反应是氧化还原反应,根据 物理化学知识可知总反应常用氧化半反应和还 原半反应来表示。电极上每个半反应的还原电 极电位(E ’ )与反应型体活度的关系由能斯特 方程(Nernst equation )表示: 若某一电极上半反应的方程式为: Ox + ne Red 则其电极电位为 a a Red Ox ln nF RT E = E +
四、电极上半反应的电极电位(E’ ) 电池中发生的反应是氧化还原反应,根据 物理化学知识可知总反应常用氧化半反应和还 原半反应来表示。电极上每个半反应的还原电 极电位(E ’ )与反应型体活度的关系由能斯特 方程(Nernst equation )表示: 若某一电极上半反应的方程式为: Ox + ne Red 则其电极电位为 a a Red Ox ln nF RT E = E +

五、电极的类型 1、基于电子交换反应的电极 (1) 第一类电极: M n+/M (2) 第二类电极: M/MX(固体) (3) 第三类电极: M/MX (s),NX (s), N n+ , (4) 第零类电极: 惰性金属 2、选择性电极 (1)离子选择性电极(ion selective electrode, ISE) 包括常见的各种膜电极。 (2)生物活性物选择性电极。 包括组织电极和酶电极。 (3)场效应微电子传感器(集成电极)
五、电极的类型 1、基于电子交换反应的电极 (1) 第一类电极: M n+/M (2) 第二类电极: M/MX(固体) (3) 第三类电极: M/MX (s),NX (s), N n+ , (4) 第零类电极: 惰性金属 2、选择性电极 (1)离子选择性电极(ion selective electrode, ISE) 包括常见的各种膜电极。 (2)生物活性物选择性电极。 包括组织电极和酶电极。 (3)场效应微电子传感器(集成电极)

§4-2 电位分析法原理 电位分析法(potentiometry):是基于测 量浸入被测液中两电极间的电动势或电动势变化 来进行定量分析的一种电化学分析方法,称为电 位分析法。根据分析应用的方式又可分为直接电 位法和电位滴定法。 直接电位法(direct potentiometry) :是将电 极插入被测液中构成原电池,根据原电池的电动 势与被测离子活度间的函数关系直接测定离子活 度的方法。 电位滴定法 (potentiometric titration): 是 借助测量滴定过程中电池电动势的突变来确定滴 定终点,再根据反应计量关系进行定量的方法
§4-2 电位分析法原理 电位分析法(potentiometry):是基于测 量浸入被测液中两电极间的电动势或电动势变化 来进行定量分析的一种电化学分析方法,称为电 位分析法。根据分析应用的方式又可分为直接电 位法和电位滴定法。 直接电位法(direct potentiometry) :是将电 极插入被测液中构成原电池,根据原电池的电动 势与被测离子活度间的函数关系直接测定离子活 度的方法。 电位滴定法 (potentiometric titration): 是 借助测量滴定过程中电池电动势的突变来确定滴 定终点,再根据反应计量关系进行定量的方法

电位分析法的实质是通过在零电流条件下 测定两电极间的电位差(即所构成原电他的电动 势) 进行分析测定。 由于电位法测定的是一个原电池的平衡电 动势值,而电池的电动势与组成电池的两个电极 的电极电位密切相关,所以我们一般将电极电位 与被测离子活度变化相关的电极称指示电极或工 作电极,而将在测定过程中其电极电位保持恒定 不变的另一支电极叫参比电极。 若参比电极的电极电位能保持不变,则测得电池 的电动势就仅与指示电极有关,进而也就与被测 离子活度有关。 E电 池 = E+ − E−
电位分析法的实质是通过在零电流条件下 测定两电极间的电位差(即所构成原电他的电动 势) 进行分析测定。 由于电位法测定的是一个原电池的平衡电 动势值,而电池的电动势与组成电池的两个电极 的电极电位密切相关,所以我们一般将电极电位 与被测离子活度变化相关的电极称指示电极或工 作电极,而将在测定过程中其电极电位保持恒定 不变的另一支电极叫参比电极。 若参比电极的电极电位能保持不变,则测得电池 的电动势就仅与指示电极有关,进而也就与被测 离子活度有关。 E电 池 = E+ − E−
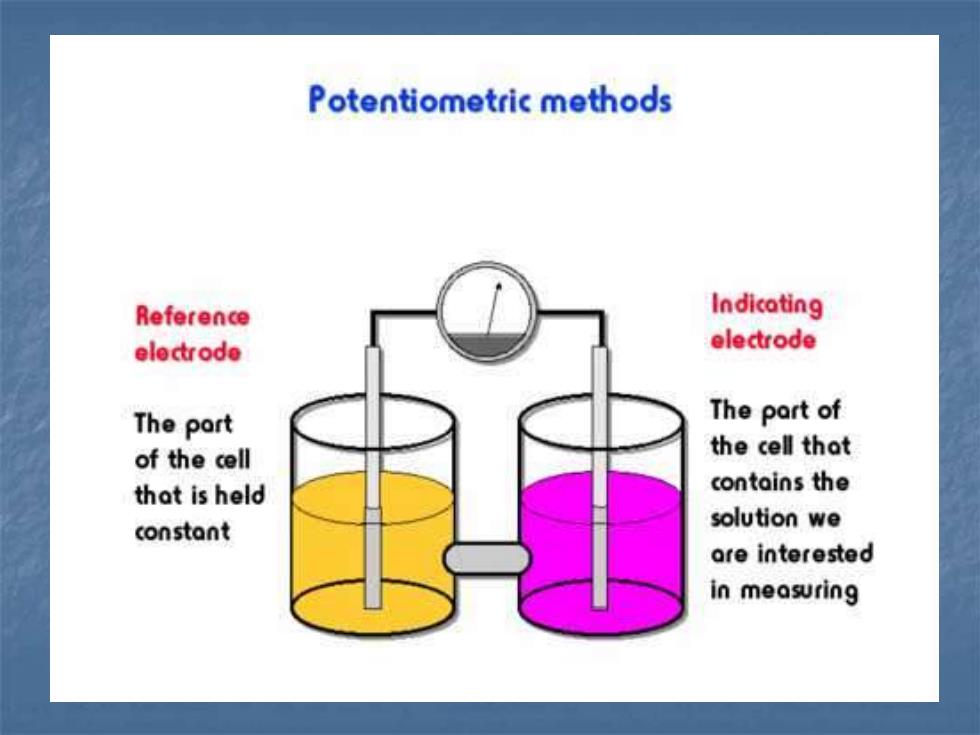
Potentiometric methods Reference Indicating electrode electrode The port The part of of the cell the cell thot that is held contains the constant solution we are interested in measuring
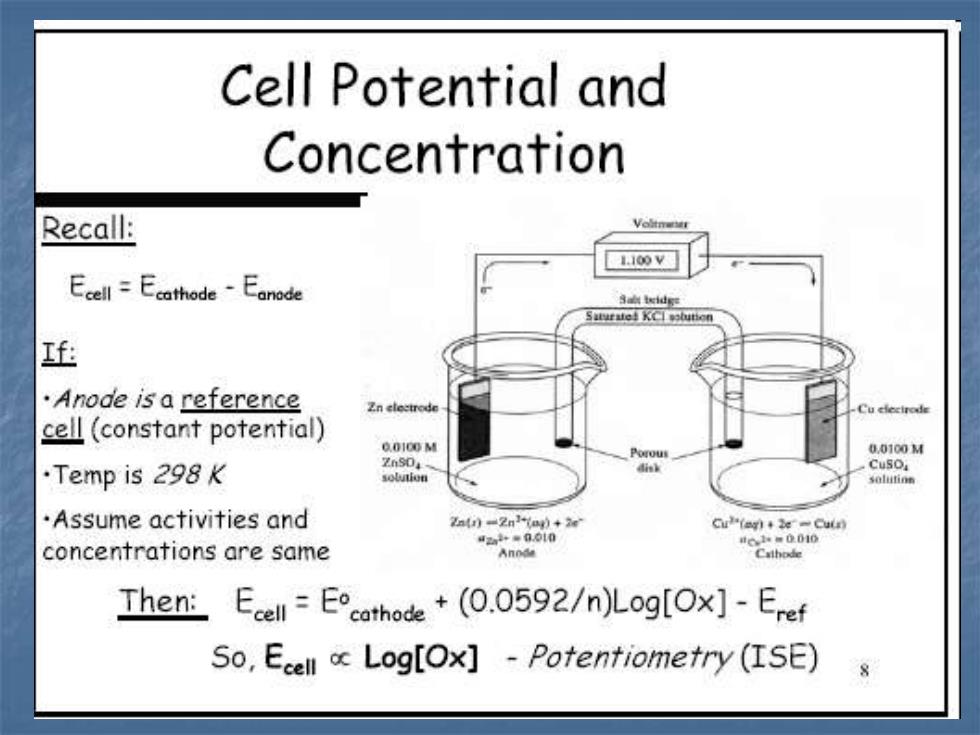
Cell Potential and Concentration Recall: Voltnar 110oV Ecell =Ecathode-Eanede Sal teidge Saturate KCI olutior f ·Anode is a reference Zn cleetrode cell(constant potential) 0.0100d 0.0100M .Temp is 298K 2nS04 Cuso sobaion .Assume activities and 2a)=2n1a)+2e Cu(ag)2e -Cuin 42+=0010 t6,1w=0010 concentrations are same Cathode Then:Ecell Ecothode +(0.0592/n)Log[Ox]-Eref So,Ecell o Log[Ox]-Potentiometry (ISE)
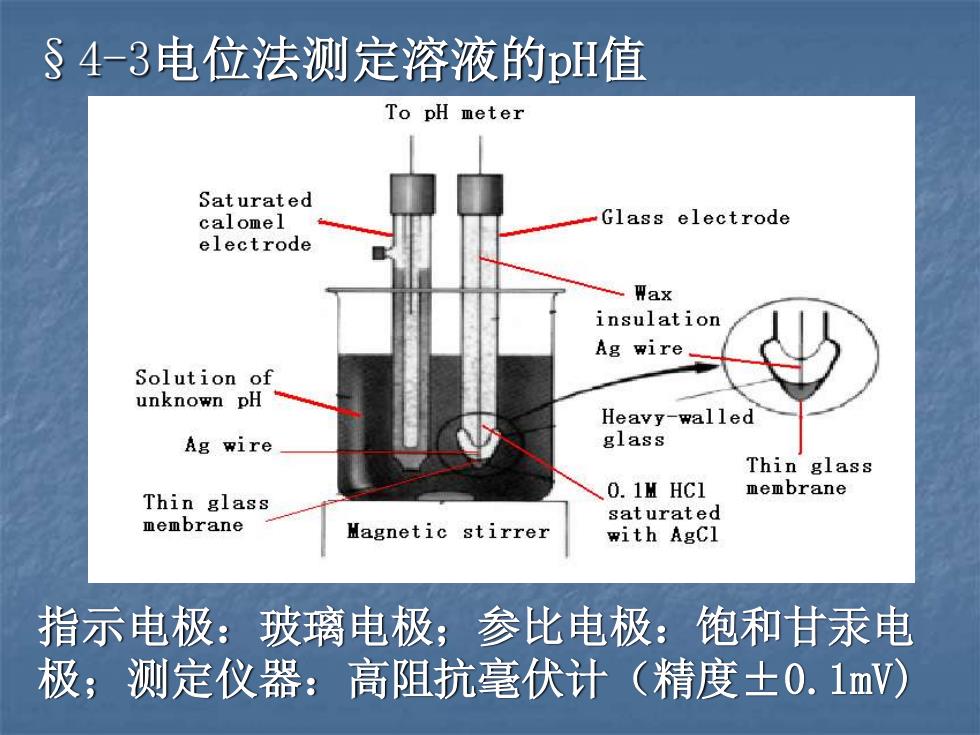
§4-3电位法测定溶液的pH值 指示电极:玻璃电极;参比电极:饱和甘汞电 极;测定仪器:高阻抗毫伏计(精度±0.1mV)
§4-3电位法测定溶液的pH值 指示电极:玻璃电极;参比电极:饱和甘汞电 极;测定仪器:高阻抗毫伏计(精度±0.1mV)