
第三节 酶促反应动力学 Kinetics of enzyme-catalyzed reaction
第三节 酶促反应动力学 Kinetics of enzyme-catalyzed reaction

研究内容:酶促反应速度及其影响因素。 酶促反应的速度用单位时间内底物(substrate) 减少或产物增加的量来表示。 酶促反应速度的影响因素:底物浓度、酶浓 度、温度、pH值、抑制剂、激活剂等
◼ 研究内容:酶促反应速度及其影响因素。 ◼ 酶促反应的速度用单位时间内底物(substrate) 减少或产物增加的量来表示。 ◼ 酶促反应速度的影响因素:底物浓度、酶浓 度、 温度、 pH值、抑制剂、激活剂等

一、底物浓度对反应速度的影响 研究前提: I. 单底物、单产物反应 Il. 反应速度取其初速度,即反应刚刚开始 产物的生成量极少,逆反应可不予考虑 I.底物浓度远远大于酶浓度 在其他因素不变的情况下,底物浓度对 反应速度的影响呈矩形双曲线关系
一、底物浓度对反应速度的影响 I. 单底物、单产物反应 II. 反应速度取其初速度,即反应刚刚开始, 产物的生成量极少,逆反应可不予考虑 III. 底物浓度远远大于酶浓度 ➢ 研究前提: ❖ 在其他因素不变的情况下,底物浓度对 反应速度的影响呈矩形双曲线关系
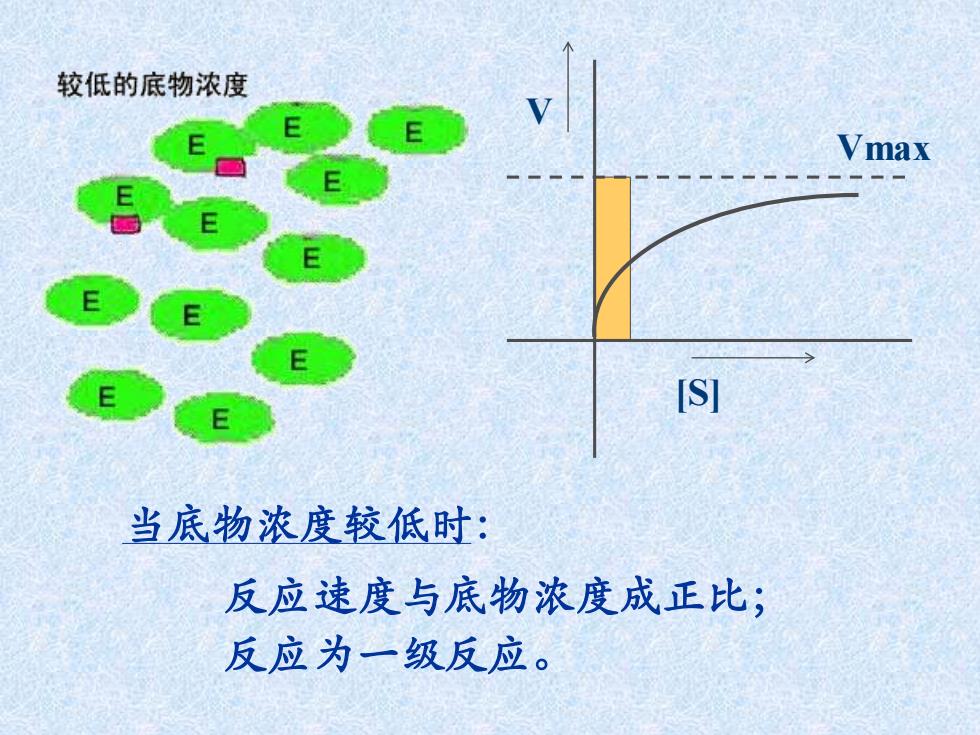
较低的底物浓度 Vmax E [S] 当底物浓度较低时: 反应速度与底物浓度成正比; 反应为一级反应
当底物浓度较低时: 反应速度与底物浓度成正比; 反应为一级反应。 [S] V Vmax
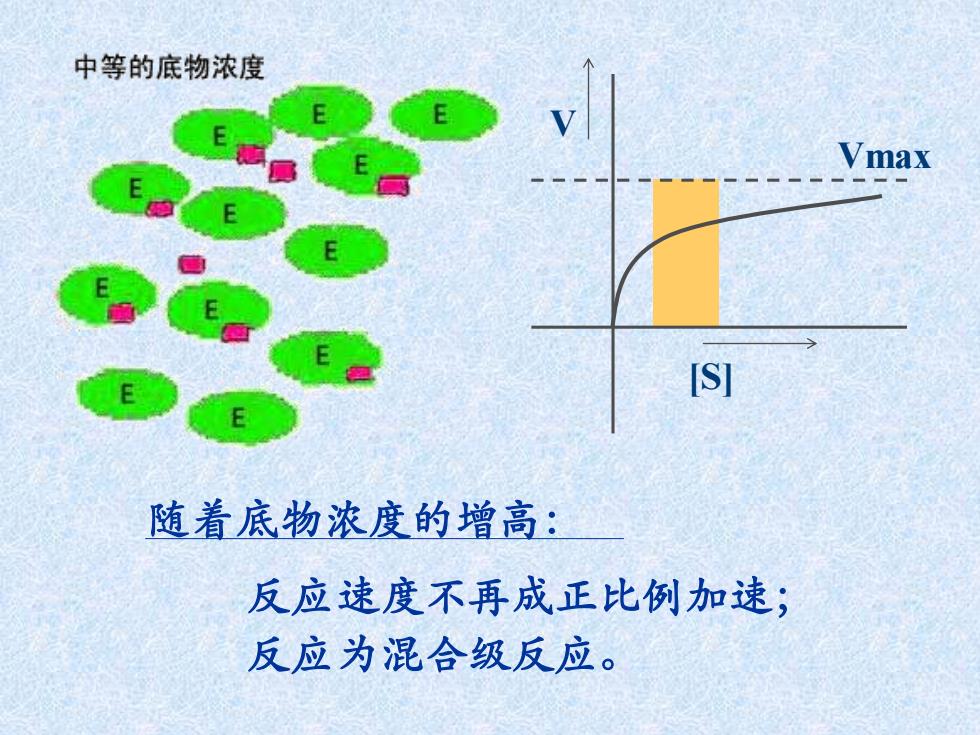
中等的底物浓度 Vmax S 随着底物浓度的增高: 反应速度不再成正比例加速; 反应为混合级反应
随着底物浓度的增高: 反应速度不再成正比例加速; 反应为混合级反应。 [S] V Vmax
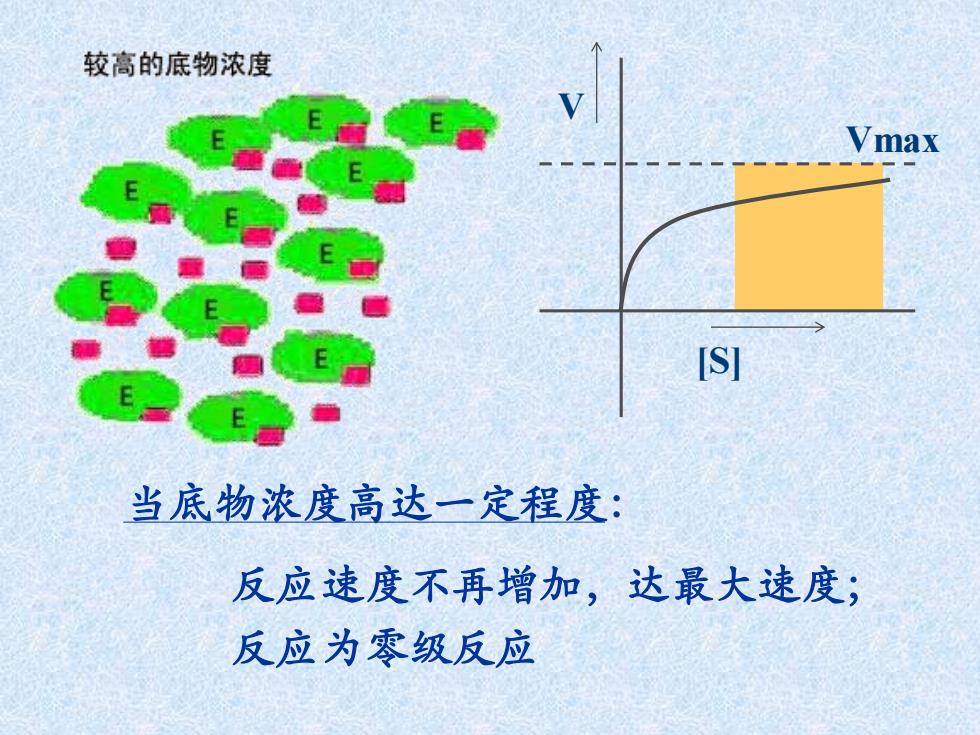
较高的底物浓度 Vmax [S] 当底物浓度高达一定程度: 反应速度不再增加,达最大速度; 反应为零级反应
当底物浓度高达一定程度: 反应速度不再增加,达最大速度; 反应为零级反应 [S] V Vmax

(一)米-曼氏方程式 酶促反应模式一一中间产物学说 k k E+S ES 之E十P 中间产物
(一)米-曼氏方程式 ❖ 酶促反应模式——中间产物学说 k1 k3 E + S ES E + P k2 k4 中间产物

※1913年Michaelis和Menten提出反应速度与 底物浓度关系的数学方程式,即米-曼氏方程 式,简称米氏方程式(Michaelis equation)。 max [S] Km+S S:底物浓度 V:不同S时的反应速度 最大反应速度(maximum velocity) Km:米氏常数(Michaelis constant)
※1913年Michaelis和Menten提出反应速度与 底物浓度关系的数学方程式,即米-曼氏方程 式,简称米氏方程式(Michaelis equation)。 [S]:底物浓度 V:不同[S]时的反应速度 Vmax:最大反应速度(maximum velocity) Km:米氏常数(Michaelis constant) Vmax [S] Km+S V =

米-曼氏方程式推导基于两个假设: E与$形成ES复合物的反应是快速平衡反应 而E$分解为E及P的反应为慢反应,反应速 度取决于慢反应即V=kES] S的总浓度远远大于的总浓度,因此在反应 的初始阶段,S的浓度可认为不变即IS=[S】
米-曼氏方程式推导基于两个假设: ➢ E与S形成ES复合物的反应是快速平衡反应 而ES分解为E及P的反应为慢反应,反应速 度取决于慢反应即V=k3 [ES] ➢ S的总浓度远远大于E的总浓度,因此在反应 的初始阶段,S的浓度可认为不变即[S]=[St ]
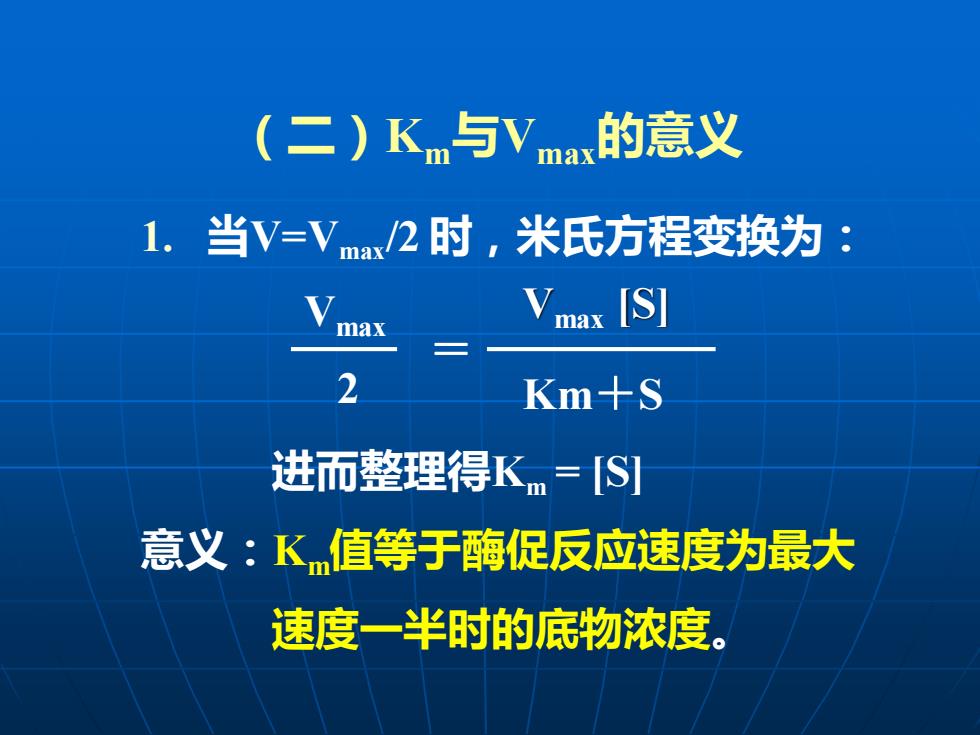
(二)Km与Vmax的意义 1.当V=Vmax2时,米氏方程变换为: max max [S] 2 Km+S 进而整理得Km=S] 意义:K值等于酶促反应速度为最大 速度一半时的底物浓度
(二)Km与Vmax的意义 1. 当V=Vmax/2 时,米氏方程变换为: 进而整理得Km = [S] 意义:Km值等于酶促反应速度为最大 速度一半时的底物浓度。 Vmax [S] Km+S Vmax 2 =