
离子聚合 5.1引言 离子聚合的理论研究开始于五十年代 1953年,Ziegler在常温低压下制得E 1956年,Szwarc发现了“活性聚合物'” 离子聚合有别于自由基聚合的特点: 0 根本区别在于聚合活性种不同 离子聚合的活性种是带电荷的离子: 碳阳离子 通常是 碳阴离子
离 子 聚 合 离子聚合的理论研究开始于五十年代 1953年,Ziegler在常温低压下制得PE 1956年,Szwarc发现了“活性聚合物” 离子聚合有别于自由基聚合的特点: 根本区别在于聚合活性种不同 离子聚合的活性种是带电荷的离子: 5.1 引言 碳阳离子 碳阴离子 5 通常是

离子聚合对单体有较高的选择性 带有1,1-二烷基、烷氧基等推电子基的单体才能进 行阳离子聚合 具有腈基、羰基等强吸电子基的单体才能进行阴离 子聚合 羰基化合物、杂环化合物,大多属离子聚合 ▣聚合机理和动力学研究不如自由基聚合成熟 聚合条件苛刻,微量杂质有极大影响,聚合重现性差 原因 聚合速率快,需低温聚合,给研究工作造成困难 反应介质的性质对反应也有极大的影响,影响因素 复杂
离子聚合对单体有较高的选择性 聚合机理和动力学研究不如自由基聚合成熟 原因 聚合条件苛刻,微量杂质有极大影响,聚合重现性差 聚合速率快,需低温聚合,给研究工作造成困难 反应介质的性质对反应也有极大的影响,影响因素 复杂 带有1,1-二烷基、烷氧基等推电子基的单体才能进 行阳离子聚合 具有腈基、羰基等强吸电子基的单体才能进行阴离 子聚合 羰基化合物、杂环化合物,大多属离子聚合

5.2阳离子聚合 到目前为止,对阳离子聚合的认识还不很深入 原因: 阳离子活性很高,极易发生各种副反应,很难获得 高分子量的聚合物 碳阳离子易发生和碱性物质的结合、转移、异构化 等副反应—构成了阳离子聚合的特点 引发过程十分复杂,至今未能完全确定 目前采用阳离子聚合并大规模工业化的产品只 有丁基橡胶
5.2 阳离子聚合 到目前为止,对阳离子聚合的认识还不很深入 原因: 阳离子活性很高,极易发生各种副反应,很难获得 高分子量的聚合物 碳阳离子易发生和碱性物质的结合、转移、异构化 等副反应——构成了阳离子聚合的特点 引发过程十分复杂,至今未能完全确定 目前采用阳离子聚合并大规模工业化的产品只 有丁基橡胶
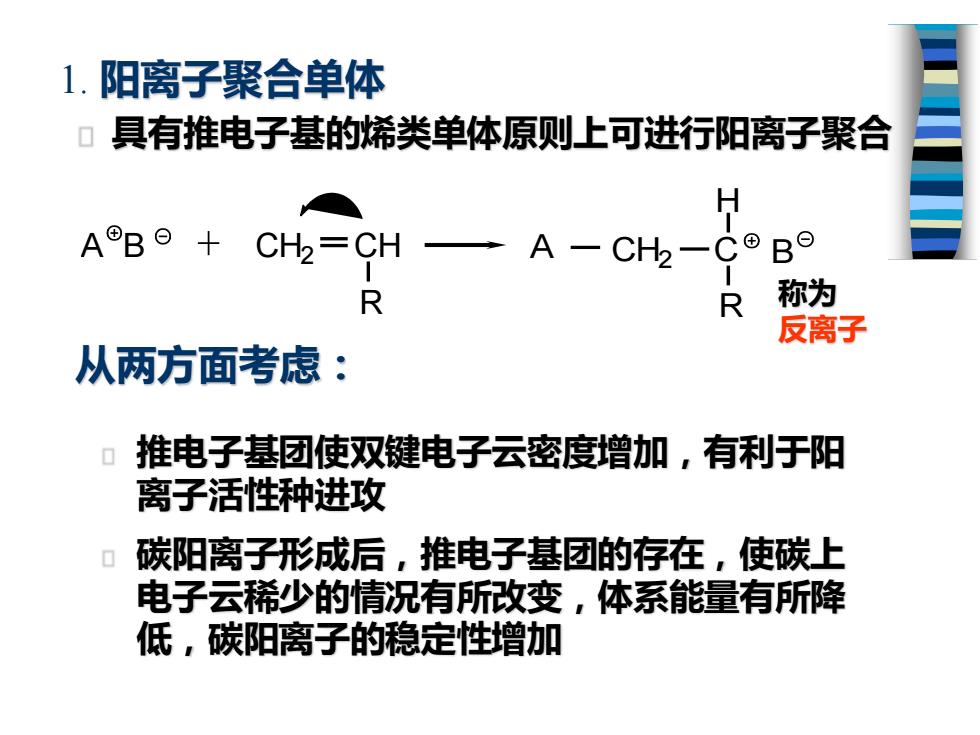
1.阳离子聚合单体 ▣具有推电子基的烯类单体原则上可进行阳离子聚合 H A®B⊙+ CH2=CH一A-CH2-CoBO R R 称为 反离子 从两方面考虑: 推电子基团使双键电子云密度增加,有利于阳 离子活性种进攻 ▣碳阳离子形成后,推电子基团的存在,使碳上 电子云稀少的情况有所改变,体系能量有所降 低,碳阳离子的稳定性增加
1. 阳离子聚合单体 具有推电子基的烯类单体原则上可进行阳离子聚合 推电子基团使双键电子云密度增加,有利于阳 离子活性种进攻 碳阳离子形成后,推电子基团的存在,使碳上 电子云稀少的情况有所改变,体系能量有所降 低,碳阳离子的稳定性增加 A B CH2 CH R + CH2 C R A B H 称为 反离子 从两方面考虑:

能否聚合成高聚物,还要求: 质子对碳·碳双键有较强的亲合力 增长反应比其它副反应快,即生成的碳阳离子有适 当的稳定性 o 对单体种类进行讨论(可由热焓一△H判断): -烯烃 CH2=CH CH2=CH CH-CH CH3 C2H5 无取代基,不易 质子亲和力较大,有利于反应 极化,对质子亲 但一个烷基的供电性不强,R不快; 和力小,不能发 仲碳阳离子较活泼,容易重排,生 生阳离子聚合 成更稳定的叔碳阳离子
质子对碳-碳双键有较强的亲合力 增长反应比其它副反应快,即生成的碳阳离子有适 当的稳定性 对单体种类进行讨论 (可由热焓-△H判断): 能否聚合成高聚物,还要求: -烯烃 CH2 CH2 无取代基,不易 极化,对质子亲 和力小,不能发 生阳离子聚合 CH2 CH CH3 CH2 CH C2 H5 质子亲和力较大,有利于反应 但一个烷基的供电性不强,Rp不快; 仲碳阳离子较活泼,容易重排,生 成更稳定的叔碳阳离子
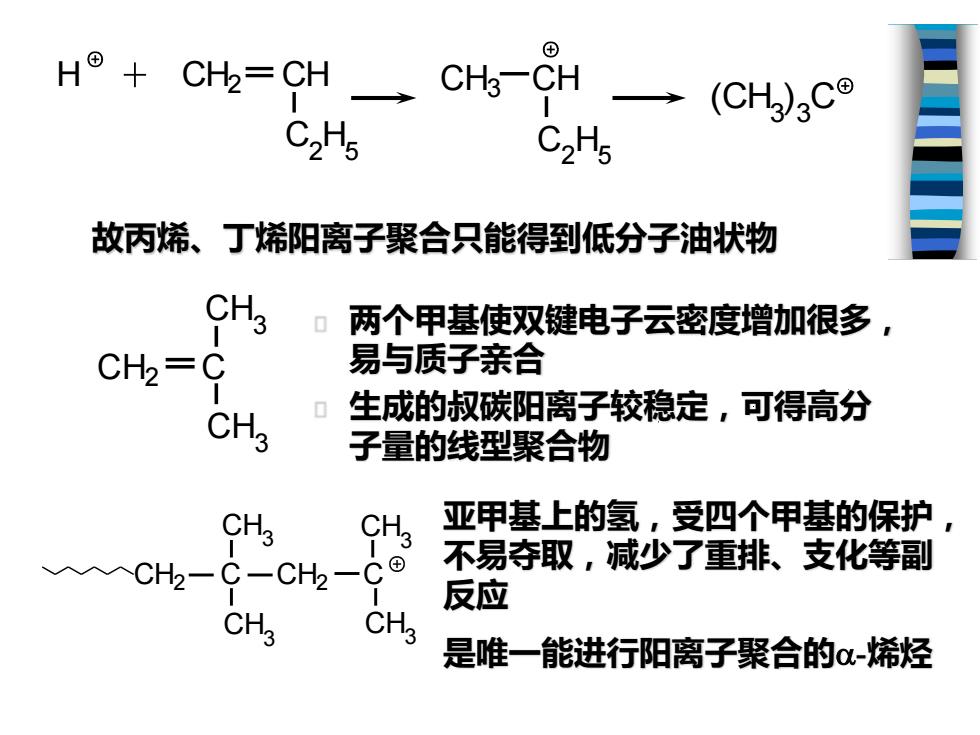
H⑧+CH2=CH CHs一CH→(CH)3C8 C2H5 C2H5 故丙烯、丁烯阳离子聚合只能得到低分子油状物 CH3 两个甲基使双键电子云密度增加很多, CH2=C 易与质子亲合 CH3 生成的叔碳阳离子较稳定,可得高分 子量的线型聚合物 CH3 S 亚甲基上的氢,受四个甲基的保护 入CH2 -CH2 C⊙ 不易夺取,减少了重排、支化等副 反应 CH3 CH3 是唯一能进行阳离子聚合的-烯烃
两个甲基使双键电子云密度增加很多, 易与质子亲合 生成的叔碳阳离子较稳定,可得高分 子量的线型聚合物 H + CH2 CH C2 H5 CH3 CH C2 H5 (CH3 ) 3 C 故丙烯、丁烯阳离子聚合只能得到低分子油状物 CH2 C CH3 CH3 CH2 C CH2 C CH3 CH3 CH3 CH3 亚甲基上的氢,受四个甲基的保护, 不易夺取,减少了重排、支化等副 反应 是唯一能进行阳离子聚合的-烯烃
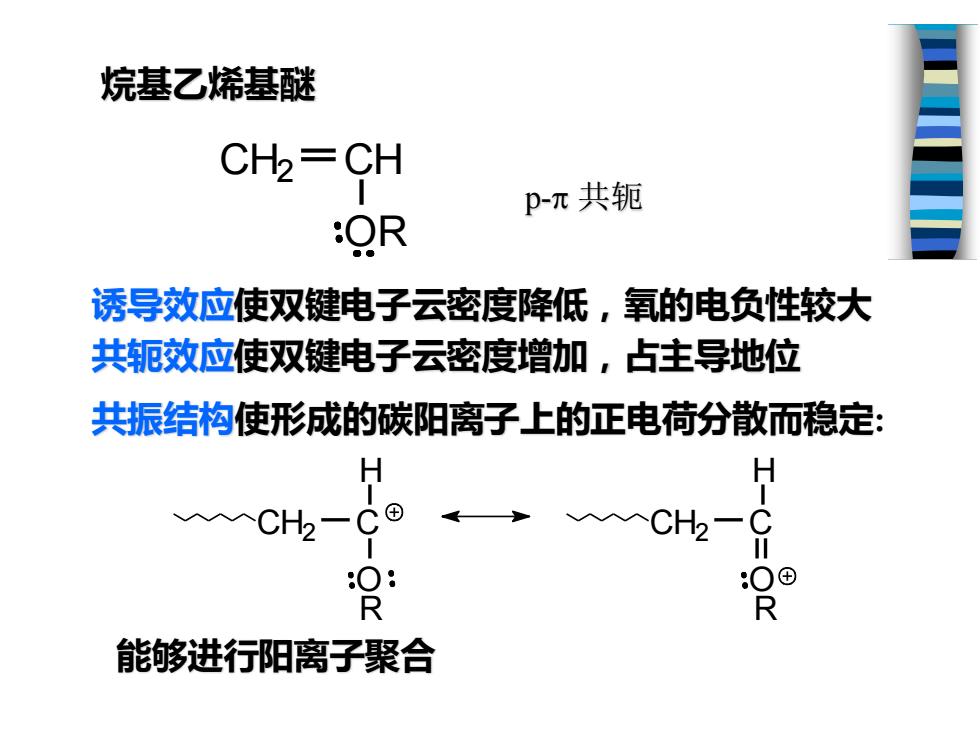
烷基乙烯基醚 CH2=CH pπ共轭 OR 诱导效应使双键电子云密度降低,氧的电负性较大 共轭效应使双键电子云密度增加,占主导地位 共振结构使形成的碳阳离子上的正电荷分散而稳定: H CH一C® 0® R R 能够进行阳离子聚合
烷基乙烯基醚 诱导效应使双键电子云密度降低,氧的电负性较大 共轭效应使双键电子云密度增加,占主导地位 CH2 C O H CH2 C O H R R p- 共轭 共振结构使形成的碳阳离子上的正电荷分散而稳定: OR CH2 CH 能够进行阳离子聚合

▣共轭烯烃 如;St,o-MeSt,B,I π电子的活动性强,易诱导极化,既能阳离子 聚合,又能阴离子聚合 但聚合活性远不如异丁烯、乙烯烷基醚,工业 很少进行这类单体的阳离子聚合 2.阳离子聚合引发体系及引发作用 阳离子聚合的引发剂都是亲电试剂,即电子接受体 阳离子聚合的引发方式: 引发剂生成阳离子,引发单体生成碳阳离子 电荷转移引发,即引发剂和单体先形成电荷转移络 合物而后引发
共轭烯烃 如;St,-MeSt,B,I 电子的活动性强,易诱导极化,既能阳离子 聚合,又能阴离子聚合 但聚合活性远不如异丁烯、乙烯烷基醚,工业 很少进行这类单体的阳离子聚合 引发剂生成阳离子,引发单体生成碳阳离子 电荷转移引发,即引发剂和单体先形成电荷转移络 合物而后引发 2. 阳离子聚合引发体系及引发作用 阳离子聚合的引发剂都是亲电试剂,即电子接受体 阳离子聚合的引发方式:
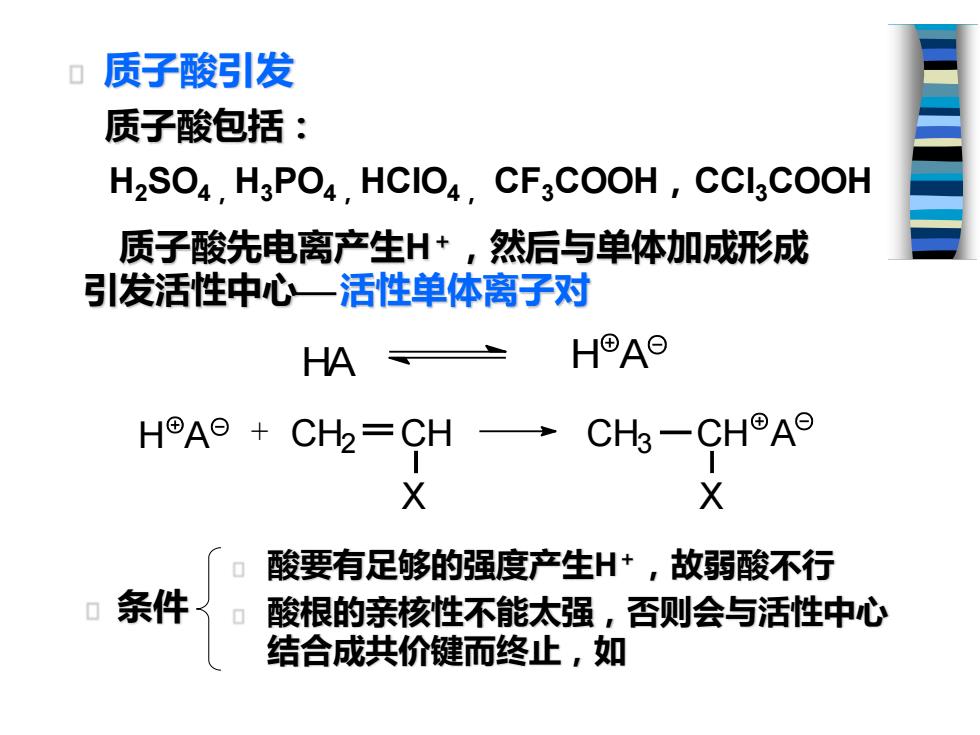
质子酸引发 质子酸包括: H2SO4.H3PO4.HCIO4.CF3COOH,CCIsCOOH 质子酸先电离产生H+,然后与单体加成形成 引发活性中心一活性单体离子对 HA H®AO HA⊙+ CH=CH一CH-CH9A9 X X 0 酸要有足够的强度产生H+,故弱酸不行 条件 酸根的亲核性不能太强,否则会与活性中心 结合成共价键而终止,如
质子酸引发 质子酸包括: H2SO4, H3PO4, HClO4, CF3COOH,CCl3COOH 酸要有足够的强度产生H+ ,故弱酸不行 酸根的亲核性不能太强,否则会与活性中心 结合成共价键而终止,如 质子酸先电离产生H+ ,然后与单体加成形成 引发活性中心⎯ 活性单体离子对 HA H A H A CH2 CH X CH3 CH X + A 条件
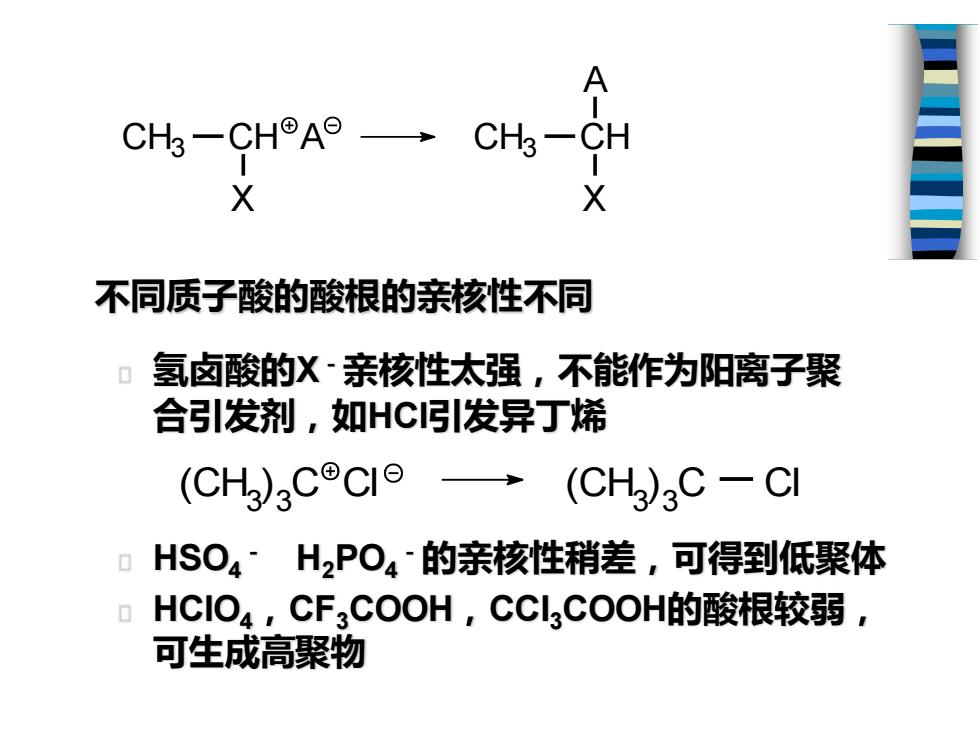
CHs-CH9A9-CHg-CH X X 不同质子酸的酸根的亲核性不同 氢卤酸的X~亲核性太强,不能作为阳离子聚 合引发剂,如HC引发异丁烯 (CH3CCI 9→(CH)3C -C HSO4~H2PO4的亲核性稍差,可得到低聚体 HCIO4,CF3COOH,CCL3COOH的酸根较弱, 可生成高聚物
HSO4 - H2PO4 -的亲核性稍差,可得到低聚体 HClO4,CF3COOH,CCl3COOH的酸根较弱, 可生成高聚物 氢卤酸的X-亲核性太强,不能作为阳离子聚 合引发剂,如HCl引发异丁烯 CH3 CH X A CH3 CH X A 不同质子酸的酸根的亲核性不同 (CH3 ) 3 (CH C Cl 3 ) 3 C Cl