
第六章离子聚合 1.2.0moL苯乙烯的二氯乙烷溶液,于25℃时在4.0×104molL硫酸存在下聚合,计算开 始时的聚合度。假如单体溶液中含有浓度为8.0×105mo/L的异丙苯,那么聚苯乙烯的聚 合度是多少?为便于计算,可利用下列数据。 参数: 数值 kp [L/(mol-S)] 7.6 k1(s)自发终止 4.9x10-2 k,(s)与反离子结合终止 6.7×10-3 ktr.M(L/mol-s) 1.2x10l Cs(25℃,在二氯乙烷中用异丙苯作转移剂) 4.5×10-2 解:阳离子聚合速率方程为 Rp=kpMM=76x20x4.0x10-46.08×103 mol /(L-S) 该体系终止反应为自发终止、与反离子结合终止、向单体转移终止之和 .Rt=kt1[M]+kt2[M]+ktr.M [M"][M] k[M] R.k+k +krm[M] 7.6×2.0 49x102+67×10+12x10-x2051.4 存在链转移剂异丙苯时 动+c岛 1 =5+45x10-x800-0195 1 2.0 X。=514
1 第六章 离子聚合 1.2.0 mol/L苯乙烯的二氯乙烷溶液,于25℃时在4.0×10-4 mol/L硫酸存在下聚合,计算开 始时的聚合度。假如单体溶液中含有浓度为8.0×10-5 mol/L的异丙苯,那么聚苯乙烯的聚 合度是多少?为便于计算,可利用下列数据。 参数: 数值 kp [L/(mol·S)] 7.6 kt1(s-1 )自发终止 4.9×10-2 kt2 (s-1 )与反离子结合终止 6.7×10-3 ktr,M(L/mol·s) 1.2×10-1 Cs(25℃,在二氯乙烷中用异丙苯作转移剂) 4.5×10-2 解:阳离子聚合速率方程为 Rp= kp[M][M+]=7.6×2.0×4.0×10-4=6.08×10-3 mol /( L·S) 该体系终止反应为自发终止、与反离子结合终止、向单体转移终止之和 ∴ Rt= kt1[M+]+kt2[M+]+ ktr,M [M+][M] [ ] [ ] ( ) 1 2 0 k k k M k M R R X t t trm p t p n 51.4 4.9 10 6.7 10 1.2 10 2.0 7.6 2.0 2 3 1 存在链转移剂异丙苯时 [ ] [ ] ( ) 1 1 0 M S C X X S n n 0.0195 2.0 8.0 10 4.5 10 51.4 1 5 2 ∴ Xn 51.4

2.将1.0×103mol萘钠溶于四氢呋喃中,然后迅速加入2.0mol的苯乙烯,溶液的总体积为1L。 假如单体立即均匀混合,发现2000秒钟内已有一半单体聚合,计算在聚合了2000秒和4000 秒时的聚合度。 解:无终止的阴离子聚合速率为Rp-kp[M们M 以萘钠为引发剂时,由于聚合开始前,引发剂就以定量地离解成活性中心 .[M ]=[C]=1.0x103mol/L 将Rp式改写为-dM/dt=kp[C][M 积分得n(Mo/M])-kp[C]t 已知t1=2000秒时,M0/M1=2,代入上面积分式: ln2=kp×2000 .kp[C]=In2/2000 设当t2=4000秒时,剩余单体浓度为M2 ln(M0/M]2)=kp[C]t2=ln2/2000×4000=1.386 M2=M0/4 则反应掉的单体浓度为M0-M0/4-3M0/4 根据阴离子聚合的聚合度公式xn=mMIC](双阴离子n=2)[C为引发剂浓度 ·:聚合到2000秒时,单体转化率为50%,则反应掉的单体浓度为50%M0 .xm=nx50%M00/IC]=2×50%×2.0/(1.0×10-3)=2000 己求得聚合到4000秒时,反应掉的单体浓度为3M0/4 ∴.xn=nx(3M00/4)/[C=2×(3/4)×2.0/1.0x103=3000 3.用TC4作催化剂和水作共催化剂,使异丁烯在一定反应条件下于苯中进行阳离子聚 合时,实验的聚合速率方程式为Rpk[TiC14]M[H2O 如果链终止是通过活性增长中心重排进行的,并产生不饱和端基聚合物和催化剂共催 化剂络合物。 (1)试写出这个聚合反应的机理、推导聚合速率和聚合度方程。 2
2 2.将1.0×10-3mol萘钠溶于四氢呋喃中,然后迅速加入2.0mol的苯乙烯,溶液的总体积为1L。 假如单体立即均匀混合,发现2000秒钟内已有一半单体聚合,计算在聚合了2000秒和4000 秒时的聚合度。 解:无终止的阴离子聚合速率为Rp=kp[M- ][M] 以萘钠为引发剂时,由于聚合开始前,引发剂就以定量地离解成活性中心 ∴[M- ]=[C]=1.0×10-3mol/L 将Rp式改写为-d[M]/dt=kp[C][M] 积分得ln([M]0/[M])=kp[C]t 已知t1=2000秒时,[M]0/[M]1=2,代入上面积分式: ln2=kp×2000 ∴kp[C]=ln2/2000 设当t2=4000秒时,剩余单体浓度为[M]2 ln([M]0/[M]2)=kp[C]t2=ln2/2000×4000=1.386 ∴[M]2= [M]0/4 则反应掉的单体浓度为[M]0-[M]0/4=3[M]0/4 根据阴离子聚合的聚合度公式 x n=n[M]/[C] (双阴离子n=2) [C]为引发剂浓度 ∵聚合到2000秒时,单体转化率为50%,则反应掉的单体浓度为50%[M]0 ∴ xn n×50%[M]0/[C]=2×50%×2.0/(1.0×10-3 )=2000 已求得聚合到4000秒时,反应掉的单体浓度为3[M]0/4 ∴ xn n×(3[M]0/4)/[C]=2×(3/4)×2.0/(1.0×10-3 )=3000 3.用TiCl4作催化剂和水作共催化剂,使异丁烯在一定反应条件下于苯中进行阳离子聚 合时,实验的聚合速率方程式为Rp=k[TiCl4][M][H2O]0 如果链终止是通过活性增长中心重排进行的,并产生不饱和端基聚合物和催化剂-共催 化剂络合物。 (1)试写出这个聚合反应的机理、推导聚合速率和聚合度方程

(2)又在什么条件下聚合速率可为对H2O]为一级反应,对TiC4为零级反应以及对[M 为二级反应,即Rp=kH2O]MTiC4]‘。 解:(1)根据题意,有下述机理: 引发: TC4tH,0 H(TiCI40H° K为引发剂和共引发剂的络和平衡常数为 「HTiC,oH° K络= [TiCl]H2o] CHa HTiC,OH°+CH2 kc4mco° CH 链增长 CH-TCOHPCH 2 CHa CH2-C CH3 H.kgmwC-C8TCoH CHa 链终止,属自发终止: CHa-(TiCLOHCH2-G-CH2+H(TiClOH CH3 当引发剂和共引发剂的络合反应是慢反应时: 引发速率:Ri=K络TiCl4]H2O] 聚合速率:R,=k,[HMTiCI,OH9°]M 自发终止时有:R=k[HMTiCI,OH°】
3 (2)又在什么条件下聚合速率可为对[H2O]为一级反应,对[TiCl4]为零级反应以及对[M] 为二级反应,即Rp=k[H2O][M]2 [TiCl4] 0。 解:(1)根据题意,有下述机理: 引发: TiCl4+H2O H (TiCl4OH) k络 K络为引发剂和共引发剂的络和平衡常数为 H (TiCl4OH) TiCl4 H2O K络= H (TiCl4OH) + CH2 C CH3 CH3 ki CH3 C (TiCl4OH) CH3 CH3 链增长 CH3 C (TiCl4OH) CH3 CH3 + CH2 C CH3 CH3 kp CH3 C CH2 C CH3 CH3 CH3 CH3 (TiCl4OH) . CH2 C CH3 CH3 kp CH3 CH3 (TiCl CH 4OH) . 2 C 链终止,属自发终止: CH3 CH3 (TiCl CH 4OH) 2 C kt CH2 C CH3 CH2 + H (TiCl4OH) 当引发剂和共引发剂的络合反应是慢反应时: 引发速率:Ri=K络[TiCl4][H2O] 聚合速率: Rp =kp [HM (TiCl4OH) ] [M] 自发终止时有: Rt=kt [HM (TiCl4OH) ]

假定稳态:则Ri=Rt K[TiCl4][H2O]=k:[HMTiCIOH)] .[HM(TiCLOH)]=(K/k)ITiCl][HzO] 代入Rp式得:Rp=(k,Kw/k)TiCl]MHO] 当H20]过量,则[H20]视为一常数,一并合并到速度常数项中,则 Rp=Ka[TiCI4][M][H2OJ0 可见,在水过量以及在引发剂和共引发剂的络合反应是慢反应时,聚合速率对引发剂为一 级反应,对单体为一级反应,对水为零级反应。 而 Rek [HM (TiCLOH]M]keM) Xn-Rt k:[HM(TiClOH)] k 推毕 (2)当引发剂引发单体生成碳阳离子的反应为慢反应时,则 Ri=k;[H(TiClOH)][M]=Kk;[TiCl4][H2O][M] 稳态时,R=Rt [HMTICLOH [TCL](H2O1 [M] k 代入Rp式得 ca POIP x是-hwTC,owi四.w k [HM(TiCIOH)] 当TiC14浓度过量时,TiC14]可视为一常数,一并合并到速率常数中,则 Rp=KeH2O]M)2[TiCL4°
4 假定稳态:则Ri=Rt K络[TiCl4 ] [H2O]=kt [HM (TiCl4OH) ] ∴ [HM (TiCl4OH) ] = (K络/kt )[TiCl4 ] [H2O] 代入Rp式得:Rp= (kp K络/ kt) [TiCl4][M] [H2O] 当[H2O]过量,则[H2O]视为一常数,一并合并到速度常数项中,则 Rp=K总[TiCl4][M][H2O]0 可见,在水过量以及在引发剂和共引发剂的络合反应是慢反应时,聚合速率对引发剂为一 级反应,对单体为一级反应,对水为零级反应。 而 Xn = Rt Rp = [HM (TiCl k 4OH) ] p [M] kt [HM (TiCl4OH) ] kp kt = [M] 推毕 (2)当引发剂引发单体生成碳阳离子的反应为慢反应时,则 Ri=ki [H (TiCl4OH) ] [M] = K络ki [TiCl4 ] [H2O] [M] 稳态时,Ri=Rt ∴ [HM (TiCl4OH) ] = kt [M] K络ki [TiCl4 ] [H2O] 代入Rp式得 kt [M] 2 K络kpki [TiCl4 R ] [H2O] p= 而 Xn = Rt Rp = [HM (TiCl k 4OH) ] p [M] kt [HM (TiCl4OH) ] kp kt = [M] 当TiCl4浓度过量时,[TiCl4]可视为一常数,一并合并到速率常数中,则 Rp=K总[H2O] [M]2 [TiCl4] 0

可见,在TC4浓度过量以及在引发反应中引发剂引发单体生成碳阳离子的反应为慢反应 时,聚合速率对H2O]为一级反应,对单体为二级反应,对TiC4为零级反应。 4.异丁烯在四氢呋喃中用SnC1,-H,0引发聚合,发现聚合速率Rp∝[SnCl,lH,O][异丁烯?。 起始生成的聚合物的数均分子量为20000.1.00g聚合物含3.0×10mol的OH基,不含氯。 写出该聚合的引发、增长、终止反应方程式。推导聚合速率和聚合度的表达式。指出推导 过程中用了何种假定。什么情况下聚合速率是水或SC14的零级、单体的一级反应? 解:根据题意,终止是活性中心与反离子碎片结合。 ①引发:SnCl4+H0 k络P(SnCL,OHP CH3 (SnCL,oHP+CH=C占→H-9 ( CH3 增长: CH3 CH3-C(SnClaOH)+CH2=C c@(SnClOH CH3 CH3 CH3 CH3 CH3CH3 CH3 .+M.>CH3-c-CH2-c]CH2-c(SnCLOH) CH3 CH3 CH3 终止: CH3CH3 CH3 CH3 CHs CH3 CH-FECHoaCLOmCB-EcH C-OH+SnCla CH3 CH3 CH3 ②各步反应速率方程为 Ri=ki[H(SnCl40H)][CH2=C(CH3)2]=kki[SnCl4][H2O][CH2=C(CH3)2] (k=[H(SnCI40H)VISnCl4][H20]) Rp=kp[HM(SnCl4OH)][CH2=C(CH3)2]
5 可见,在TiCl4浓度过量以及在引发反应中引发剂引发单体生成碳阳离子的反应为慢反应 时,聚合速率对[H2O]为一级反应,对单体为二级反应,对TiCl4为零级反应。 4.异丁烯在四氢呋喃中用SnCl4-H2O引发聚合。发现聚合速率Rp∝[SnCl4 ][H2O][异丁烯] 2。 起始生成的聚合物的数均分子量为 20000。1.00g 聚合物含 3.0×10-5mol 的 OH 基,不含氯。 写出该聚合的引发、增长、终止反应方程式。推导聚合速率和聚合度的表达式。指出推导 过程中用了何种假定。什么情况下聚合速率是水或 SnCl4 的零级、单体的一级反应? 解:根据题意,终止是活性中心与反离子碎片结合。 ① 引发: SnCl4+H2O k络 H (SnCl4OH) H (SnCl4OH) +CH2 C CH3 CH3 ki CH3 C CH3 CH3 (SnCl4OH) 增长: CH3 C CH3 CH3 (SnCl4OH) +CH2 C CH3 CH3 kp CH2 C CH3 CH3 C CH3 CH3 CH3 (SnCl4OH) +M CH2 C CH3 CH3 C CH3 CH2 CH3 C CH3 CH3 CH3 (SnCl4OH) n 终止: CH2 C CH3 CH3 C CH3 CH2 CH3 C CH3 CH3 CH3 (SnCl4OH) n kt CH2 C CH3 CH3 C CH3 CH2 CH3 C CH3 CH3 CH3 OH+SnCl4 n ② 各步反应速率方程为 Ri=ki[H+(SnCl4OH)-][CH2=C(CH3)2]=k络ki[SnCl4][H2O][CH2=C(CH3)2] (k络=[H+(SnCl4OH)-]/[SnCl4][H2O]) Rp=kp[HM+(SnCl4OH)-][CH2=C(CH3)2]

Rt=kt[HM(SnCI4OH)] 假定R=Rt(稳态)则 [HM(SnCI4OH)]=kki[SnCI4][H2O][CH2=C(CH3)2V/kt 代入R,式得 Rp=kkikp[SnCI4][H2O][CH2=C(CH3)2]2/kt X=Rp/Rt=kp[HM(SnC140H)][CH2=C(CH3)2]/(kt [HM(SnCI4OH)D)=kp [CH2=C(CH3)2]/kt ③若H2OP>[SnCl4],且k>k络, 则在引发反应中,第一步(生成络合物的反应)为控制步骤,且2O]基本保持恒定。 .Ri=k[H2O][SnC14]=k1[SnC14] 稳态时:kuHM+(SnCl4OH-]=k1[SnCl4] .[HM(SnCI40H)1=k1/kt[SnCl4] 代入Rp式得 Rp=kpk1/kt[SnCl4][CH2=C(CH3)2] 即Rp是水的零级,单体的一级反应。 ④若[SnCl4]>H2O],且k>k络 则在引发反应中,生成络合物的反应为控制步骤,且[SnC14]基本恒定。 ∴.R=k络H20][SnCl4]=k2H20] 稳定时:ktHM十(SnCl4OH一]=k2H2O] .[HM(SnCI4OH)]=k2/kt[H2O] 代入Rp式得: Rp=kpk2/kt[H2O][CH2=C(CH3)2] 即Rp是SnCl4的零级、单体的一级反应。 5.在搅拌下依次向装有四氢呋喃的反应釜中加入0.2moln-BuLi和20kg苯乙烯。当单体聚合 6
6 Rt=kt[HM+(SnCl4OH)-] 假定 Ri=Rt (稳态) 则 [HM+(SnCl4OH)-]=k络ki[SnCl4][H2O][CH2=C(CH3)2]/kt 代入Rp式得 Rp= k络kikp[SnCl4] [H2O][CH2=C(CH3)2] 2 /kt xn =Rp/Rt= kp[HM+( SnCl4OH)-][CH2=C(CH3)2]/(kt [HM+( SnCl4OH)-])=kp [CH2=C(CH3)2] /kt ③ 若[H2O]>>[SnCl4],且ki>>k络, 则在引发反应中,第一步(生成络合物的反应)为控制步骤,且[H2O]基本保持恒定。 ∴Ri=k络[H2O][SnCl4] = k1[SnCl4] 稳态时:kt[HM+( SnCl4OH)-]= k1[SnCl4] ∴[HM+( SnCl4OH)-]=k1/kt[SnCl4] 代入Rp式得 Rp=kpk1/kt[SnCl4][CH2=C(CH3)2] 即Rp是水的零级,单体的一级反应。 ④若[SnCl4]>>[H2O],且ki>>k络 则在引发反应中,生成络合物的反应为控制步骤,且[SnCl4]基本恒定。 ∴Ri= k络[H2O][SnCl4]=k2[H2O] 稳定时:kt[HM+( SnCl4OH)-]=k2[H2O] ∴[HM+( SnCl4OH)-]=k2/kt[H2O] 代入Rp式得: Rp=kpk2/kt[H2O] [CH2=C(CH3)2] 即Rp是SnCl4的零级、单体的一级反应。 5.在搅拌下依次向装有四氢呋喃的反应釜中加入0.2mol n-BuLi和20kg苯乙烯。当单体聚合

了一半时,向体系中加入18gHO,然后继续反应。假如用水终止的和继续增长的聚苯乙 烯的分子量分布指数均是1,试计算 (1)水终止的聚合物的数均分子量: (2)单体完全聚合后体系中全部聚合物的数均分子量: (3)最后所得聚合物的分子量分布指数。 解一:(1)单体反应一半时加入1.8gH20,由水终止所得聚合物的分子量M为 n,=参加反应的单体的克数:n=2000/2=5000 活性中心摩尔数 02 (2)单体完全转化后全部聚合物的数均分子量,仍然是个平均的概念,即指的是平均来 讲每一个活性种所加上的单体的克数(若是数均聚合度,即为所加上的单体的个数), 不管中途是否加有终止剂,还是发生了其他不均匀增长 ',单体完全转化后全部聚合物的数均分子量M为 Mn-所有单体的克数:n=200=1000 活性中心摩尔数 0.2 解二:整个体系由两种分子组成: 由水终止的大分子,其摩尔数为1.8/18=0.1mol,分子量Mn,为50000 1没被水终止而继续增长所形成的大分子,其摩尔数为0.2-0.1=0.1mol, 分子量设为Mn, 通=+0w+-w四 剩余单体的克数·n」 这样,单体完全聚合后体系中全部聚合物的数均分子量为: h-MM_01×500+01x1500-100 0.1+0.1 (3)己知在这一体系中存在两类分子,一是由水终止的大分子,另一是没被水终止而得 以继续增长所形成的大分子,且已知这两类分子的分子量分布指数均为1,说明它们各自 均为均一体系,分子量都是单一值,分别求出这两种分子的摩尔数和数均分子量,即可 求得HⅢ 7
7 了一半时,向体系中加入1.8g H2O,然后继续反应。假如用水终止的和继续增长的聚苯乙 烯的分子量分布指数均是1,试计算 (1)水终止的聚合物的数均分子量; (2)单体完全聚合后体系中全部聚合物的数均分子量; (3)最后所得聚合物的分子量分布指数。 解一:(1)单体反应一半时加入1.8g H2O,由水终止所得聚合物的分子量 Mn1 为 50000 0.2 ·n 20000 / 2 Mn1 = = 活性中心摩尔数 参加反应的单体的克数 (2)单体完全转化后全部聚合物的数均分子量,仍然是个平均的概念,即指的是平均来 讲每一个活性种所加上的单体的克数(若是数均聚合度,即为所加上的单体的个数), 不管中途是否加有终止剂,还是发生了其他不均匀增长 ∴单体完全转化后全部聚合物的数均分子量 Mn 为 100000 0.2 ·n 20000 Mn = = 活性中心摩尔数 所有单体的克数 解二:整个体系由两种分子组成: 由水终止的大分子,其摩尔数为1.8/18=0.1mol,分子量 Mn1 为50000 没被水终止而继续增长所形成的大分子,其摩尔数为0.2-0.1=0.1mol, 分子量设为 2 Mn 150000 0.2 0.1 20000 / 2 50000 ·n Mn2 Mn1 = + = 剩余活性中心摩尔数 剩余单体的克数 = + 这样,单体完全聚合后体系中全部聚合物的数均分子量为: 100000 0.1 0.1 0.1 50000 0.1 150000 n Ni NiMi M (3)已知在这一体系中存在两类分子,一是由水终止的大分子,另一是没被水终止而得 以继续增长所形成的大分子,且已知这两类分子的分子量分布指数均为1,说明它们各自 均为均一体系,分子量都是单一值,分别求出这两种分子的摩尔数和数均分子量,即可 求得HI

由水终止的大分子,其摩尔数为0.1mol,分子量n,为50000,单分布 没被水终止而继续增长所形成的大分子,其摩尔数为0.1mol,分子量为150000,单分布 ∴最后所得聚合物的分子量分布指数为 ∑NiMf 0.1Mn2+0.1Mn,2 0.1Mn,+0.1Mn2 Mn ∑MiM= 0.1,+0.1Mm,=1.25 ∑WM 0.1+0.1 6.用萘钠为引发剂,制备分子量为354000的聚α-甲基苯乙烯1.77kg,问需要多少克钠? 解:根据萘钠引发剂的反应 儿+OOnE,[@of心私佛R限G+OO O 2N8nct→8HcH,cH8H ◎◎ =”严,w为单体重量,C为引发剂摩尔数 C 代入数据:354000-2x1.7刀x10 解得C=0.01mol .需要钠为0.01×23=23g 7.在-35℃以TC14为引发剂、水为共引发剂,异丁烯进行低温聚合,单体浓度对平均聚合 度的影响,有下列数据 M0(mol/L)0.6670.3330.2780.1450.059 DP 69404130286023501030 根据以上数据计算速率常数比:kkp和kkp。 解:由以上数据可得
8 由水终止的大分子,其摩尔数为0.1mol,分子量 Mn1 为50000,单分布 没被水终止而继续增长所形成的大分子,其摩尔数为0.1mol,分子量为150000,单分布 ∴最后所得聚合物的分子量分布指数为 1.25 0.1 0.1 0.1Mn 0.1Mn 0.1Mn 0.1Mn 0.1Mn 0.1Mn 1 2 1 2 2 2 2 1 2 Ni NiMi NiMi NiMi Mn Mw 6.用萘钠为引发剂,制备分子量为 354000 的聚 α-甲基苯乙烯 1.77kg,问需要多少克钠? 解:根据萘钠引发剂的反应 C nW Mn , W为单体重量, C为引发剂摩尔数 代入数据: C 2 1.77 1000 354000 解得C=0.01 mol ∴ 需要钠为0.01×23=23 g 7.在-35℃以 TiCl4 为引发剂、水为共引发剂,异丁烯进行低温聚合,单体浓度对平均聚合 度的影响,有下列数据 [M] (mol/L) 0.667 0.333 0.278 0.145 0.059 DP 6940 4130 2860 2350 1030 根据以上数据计算速率常数比:ktr/kp 和 kt/kp。 解:由以上数据可得 Na+ THF Na 苯乙烯 NaCHCH2 + 2Na CHCH2 Na CHCH2CH2CHNa

1/M1.4993.0033.5976.89716.949 1/DP 1.441 2.421 3.497 4.255 9.709 1 根据无链转移剂时聚合度公式乏kM十C。 可知,以 。对二作图,所得直线斜率即为kkp:截距即为Cm,亦即kkp [M] 8.现有DPPH和苯醌两种试剂,用其如何区别自由基聚合反应、阳离子聚合和阴离子聚合 这三种反应? 解:已经知道:三种聚合反应的阻聚剂如下: 自由基聚合:氧、DPPH、苯醌 阳离子聚合:极性物质水、醇,碱性物质,苯醌 阴离子聚合:极性物质水、醇,酸性物质,二氧化碳 阻聚剂DPPH和苯醌对这三种反应所表现的阻聚作用不同: DPPH(1,1二苯基-2三硝基苯肼)是高效自由基捕获剂,它能非常有效的捕获初级自由 基,常称为自由基捕获剂。DPPH通过链转移反应消灭自由基,一个DPPH分子能够按化学 计量消灭一个自由基,因此可以用来测定引发速率。亦即DPPH是自由基的阻聚剂,但它对 离子聚合无阻聚作用,故借助DPPH对自由基聚合产生阻聚作用、而对离子聚合不产生阻聚 作用的原理,可将自由基聚合和离子聚合区分开来。而苯醌是阳离子聚合的阻聚剂,可据 此区分阳离子聚合和阴离子聚合。 火 9.试从单体、引发剂、聚合方法及反应的特点等方面对自由基、阴离子和阳离子聚合反应 进行比较?
9 1/[M] 1.499 3.003 3.597 6.897 16.949 1/DP 1.441 2.421 3.497 4.255 9.709 根据无链转移剂时聚合度公式 m n C x k [M] 1 k p t 可知,以 [M] 1 对 xn 1 作图,所得直线斜率即为 kt/kp;截距即为 Cm,亦即 ktr/kp。 8.现有DPPH和苯醌两种试剂,用其如何区别自由基聚合反应、阳离子聚合和阴离子聚合 这三种反应? 解:已经知道:三种聚合反应的阻聚剂如下: 自由基聚合:氧、DPPH、苯醌 阳离子聚合:极性物质水、醇,碱性物质,苯醌 阴离子聚合:极性物质水、醇,酸性物质,二氧化碳 阻聚剂DPPH和苯醌对这三种反应所表现的阻聚作用不同: DPPH(1,1-二苯基-2-三硝基苯肼)是高效自由基捕获剂,它能非常有效的捕获初级自由 基,常称为自由基捕获剂。DPPH通过链转移反应消灭自由基,一个DPPH分子能够按化学 计量消灭一个自由基,因此可以用来测定引发速率。亦即DPPH是自由基的阻聚剂,但它对 离子聚合无阻聚作用,故借助DPPH对自由基聚合产生阻聚作用、而对离子聚合不产生阻聚 作用的原理,可将自由基聚合和离子聚合区分开来。而苯醌是阳离子聚合的阻聚剂,可据 此区分阳离子聚合和阴离子聚合。 N N NO2 NO2 NO2 CH2CH NO2 X H NO2 N N NO2 CH CH X ~ + ~ + 9.试从单体、引发剂、聚合方法及反应的特点等方面对自由基、阴离子和阳离子聚合反应 进行比较?
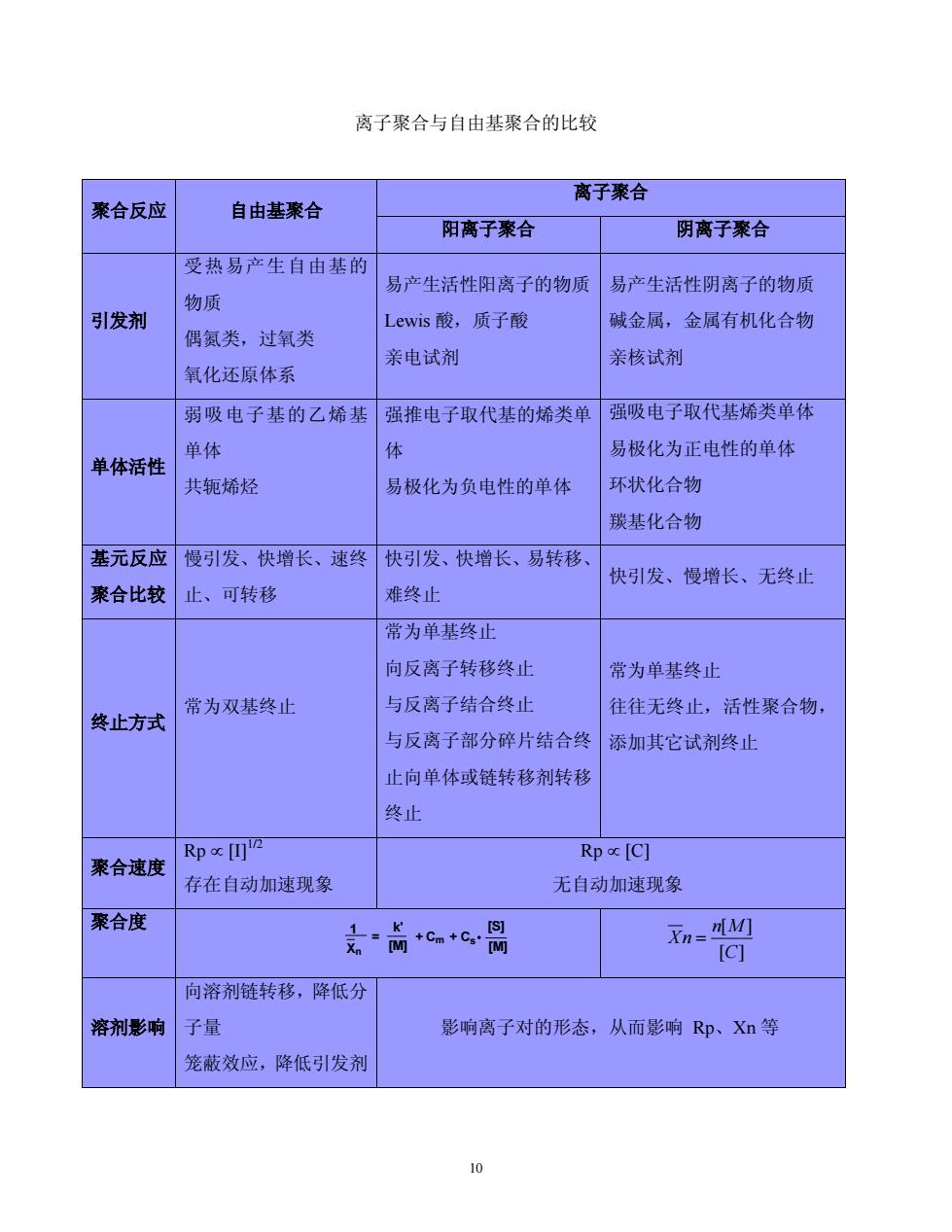
离子聚合与自由基聚合的比较 离子聚合 聚合反应 自由基聚合 阳离子聚合 阴离子聚合 受热易产生自由基的 易产生活性阳离子的物质易产生活性阴离子的物质 物质 引发剂 Lewis酸,质子酸 碱金属,金属有机化合物 偶氨类,过氧类 亲电试剂 亲核试剂 氧化还原体系 弱吸电子基的乙烯基强推电子取代基的烯类单 强吸电子取代基烯类单体 单体 易极化为正电性的单体 单体活性 共轭烯烃 易极化为负电性的单体 环状化合物 羰基化合物 基元反应慢引发、快增长、速终快引发、快增长、易转移 快引发、慢增长、无终止 聚合比较止、可转移 难终止 常为单基终止 向反离子转移终止 常为单基终止 常为双基终止 与反离子结合终止 往往无终止,活性聚合物, 终止方式 与反离子部分碎片结合终 添加其它试剂终止 止向单体或链转移剂转移 终止 Rpc四2 Rp [C] 聚合速度 存在自动加速现象 无自动加速现象 聚合度 是前c+c周 n=☑ [C] 向溶剂链转移,降低分 溶剂影响子量 影响离子对的形态,从而影响Rp、Xn等 笼蔽效应,降低引发剂 10
10 离子聚合与自由基聚合的比较 聚合反应 自由基聚合 离子聚合 阳离子聚合 阴离子聚合 引发剂 受热易产生自由基的 物质 偶氮类,过氧类 氧化还原体系 易产生活性阳离子的物质 Lewis 酸,质子酸 亲电试剂 易产生活性阴离子的物质 碱金属,金属有机化合物 亲核试剂 单体活性 弱吸电子基的乙烯基 单体 共轭烯烃 强推电子取代基的烯类单 体 易极化为负电性的单体 强吸电子取代基烯类单体 易极化为正电性的单体 环状化合物 羰基化合物 基元反应 聚合比较 慢引发、快增长、速终 止、可转移 快引发、快增长、易转移、 难终止 快引发、慢增长、无终止 终止方式 常为双基终止 常为单基终止 向反离子转移终止 与反离子结合终止 与反离子部分碎片结合终 止向单体或链转移剂转移 终止 常为单基终止 往往无终止,活性聚合物, 添加其它试剂终止 聚合速度 Rp [I]1/2 存在自动加速现象 Rp [C] 无自动加速现象 聚合度 Cs [M] [S] Xn 1 = k' + Cm + [M] 溶剂影响 向溶剂链转移,降低分 子量 笼蔽效应,降低引发剂 影响离子对的形态,从而影响 Rp、Xn 等 [ ] [ ] C n M Xn