
高分子化学电子教案 第三章自由基聚合反应(radical polymerization) 【课时安排】 31单体的聚合能力 1学时 32自由基聚合机理 2学时 33 链引发反应 2学时 3.4 聚合反应动力学 15学时 3.5相对分子质量 1学时 3.6链转移反应 2学时 37聚合方法 35学时 12学时 【掌握内容】 1单体聚合能力:热力学(△E△S,T,P):动力学(空间效应聚合能力,电子效应聚合类型) 3.自由基基元反应每步反应特征自由基聚合反应特征 3常用引发剂的种类和符号引发剂分解反应式表征方法四个参数)引发剂效嘉透导效应 笼蔽效应,引发剂选择原则 4.聚合动力学:聚合初期:三个假设,四个条件,反应级数的变化,影响速率的四因素M山TP): 聚合中后期的反应速率的研究:自动加速现象,凝胶效应,沉淀效应:聚合反应类型 5相对分子质最:动力学链长,聚合度及影响其的四因素(ML,T,P), 6链转移:类型,聚合度动力学分析阻聚与缓聚 7.本体溶液悬浮,乳液四大聚合方法配方,基本组成,优缺点及主要品种 【熟悉内容】 1热、光、辐射聚合。 3.聚合动力学研究方法。 3自由基聚合的相对分子质量分布。 4悬浮聚合与乳液聚合所用分散剂种类、聚合过程, 【了解内容】 1.通用单体来源。 3.自由基聚合进展 【教学难点】 1对具体单体聚合热力学与动力学的综合分机 3.终止方式的相对比例及其与体系状态的关系 3.氧化还原类的反应式:笼蔽效应与诱导效应 4.不同条件下反应速率对单体与引发剂浓度的反应级数的推导与分析 5.区别聚合反应速率、动力学链长、平均聚合度的影响因素和变化趋势 6.向不同转移对象的链转移程度的难易分析 7到湾聚合机理及动力学 【教学日标】 1.掌握自由基聚合相关基本概念。 3.掌握自由基聚合常见单体、引发剂、阻聚剂、聚合方法。 3.达到如下技能:
1 高分子化学电子教案 第三章 自由基聚合反应(radical polymerization) 【课时安排】 3.1 单体的聚合能力 1 学时 3.2 自由基聚合机理 2 学时 3.3 链引发反应 2 学时 3.4 聚合反应动力学 1.5 学时 3.5 相对分子质量 1 学时 3.6 链转移反应 2 学时 3.7 聚合方法 3.5 学时 总计 12 学时 【掌握内容】 1.单体聚合能力:热力学(△ E, △ S,T,P);动力学(空间效应-聚合能力,电子效应-聚合类型) 3.自由基基元反应每步反应特征,自由基聚合反应特征 3.常用引发剂的种类和符号,引发剂分解反应式,表征方法(四个参数),引发剂效率,诱导效应, 笼蔽效应,引发剂选择原则 4.聚合动力学:聚合初期:三个假设,四个条件,反应级数的变化,影响速率的四因素(M,I,T,P); 聚合中后期的反应速率的研究:自动加速现象,凝胶效应,沉淀效应;聚合反应类型 5.相对分子质量:动力学链长,聚合度及影响其的四因素(M,I,T,P), 6.链转移:类型,聚合度,动力学分析,阻聚与缓聚 7.本体,溶液,悬浮,乳液四大聚合方法配方,基本组成,优缺点及主要品种 【熟悉内容】 1.热、光、辐射聚合。 3.聚合动力学研究方法。 3 自由基聚合的相对分子质量分布。 4 悬浮聚合与乳液聚合所用分散剂种类、聚合过程。 【了解内容】 1. 通用单体来源。 3. 自由基聚合进展。 【教学难点】 1. 对具体单体聚合热力学与动力学的综合分析 3. 终止方式的相对比例及其与体系状态的关系 3. 氧化还原类的反应式;笼蔽效应与诱导效应 4. 不同条件下反应速率对单体与引发剂浓度的反应级数的推导与分析 5. 区别聚合反应速率、动力学链长、平均聚合度的影响因素和变化趋势 6. 向不同转移对象的链转移程度的难易分析 7. 乳液聚合机理及动力学 【教学目标】 1. 掌握自由基聚合相关基本概念。 3. 掌握自由基聚合常见单体、引发剂、阻聚剂、聚合方法。 3. 达到如下技能:

(1)单体聚合能力的判断与卷利的洗择 (2)引发剂的洗择及正确书写引发反应式 (3)正确书写任一体系的基元反应式 (4)根据动力学方程计算各参数选择适当方法控制反应进程 (⑤)根据相对分子质量方程计算各参数,选择适当方法控制产物结构 (6)设计聚合工艺,线路与配方 3.】单体的聚合能力 【教学内容】 3.1.1聚合热力学 一聚合热 二聚合熵 三聚合温度 四小结 3.12 聚合动力学 一连锁聚合种类与活性中心 一单体对聚合类型的洗择及聚合能力 】取代基对聚合能力的影响(空间效应) 2取代基对聚合类型的选择电子效应 3单体共聚能力 【授课时间】1学时 【教学重点】 1影响聚合热的主要因素及其规律 2单体对聚合类型的洗择及聚合能于 【教学难点】 1影响聚合热的主要因素及其规律 2对只体单体聚合热力学与动力学的综合分析 【教学目标】 1掌握影响聚合热的主要因素及其规律 2掌握取代基对单体聚合类型选择及聚合能力的影响规律 能正确综合分析其体单体的聚合热力学与动力学行为 【教学手段】课堂讲授,辅以实例练习 【教学过程】 聚合能力: 一化学结构:两个可相互反应官能团 常见聚合单体类型 一两个以上有机官能团单材 上骑力季 -R-C-O -杂环(ONPS) 311聚合热力学 △G=AH-T△S=AE+PAV-TAS0解系 聚合热AH=AE+PAV 1内能变化 AE=AE+AER+△E+△E'-(Ep-EamH(ERp-ERmH(Ep-EH△E 2
2 (1)单体聚合能力的判断与类型的选择 (2)引发剂的选择及正确书写引发反应式 (3)正确书写任一体系的基元反应式 (4)根据动力学方程计算各参数,选择适当方法控制反应进程 (5) 根据相对分子质量方程计算各参数,选择适当方法控制产物结构 (6)设计聚合工艺,线路与配方 3.1 单体的聚合能力 【教学内容】 3.1.1 聚合热力学 一 聚合热 二 聚合熵 三 聚合温度 四 小结 3.1.2 聚合动力学 一 连锁聚合种类与活性中心 二 单体对聚合类型的选择及聚合能力 1 取代基对聚合能力的影响(空间效应) 2 取代基对聚合类型的选择(电子效应) 3 单体共聚能力 【授课时间】1 学时 【教学重点】 1 影响聚合热的主要因素及其规律 2 单体对聚合类型的选择及聚合能力 【教学难点】 1 影响聚合热的主要因素及其规律 2 对具体单体聚合热力学与动力学的综合分析 【教学目标】 1 掌握影响聚合热的主要因素及其规律 2 掌握取代基对单体聚合类型选择及聚合能力的影响规律 3 能正确综合分析具体单体的聚合热力学与动力学行为 【教学手段】课堂讲授,辅以实例练习 【教学过程】 聚合能力: 化学结构:两个可相互反应官能团 常见聚合单体类型 两个以上有机官能团单体 C=C-X 热力学:方向,限度,∆G0 解聚 一 聚合热∆H=∆E+P∆V 1 内能变化 ∆E=∆Ef+∆ER+∆Es+∆E’=( Efp - Efm)+( ERp - ERm)+( Esp - Esm)+ ∆E’

E.由键能所贡献的内能 Eg- 一由共振效应所贡献的内能 由空间张力或位阻效应所贡献的内能 △E'其它因素引起的内能变化 (1)双键断裂能 CH,=CH, -CH,-CH,- 609.2-2×351.7=94.2kJmo(实测值AH=-88.8kJ.mo) 2洪效应增H外 (3)位阻效应增强,一AH减小 (4)氢键与溶剂化作用增强,一△H减小 (⑤)强电负性取代基的存在使!一△H增强 (6)需具体综合分析 2压力影响:压力增大,有利于聚合物进行 聚合病 △S=-100.125kmo 三聚合温度 1聚合上限温度 △G=AH.TAS=0→T=AHW△S(不同压力与活度下数值) 一工。有一系列,对应一系列平衡单体浓度 →常规定M 1mol/L时T为聚合上限温度 2平衡单体浓度 AHo Te= △S°+RT InlM 四小结 增强聚合倾向 内因△S影响不大 △E:降低共轭效应,降低位阻效应,降低氢键与溶剂化作用,增强强电负性取代基 外因增大压力路低温府 可解释-甲基 乙烯(a-MeS)的聚合现象 3.12聚合动力学 一连锁聚合种类与活性中心 根据引发活性种与链增长活性中心的不同,链式聚合反应可分为自由基聚合、阳离子聚 合、阴离子聚合和配位聚合等 自由A4分 z=CHX ACH2-CH之之 用离子AB离桥A'B CH."CH 霸离于A8离程AB C-C以A6此格-角之之 单体对聚合类型的选择及聚合能力 】取代基对聚合能力的影响(空间效应) (1)单取代能聚合
3 Ef-由键能所贡献的内能 ER-由共振效应所贡献的内能 Es-由空间张力或位阻效应所贡献的内能 ∆E’-其它因素引起的内能变化 (1) 双键断裂能 CH2=CH2 -CH2-CH2- ∆Ef=εm-εp=609.2-2×351.7=-94.2 kJ.mol-1 (实测值∆H=-88.8 kJ.mol-1) (2)共轭效应增强,|—∆H|减小 (3)位阻效应增强,|—∆H|减小 (4)氢键与溶剂化作用增强,|—∆H|减小 (5)强电负性取代基的存在使|—∆H|增强 (6)需具体综合分析 2 压力影响: 压力增大,有利于聚合物进行 二 聚合熵 ∆S=-100~-125 kJ.mol-1 三 聚合温度 1 聚合上限温度 ∆G=∆H-T∆S=0→Tc=∆H/∆S(不同压力与活度下数值) →Tc 有一系列,对应一系列平衡单体浓度 →常规定[M] e=1mol/L 时 Tc为聚合上限温度 →Tc=∆H0 /∆S0 2 平衡单体浓度 e o o S RT M H Tc ln[ ] 四 小结 增强聚合倾向 内因 ∆S 影响不大 ∆E: 降低共轭效应, 降低位阻效应, 降低氢键与溶剂化作用,增强强电负性取代基 外因 增大压力,降低温度 可解释 α-甲基苯乙烯(α-MeSt)的聚合现象 3.1.2 聚合动力学 一 连锁聚合种类与活性中心 根据引发活性种与链增长活性中心的不同,链式聚合反应可分为自由基聚合、阳离子聚 合、阴离子聚合和配位聚合等 二 单体对聚合类型的选择及聚合能力 1 取代基对聚合能力的影响(空间效应) (1)单取代能聚合 自由基:AA 2A CH2=CHX A CH2 CH X 阳离子 AB CH2=CHX A CH2 H C X 分解 离解 A +B - + B - 阴离子 AB CH2=CHX A CH2 H C X 离解 A -B + + B -

(2)双取代一般可以聚合,但基团太大时难以聚合 3)三、四取代一般不可以聚合,氟取代除外 2取代基对聚合类型的选择(电子效应) (①)取代基的诱导效心 带给电子基团的烯类单体易进行阳离子聚合 带吸电子基团的烯类单体易进行阴离子聚合与自由基 带强给电子基团、强吸电子基团的烯类单体只能分别进行阳离子、阴离子聚合 (2)取代基的共轭效应:流动性大,易诱导极化,可进行多种机理的聚合反应 (③)带不同基团的单体进行几种聚合时的排序 阳离子聚合 取代基-X:NO2,-CN,-F-CL,-COOCH,-CONH,-OCOR,-CH=CH2,-C。H,-CH,-OR 一自由基聚合 一阴离子聚合 3单体共聚能力:与参与共聚的各种单体均有关 3.2自由基聚合机理 【教学内容】 33.1自由基 3.3.2自由基聚合的基元反应 二链增长反应(chain growth) 三链终止反应(chain termination) 四链转移反应(chain transfer) 3.3.3自由基聚合的反应特征 【授课时间】2学时 【教学重点】自由基聚合的基元反应 自由基聚合反应特征 【教学难点】终止方式的相对比例及其与体系状态的关系 【教学目标】 1掌握自由基聚合机理 2掌握自由基聚合反应特征 3能正确写出具体聚合物的基元反应式 【教学手段】课堂讲授,配以Hash动画演示,辅以学生讨论 【教学过程】 33.1自由基 分类与产生 二活性 1影响因素:共轭效应大,吸电子诱导效应大,位阻效应强,稳定性强,活性小 2活性顺序 三反应:加成反应,氧化还原反应,偶合反应,脱氢反应,消去反应 332自由基聚合的基元反应 一链引发反应(chain initiation)→单体自由基 引发剂引发为例 1k。21。号引发活性种,初级自由善,引发自由基 I·+H2C=CH I-CH2-CH 4 ¥ M
4 (2)双取代一般可以聚合,但基团太大时难以聚合 (3)三、四取代一般不可以聚合,氟取代除外 2 取代基对聚合类型的选择(电子效应) (1) 取代基的诱导效应 带给电子基团的烯类单体易进行阳离子聚合 带吸电子基团的烯类单体易进行阴离子聚合与自由基 带强给电子基团、强吸电子基团的烯类单体只能分别进行阳离子、阴离子聚合 (2) 取代基的共轭效应:流动性大,易诱导极化,可进行多种机理的聚合反应 (3) 带不同基团的单体进行几种聚合时的排序 阳离子聚合 取代基-X: -NO2,-CN,-F,-Cl,-COOCH3,-CONH2,-OCOR,-CH=CH2,-C6H5,-CH3,-OR 自由基聚合 阴离子聚合 3 单体共聚能力:与参与共聚的各种单体均有关 3.2 自由基聚合机理 【教学内容】 3.3.1 自由基 3.3.2 自由基聚合的基元反应 一 链引发反应(chain initiation) 二 链增长反应(chain growth) 三 链终止反应(chain termination) 四 链转移反应(chain transfer) 3.3.3 自由基聚合的反应特征 【授课时间】2 学时 【教学重点】自由基聚合的基元反应;自由基聚合反应特征 【教学难点】终止方式的相对比例及其与体系状态的关系 【教学目标】 1 掌握自由基聚合机理 2 掌握自由基聚合反应特征 3 能正确写出具体聚合物的基元反应式 【教学手段】课堂讲授,配以 Flash 动画演示,辅以学生讨论 【教学过程】 3.3.1 自由基 一 分类与产生 二 活性 1 影响因素:共轭效应大,吸电子诱导效应大,位阻效应强,稳定性强,活性小 2 活性顺序 三 反应:加成反应,氧化还原反应,偶合反应,脱氢反应,消去反应 3.3.2 自由基聚合的基元反应 一 链引发反应(chain initiation) 慢 单体自由基 引发剂引发为例 I 2 I kd I ki I CH2 引发活性种,初级自由基,引发自由基 H2C CH X + CH X M

二链增长反应(chain growh)益一括性高分子链 I-CH2-CH+H2C=CH Kp 之cH-CH一链自由基 X X M. 链结构在该步形成: 序列结构一→头尾为主 顺反结构一温度升高有利于顺式结构生成 立体结构→无规结构 三链终止反应(chain termination) 稳定大分子 1双基终止(均相体系,主要方式) 偶合:2wCH2-CH Kte ∽CH2-CH-CH-CH2 歧化:2一cH2-CHka CH2-CH2+CH=CH X PS,PAN偶合为主;PMMA偶合歧化兼有:PVAC歧化为主 问题:k>k为何还可得到大分子? 2单基终止 四链转移反应(chain transfer)一条工不同活性的链自由基 CH2-CH+S- CH2-CH2 +S 3.33自由基聚合的反应特征 1慢反应,快增长,速终止
5 二 链增长反应(chain growth) 快 活性高分子链 链结构在该步形成: 序列结构→头尾为主 顺反结构→温度升高有利于顺式结构生成 立体结构→无规结构 三 链终止反应(chain termination) 速 稳定大分子 1 双基终止(均相体系,主要方式) PS,PAN 偶合为主; PMMA 偶合歧化兼有; PVAc 歧化为主 问题:kt>>kp, 为何还可得到大分子? 2 单基终止 四 链转移反应(chain transfer) 一定条件下 不同活性的链自由基 3.3.3 自由基聚合的反应特征 1 慢反应,快增长,速终止 2 3 kp I CH2 H2C CH X CH + X M CH2 CH X 链自由基 CH2 CH X 偶合: 2 CH2 CH X CH CH2 X 歧化: CH2 CH X 2 CH2 CH2 X CH CH X + ktc ktd ktr CH2 CH + X S CH2 CH2 + S X

4放热反应,低温有利 3.3链引发反应 【教学内容】 3,3.1引发剂类型 一热分解型 二氧化还原类 332引发剂活性(表征方法 333 引发剂效率 334引发剂的选打 【授课时间】2学时 【教学重点】典型类型引发剂:引发剂活性表征方法:引发剂效率及影响因素:引发剂的选 择原则 【教学难点】氧化还原类的反应式:笼蔽效应与诱导效应 【教学目标】 1掌握引发剂活性表示方法及其计算方法 2掌握引发剂效率、笼蔽效应、诱导效应等基本概念 3能正确写出典型引发剂的结构式与引发反应式 4能根据具体要求选择匹配的引发齐 【教学手段】课堂讲授,辅以多媒体幻灯图片及实例 【教学过程】 3.3.1引发剂类型 一热分解型(Ed=80140 kI/mol.中高温使用) 1偶氮类引发剂 个3 R2 N=N-( -R1 R-C-N-N-C-R1 + X X (X=吸电子取代基) 对称 不对称 HgC-C- 3 CN CN 2 HgC-c +N2 N 偶氮二异丁睛(AIBN) 2过氧类引发剂 ()有机过氧类 a烷基过氧化氢(RC-O-O-H):异丙苯过氧化氢(CHP),叔丁基过氧化氢(t-BHP) b二烷基过氧化物(R-0-O-R'):过氧化二异丙苯 6
6 4 放热反应,低温有利 3.3 链引发反应 【教学内容】 3.3.1 引发剂类型 一 热分解型 二 氧化还原类 3.3.2 引发剂活性(表征方法) 3.3.3 引发剂效率 f 3.3.4 引发剂的选择 【授课时间】2 学时 【教学重点】典型类型引发剂;引发剂活性表征方法;引发剂效率及影响因素;引发剂的选 择原则 【教学难点】氧化还原类的反应式;笼蔽效应与诱导效应 【教学目标】 1 掌握引发剂活性表示方法及其计算方法 2 掌握引发剂效率、笼蔽效应、诱导效应等基本概念 3 能正确写出典型引发剂的结构式与引发反应式 4 能根据具体要求选择匹配的引发剂 【教学手段】课堂讲授,辅以多媒体幻灯图片及实例 【教学过程】 3.3.1 引发剂类型 一 热分解型(Ed=80~140kJ/mol,中高温使用) 1 偶氮类引发剂 2 过氧类引发剂 (1) 有机过氧类 a 烷基过氧化氢(RC-O-O-H):异丙苯过氧化氢(CHP),叔丁基过氧化氢(t-BHP) b 二烷基过氧化物(R-O-O-R’):过氧化二异丙苯 R 1 C R 2 X N N C R 1 X R 2 R C R X N N C R 1 X R 2 对称 不对称 (X=吸电子取代基) H3C C CH3 CN N N C CH3 CH3 CN H3C C CH3 CN 2 + N2 偶氮二异丁腈(AIBN)

c过氧化酯(RCOOCR) d过氧化二酰(RCOOOCOR') m-oio- —2Ph-c-0 过氧化苯甲酰(B即PO) Ph-do. Ph.+CO, e过氧化二碳酸酯(ROOC-O-O-COOR):过氧化二碳酸二异丙酯(PP) (2)无机过氧类:S,02一一2S0 二氧化还原类(Ed40一60 kJ/moI,.低温使用) 1水溶性 (山生成一种R HOOH+Fe2-HO.+OH +Fe3 S2Os+Fe2-SO+SO4+Fe3 用量:还原剂<氧化剂,否则Fe2+OH→Fe+OH白白消耗自由基 (2)生成一种R S02-+S0 →S0,2+S0r+s0g- 2油溶性 332引发剂活性(表征方法) 一分解速率常数kd越大,引发剂活性越大 二分解活化能d越小,引发剂活性越大 kg=A,eaIR网 三半衰期t2越小,引发剂活性越大 品 -n2.069 四残留分率四心越小,引发剂活性越大 W。=2品 3.33引发剂效率1 引发自由基对引发剂的诱导分解 Pm80-08Pm·P.→Pn80-Pn·pm80 0 笼蔽效应(Cage Effect) 引发剂分解产生的初级自由基,在开始的瞬间被溶剂分子所包围,不能与单体分子接触 无法发生链引发反应。处于笼蔽效应中的初级自由基由于浓度高,易发生结合、歧化及诱导 分解等副反应
7 c 过氧化酯(RCOOCR’) d 过氧化二酰(RCOOOCOR’) e 过氧化二碳酸酯(ROOC-O-O-COOR’):过氧化二碳酸二异丙酯(IPP) (2) 无机过氧类:S2O8 2─→2 SO4‧ ─ 二 氧化还原类(Ed=40~60kJ/mol,低温使用) 1 水溶性 (1) 生成一种 R‧ HOOH + Fe2+→HO‧ +OH─ +Fe3+ S2O8 2─+ Fe2+ →SO4 2─ + SO4‧ ─ +Fe3+ 用量:还原剂<氧化剂,否则 Fe2++‧ OH→Fe3++OH─白白消耗自由基 (2) 生成一种 R‧ S2O8 2─+ SO3 2─→SO4 2─+ SO4‧ ─ + SO3‧ ─ 2 油溶性 3.3.2 引发剂活性(表征方法) 一 分解速率常数 kd 越大,引发剂活性越大 k I dt d I Rd d [ ] k t I I d o [ ] [ ] ln 二 分解活化能 Ed 越小,引发剂活性越大 E RT d d d k A e / 三 半衰期 t1/2 越小,引发剂活性越大 1/ 2 [ ] / 2 [ ] ln k t I I d o o d d k k t ln 2 0.693 1 / 2 四 残留分率[I]/[I]o 越小,引发剂活性越大 1/ 2 [ ]/[ ] 2 t t o I I 3.3.3 引发剂效率 f 一 二 笼蔽效应(Cage Effect) 引发剂分解产生的初级自由基,在开始的瞬间被溶剂分子所包围,不能与单体分子接触, 无法发生链引发反应。处于笼蔽效应中的初级自由基由于浓度高,易发生结合、歧化及诱导 分解等副反应。 Ph C O O O C O Ph 2 Ph C O O Ph C O O Ph + CO2 过氧化苯甲酰(BPO) Ph C O O O C O Ph + Ph Ph C O O Ph + Ph C O O 引发自由基对引发剂的诱导分解

三引发剂效率一→用于引发单体的引发剂量/投入引发剂的量 33.4引发剂的选择 1溶解性 2活性: 半衰期与反应时间处于同一数量级 3用量:单体用量的0.1%-2% 4其它: 其它引发方式自学 3.4聚合反应动力学 【教学内容】 34.1聚合反应动力学研究方法 一聚合速率的表示 二豪合速率的测油 三动力学曲线分析 3.42自由基聚合初期聚合反应速率 「自由基聚合聚合初动力学方程的推导 二关于动力学方程的讨论 三关于基元反应速率常数 四反应温度与压力对聚合反应速率的影而 34.3聚合中期反应速率 自动加速现象 凝胶效因 三沉淀效应 四影响因素 3.44聚合后期反应速率 34.5聚合类型 【授课时间】1.5学时 【教学重点】 1自由基聚合聚合初动力学方程的推导与应用条件 2关于动力学方程的时论 3自动加速现象 凝胶效应、沉淀效应 【教学难点】不同条件下反应速率对单体与引发剂浓度的反应级数的推导与分析 【教学目标】 1掌握推导聚合初期反应速率的基本假设与适用条件 2堂握聚合初期反应速率的推导过程并将其迁移至不同条件和不同历程中进行推导 3利用动力学方程式计算,包括各反应速率常数、单体与引发剂浓度、反应时间等 4掌握反应温度对聚合初期反应速率的影 5掌握聚合中后期反应速率的变化特征 【教学手段】课堂讲授,辅以多媒体幻灯图片及学生推导练习 【教学过程】 34】聚合反应动力学研究方法 聚合速率的表示 diM 以单体浓度的减少表示 ·以聚合物浓度的增加表示 ·以转化率的变化表示 R=-=w1
8 三 引发剂效率 f→用于引发单体的引发剂量/投入引发剂的量 3.3.4 引发剂的选择 1 溶解性: 2 活性:半衰期与反应时间处于同一数量级 3 用量:单体用量的 0.1%~2% 4 其它: 其它引发方式自学 3.4 聚合反应动力学 【教学内容】 3.4.1 聚合反应动力学研究方法 一 聚合速率的表示 二 聚合速率的测定 三 动力学曲线分析 3.4.2 自由基聚合初期聚合反应速率 一 自由基聚合聚合初动力学方程的推导 二 关于动力学方程的讨论 三 关于基元反应速率常数 四 反应温度与压力对聚合反应速率的影响 3.4.3 聚合中期反应速率 一 自动加速现象 二 凝胶效应 三 沉淀效应 四 影响因素 3.4.4 聚合后期反应速率 3.4.5 聚合类型 【授课时间】1.5 学时 【教学重点】 1 自由基聚合聚合初动力学方程的推导与应用条件 2 关于动力学方程的讨论 3 自动加速现象、 凝胶效应、沉淀效应 【教学难点】不同条件下反应速率对单体与引发剂浓度的反应级数的推导与分析 【教学目标】 1 掌握推导聚合初期反应速率的基本假设与适用条件 2 掌握聚合初期反应速率的推导过程,并将其迁移至不同条件和不同历程中进行推导 3 利用动力学方程式计算,包括各反应速率常数、单体与引发剂浓度、反应时间等 4 掌握反应温度对聚合初期反应速率的影响 5 掌握聚合中后期反应速率的变化特征 【教学手段】课堂讲授,辅以多媒体幻灯图片及学生推导练习 【教学过程】 3.4.1 聚合反应动力学研究方法 一 聚合速率的表示 • 以单体浓度的减少表示 • 以聚合物浓度的增加表示 • 以转化率的变化表示 dt d[M ] dt d[P] dt dC M dt d M Rp o [ ] [ ]

二聚合速率的测定 1自接法。直接定未反应的单体最或生成的聚合物最 2间接法 测定聚合过程中物性常数的变化,依据原理:各项物性常数的变化量均与单体转 化率或聚合物生成量成正比 膨胀计法:聚合反应(初期)过程中体积收缩与转化率呈线性关系 R-C-CIML 43-4 三动力学曲线分析 MMA50℃,BPO PMMA(s形) 诱导期 一→2R杂质 失活 等速期 RD恒定 ℃%=0-20% 聚合初期 加速期 Rp自动加速 C%=20-80% 聚合中期) 减速期 Rp减小 ℃%=80-95% (聚合后期) 3.42自由基聚合初期聚合反应速率 一自由基聚合聚合初动力学方程的推导 条件 R=-d[Ml/dt 无链转移 -R+R1+R++Rn一 等活性理论 自由基活性与链长无关 k。,k=k [RM]+IRM.]*.+[RM.]-[M] =R+Ro ◆一酸MM 聚合度很大 R《R Rp
9 二 聚合速率的测定 1 直接法:直接测定未反应的单体量或生成的聚合物量 2 间接法:测定聚合过程中物性常数的变化,依据原理:各项物性常数的变化量均与单体转 化率或聚合物生成量成正比 膨胀计法:聚合反应(初期)过程中体积收缩与转化率呈线性关系 三 动力学曲线分析 MMA 50℃,BPO PMMA (s 形) 1 诱导期 I→2R.杂质 失活 2 等速期 (聚合初期) Rp 恒定 C%=0-20% 3 加速期 (聚合中期) Rp 自动加速 C%=20-80% 4 减速期 (聚合后期) Rp 减小 C%=80-95% 3.4.2 自由基聚合初期聚合反应速率 一 自由基聚合聚合初动力学方程的推导 R=-d[M]/dt =Ri+Rp1+Rp2+.+Rpn ≈ Rp =Ri+Rp 条件I 无链转移 假设I 等活性理论: 自由基活性与链长无关 kp1=kp2=.=kpn [RM·]+[RM2·]+.+[RMn·]=[M·] Rp=kp[M·][M] 假设II 聚合度很大 Ri《Rp p M o t t C C R [ ] 2 1 2 1
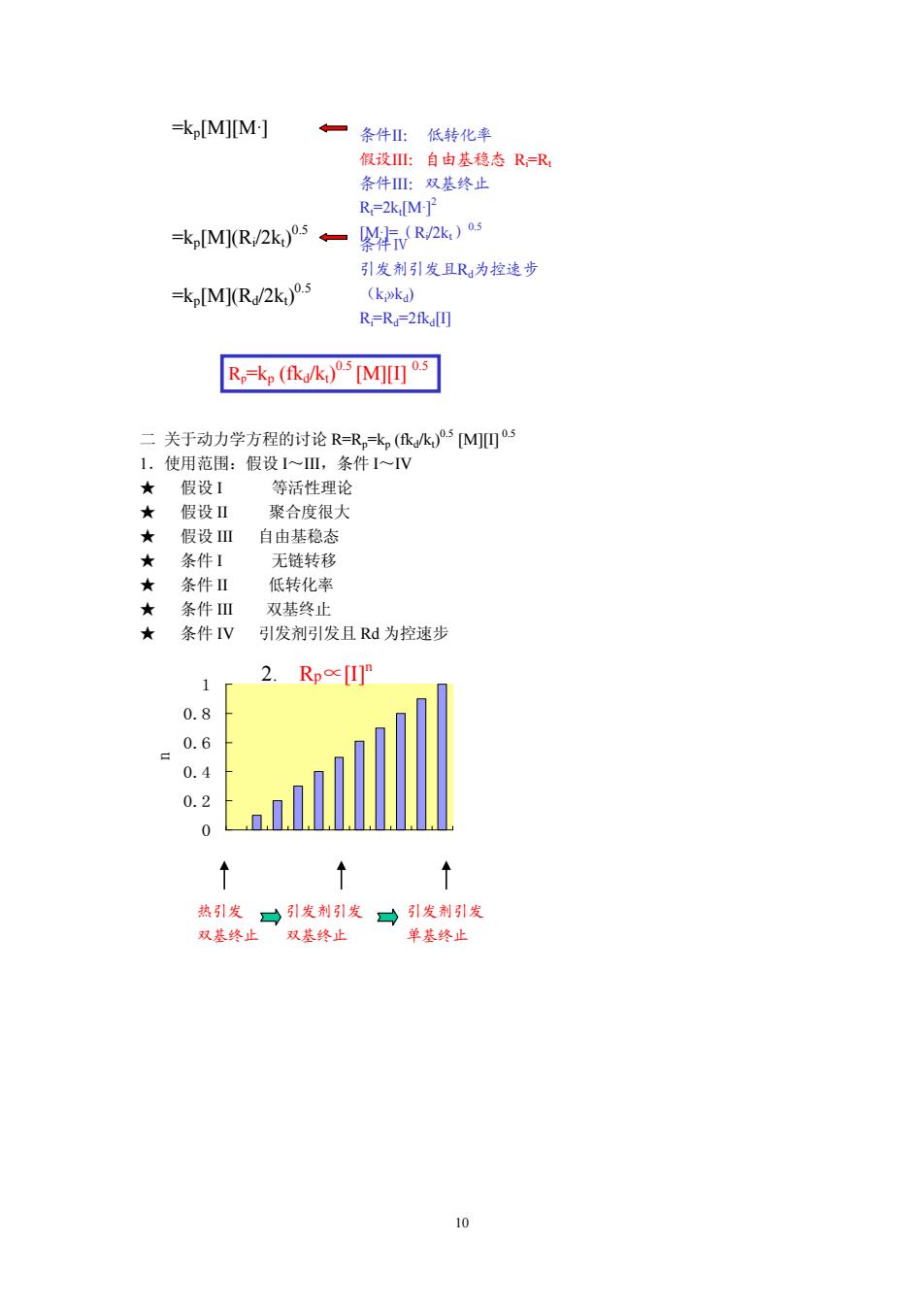
=kp[M][M:] ◆一条件亚:低转化率 假设耻自由基稳态R=R 条件 。双其终止 R-2klMP =k [MK(R/2k)5/k) 引发剂引发且R为控速步 =kM(R2k)°-5 (kok) R-R.-2fkallJ Rk,kM啊 :关于动力学方程的时论R=R式,kM四 1.使用范用:假设1~Ⅲ,条件~V 假设1 等活性理论 ★ 假设Ⅱ 聚合度很大 假设田自由基稳态 条件1 链转移 ★ 条件Ⅱ 低 化南 条件Ⅲ 双基终 ★条件IV引发剂引发且Rd为控速步 1 2.Rp∝U 0.8 0.6 0.4 0.2 0 热引发一引发荆引发 可引发制引发 双基终止 双基终止 单基终止
10 二 关于动力学方程的讨论 R=Rp=kp (fkd/kt) 0.5 [M][I] 0.5 1.使用范围:假设 I~III,条件 I~IV ★ 假设 I 等活性理论 ★ 假设 II 聚合度很大 ★ 假设 III 自由基稳态 ★ 条件 I 无链转移 ★ 条件 II 低转化率 ★ 条件 III 双基终止 ★ 条件 IV 引发剂引发且 Rd 为控速步 0 0.2 0.4 0.6 0.8 1 n 2. Rp∝[I]n 引发剂引发 双基终止 热引发 双基终止 引发剂引发 单基终止 =kp[M][M·] =kp[M](Ri /2kt) 0.5 =kp[M](Rd/2kt) 0.5 Rp=kp (fkd/kt) 0.5 [M][I] 0.5 条件II: 低转化率 假设III:自由基稳态 Ri=Rt 条件III:双基终止 Rt=2kt[M·] 2 [M·]=(Ri /2kt)0.5 条件Ⅳ 引发剂引发且Rd为控速步 (ki»kd) Ri=Rd=2fkd[I]