
第品幸 氧化逐原简法 2024-10-1
2024-10-1 1

氧化还原滴定法 (Reduction-oxydation titrations) 氧化还原滴定法是以氧化还原反应为基础的滴 定分析方法; 氧化还原滴定法的特点: (1)应用范围非常广泛,可以直接或间接的测 定多种具有氧化性或还原性的物质; (2)可用的滴定剂多。如高锰酸钾法、重铬酸 钾法、碘量法、溴量法、铈量法 (3)氧化还原反应基于电子转移,机理复杂, 反应往往是分步进行的,还常伴有各种副反应 发生,使反应物之间没有确定的计量关系,产 物受介质的影响。 2024-10-1 2
2024-10-1 2 氧化还原滴定法是以氧化还原反应为基础的滴 定分析方法; 氧化还原滴定法的特点: (1)应用范围非常广泛,可以直接或间接的测 定多种具有氧化性或还原性的物质; (2)可用的滴定剂多。如高锰酸钾法、重铬酸 钾法、碘量法、溴量法、铈量法 (3)氧化还原反应基于电子转移,机理复杂, 反应往往是分步进行的,还常伴有各种副反应 发生,使反应物之间没有确定的计量关系,产 物受介质的影响

6.1氧化还原平衡 6.1.1概述 ■,可逆氧化还原电对:可迅速建立起氧化还原 平衡,其电势基本符合Nernst公式计算的理论 电势. 例如:Fe3+/Fe2+,Fe(CN)63-Fe(CN)64,l2/l 2.不可逆氧化还原电对:不能在氧化还原反应 的任一瞬间建立起真正的平衡,其实际电势与 Nernst.公式计算的理论电势相差较大. 例如:Mn○4/Mn2+,Cr20,21Cr3+,S4O62/S2032 C02/C2042,O2H202,H202/H20 2024-10-1
2024-10-1 3

续 銦在处理氧化还原平衡时,还应注意 到电对有对称和不对称的区别。 3.对称电对:氧化态与还原态的系数 相同。 例如:Fe3++e=Fe2+, MnO4-+8H++5e Mn2++4H2O 4.不对称电对:氧化态与还原态系数 不同。 例如:l2+2e=2, Cr20,2+14Ht+6e=2Cr3++ 7H20 2024-10-1
2024-10-1 4

例1 0.100mo/LKCr2O7溶液,加入固体亚 铁盐使其还原。设此时溶液的 [H]=0.1mol/L,平衡电势E=1.17V, 求Cr2O2的转化率。 解:Cr202+14H++6e-=2Cr3++ H2O MBE:[Cr2O2]+0.5[Cr3+]=0.100moL [Cr3]=0.200-2[Cr2072] 根据能斯特公式, 2024-10-1
2024-10-1 5

E=Ecno0.059 lgCr2OH Cr3+2 0.059. 1.17=1.33+ 0g10+0059 /Cr,0,21 g0.200-210r,0, 可求得: [Cr,0,2]=2.30×104ol/L 转化率 0.100-2.30×10-4 ×100% 0.100 =99.8% 2024-10-1 K
2024-10-1 6 99.8% 100% 0.100 0.100 2.30 10 [ ] 2.30 10 / 4 2 4 2 7 转化率 Cr O mol L 2- 2 2 2 -14 2 7 3 2 2 2 7 Cr O Cr (0.200 - 2[Cr ]) Cr O ] lg 6 0.059 lg10 6 0.059 [Cr ] Cr O ][H lg 6 0.059 2 3 2 7 7 14 1.17 1.33 ] O [ [ E E
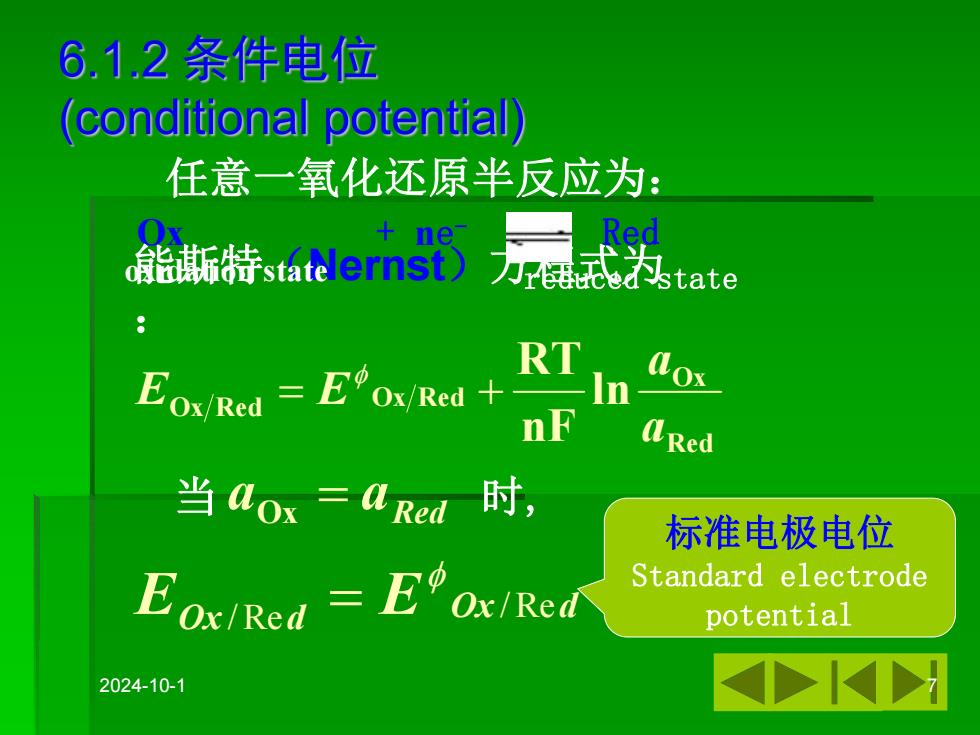
6.1.2条件电位 (conditional potential) 任意一氧化还原半反应为: ne 盖斯特sdernst) Red 力r每品e为tate Fox/Red =EOx/Red+ RT In nF Red 当aox=4red时, 标准电极电位 Eox/Red EOx/Red Standard electrode potential 2024-10-1
2024-10-1 7 任意一氧化还原半反应为: Ox + ne - Red Red Ox R Ox Red Ox ed ln nF RT a a E E 能斯特(Nernst)方程式为 : 当 时, Red a a Ox Ox d EOx d E /Re /Re 标准电极电位 Standard electrode potential oxidation state reduced state
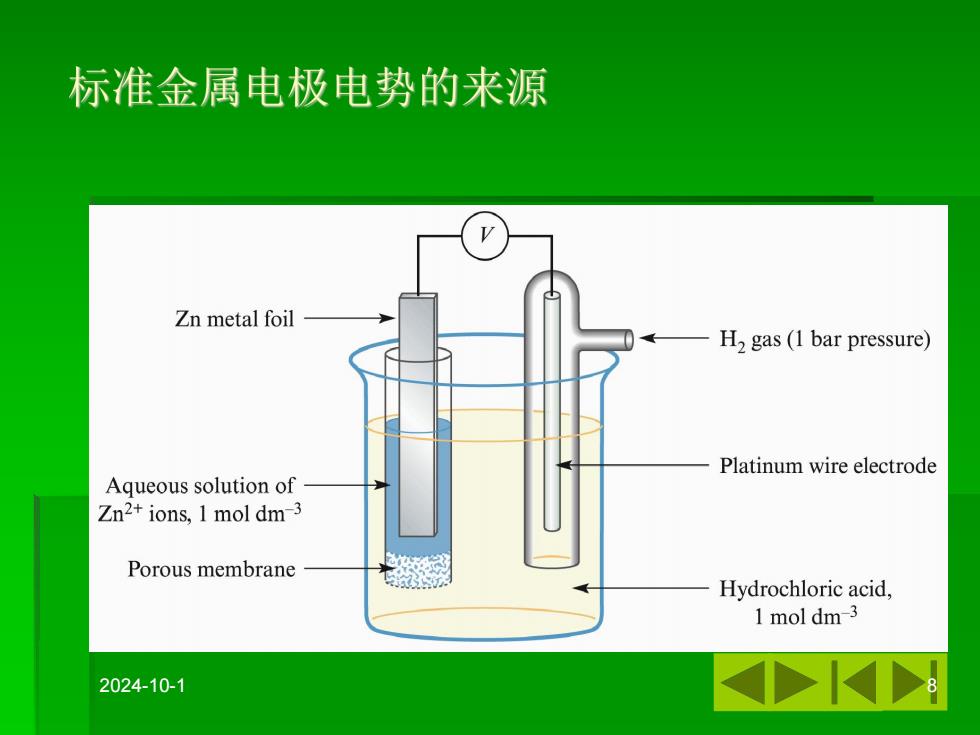
标准金属电极电势的来源 Zn metal foil H2 gas(1 bar pressure) Platinum wire electrode Aqueous solution of Zn2+ions,1 mol dm-3 Porous membrane Hydrochloric acid, 1 mol dm-3 2024-10-1
2024-10-1 8

1。影响氧化还原电对的因素 离子强度(ionic strength) 鍶鍶在氧化还原反应中,溶液的离子 强度一般较大,氧化态和还原态的电 荷数也较高,因此它们的活度系数都 远小于1,使得电对的条件电位与标准 电极电位产生差异。但实际中活度系 数不易求得,且其影响远小于各种副 反应,故计算中一般忽略离子强度的 影响。 2024-10-1
2024-10-1 9

溶液的酸度 银银当申对的半反应有H肚和0H参:,食鉴 的酸度对条件电极电位有很大的影响, 使某些氧化还原反应方向改变。 H3As04+2H++2e=HAs02+2H20 E0=0.56V ●I3+2e=3I E0=0.54V pH=8.00时,HAsO4】HAsQ2的D9=0.11V, 皎I,可氧化As)为As(V) 202410-1
2024-10-1 10 当电对的半反应有H+和OH-参加时,溶液 的酸度对条件电极电位有很大的影响,甚至 使某些氧化还原反应方向改变。 H3AsO4 + 2H+ + 2e = HAsO2 + 2H2O Eø= 0.56V • I3 - + 2e = 3I - Eø= 0.54V 当pH=8.00时, H3AsO4 / HAsO2的 Φø= 0.11V, 故I2可氧化As(Ⅲ) 为As(Ⅴ)