
第三章 酸碱滴定法的应用 滴定分析法 二、配位滴定法的应用 三、氧化还原滴定法的 应用 第四节 滴定分析法应用 四、沉淀滴定法的应用 下页 帽动 越回
第三章 滴定分析法 第四节 滴定分析法应用 一、酸碱滴定法的应用 二、配位滴定法的应用 三、氧化还原滴定法的 应用 四、沉淀滴定法的应用

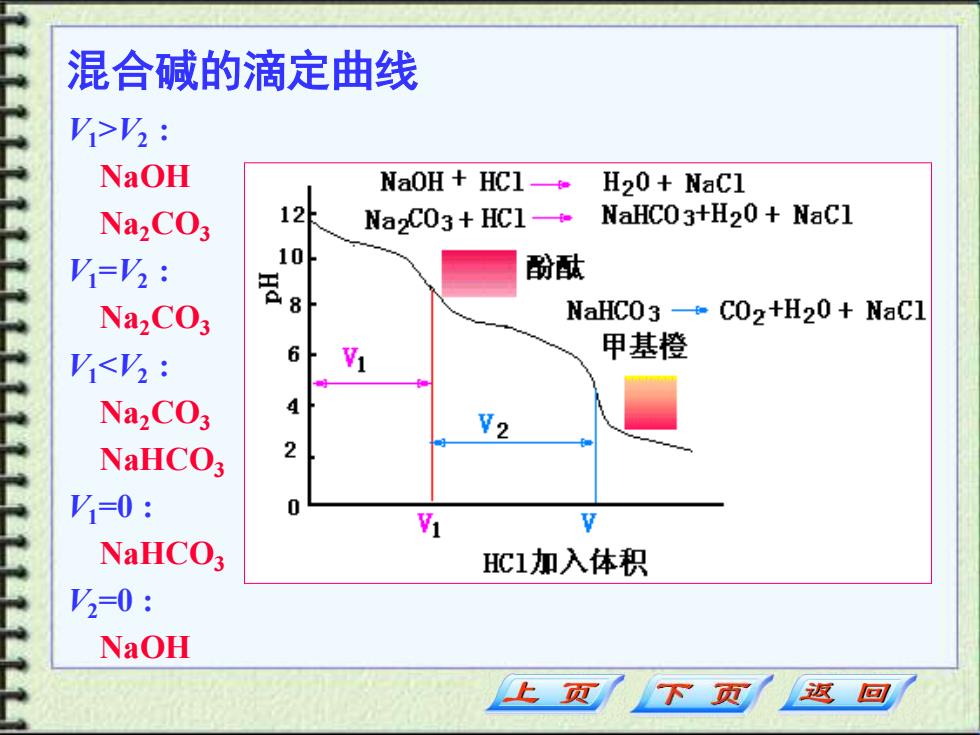
、 酸碱滴定法的应用 1.混合碱的测定(双指示剂法) (动画) NaOH,Na2C03,NaHCO3,判断由哪两种组成(定性/定量 计算)。Na2CO3能否直接滴定,有几个突跃? H2CO3=H++HCO3 pKa=6.38 HC03=Ht+C032pKa2=10.25 V>V2:NaOH(V1-V),Na2CO3(V) V=V2:Na.CO Vi<V2 Na,CO3(V),NaHCO3(V2-V1) V=0:NaHCO =0:NaOH 上页 下页 返回
一、酸碱滴定法的应用 1.混合碱的测定(双指示剂法) NaOH ,Na2CO3 ,NaHCO3 , 判断由哪两种组成(定性/定量 计算)。Na2CO3能否直接滴定, 有几个突跃? H2CO3 = H+ + HCO3 - pKa1=6.38 HCO3 - = H+ + CO3 2- pKa2=10.25 V1>V2 : NaOH(V1 – V2 ) ,Na2CO3 (V2 ) V1=V2 : Na2CO3 V1<V2 : Na2CO3 (V1 ),NaHCO3 (V2 –V1 ) V1=0 : NaHCO3 V2=0 : NaOH (动画)
混合碱的滴定曲线 K>: NaOH NaOH+HC1- H20+NaCl NazCO3 12 Na2C03+HCl- NaHCO3+H20+NaCl V=V2: 10 酚酞 Na,CO3 NaHCO3-CO2+H20+NaCl <: 6 甲基橙 Na2CO3 4 NaHCO3 2 V=0: NaHCO; HC1加入体积 3=0: NaOH 上页 下页返回
混合碱的滴定曲线 V1>V2 : NaOH Na2CO3 V1=V2 : Na2CO3 V1<V2 : Na2CO3 NaHCO3 V1=0 : NaHCO3 V2=0 : NaOH

2.化合物中氮含量的测定 (1)蒸馏法 将铵盐试液置于蒸馏瓶中,加入过量浓NaOH溶液进行 蒸馏,用过量的H3BO3溶液吸收蒸发出的NH3: NH3+H3 BO3=NH++H2BO3 用HC1标准溶液滴定反应生物的HBO3, H++H2BO3=H3BO3 终点时的pH=5,选用甲基红作指示剂。 下页 返回
2.化合物中氮含量的测定 (1)蒸馏法 将铵盐试液置于蒸馏瓶中,加入过量浓NaOH溶液进行 蒸馏,用过量的H3BO3溶液吸收蒸发出的NH3: NH3+ H3BO3 = NH+ 4+ H2BO3 - 用HCl标准溶液滴定反应生物的H2BO3 -, H+ + H2BO3 - = H3BO3 终点时的pH=5,选用甲基红作指示剂

(2)甲醛法 反应式: 6HCHO+4NH=(CH2)6NH++3H++6H2O 利用NaOH标准溶液滴定反应生成的4个H+。 六次甲基四胺(CH2)6N4是一种极弱有机碱,应选用 酚酞作指示剂。 上页下页返回
(2)甲醛法 反应式: 6HCHO+4NH4 + =(CH2 )6N4H++3H + +6H2O 利用NaOH标准溶液滴定反应生成的4 个H+ 。 六次甲基四胺(CH2)6N4是一种极弱有机碱,应选用 酚酞作指示剂

(3)克氏Kjeldahl定氮法 氨基酸、蛋白质、生物碱中的氮常用克氏法测定。 将适量浓硫酸加入试样中加热,使C、H转化为CO,和 H2O。N元素在铜盐或汞盐催化下生成NH4+,消化分解后 的溶液中加入过量NaOH溶液,再用蒸馏法测定NH3。 上页 下页 返回
(3)克氏(Kjeldahl)定氮法 氨基酸、蛋白质、生物碱中的氮常用克氏法测定。 将适量浓硫酸加入试样中加热,使C、H转化为CO2和 H2O。 N元素在铜盐或汞盐催化下生成NH4 + ,消化分解后 的溶液中加入过量NaOH溶液,再用蒸馏法测定NH3

3.硅含量的测定 试样处理过程: KOH 6HF 热H20 Si02 K2SiOg -→ K2SiF6↓ 4HF 滴定生成的强酸HF; 上页下页返回
3. 硅含量的测定 SiO2 -→ K2SiO3 -→ K2SiF6↓ -→ 4HF KOH 试样处理过程: 6HF 热H2O 滴定生成的强酸 HF;
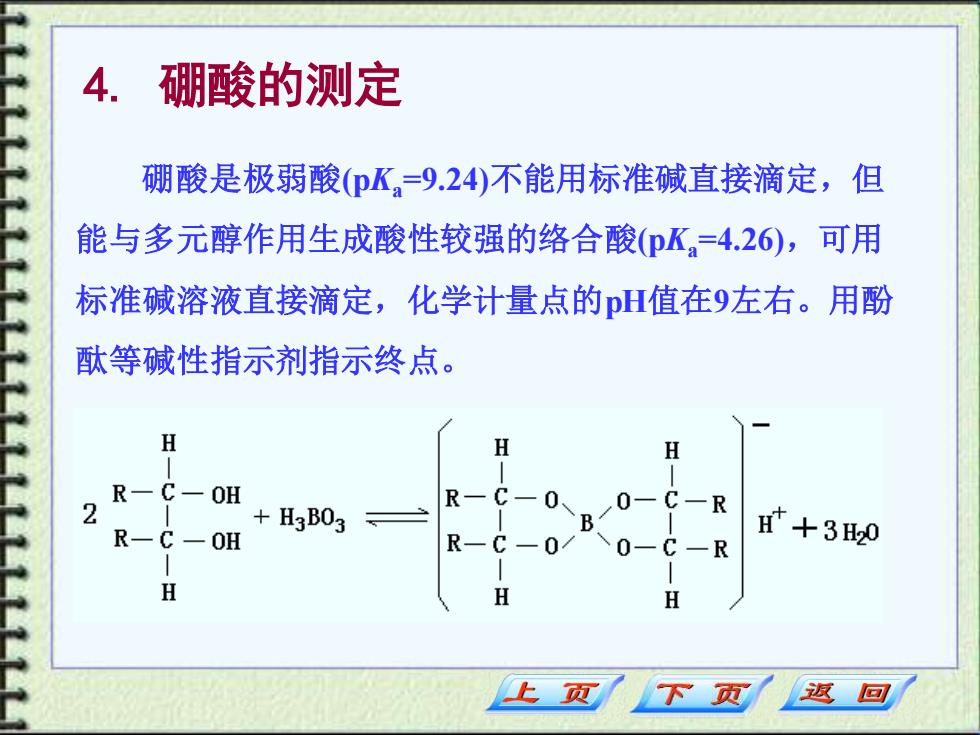
4. 硼酸的测定 硼酸是极弱酸(pK,=9.24)不能用标准碱直接滴定,但 能与多元醇作用生成酸性较强的络合酸(pK=4.26),可用 标准碱溶液直接滴定,化学计量点的H值在9左右。用酚 酞等碱性指示剂指示终点。 H H H R-C一OH 2 R-C一 +H3B03 B/O-C-R 0 R一C一0H R-C-0/ 八0-C-R 时+30 H H H 页 页 返回
4. 硼酸的测定 硼酸是极弱酸(pKa=9.24)不能用标准碱直接滴定,但 能与多元醇作用生成酸性较强的络合酸(pKa=4.26),可用 标准碱溶液直接滴定,化学计量点的pH值在9左右。用酚 酞等碱性指示剂指示终点

二、配位滴定法及其应用 1.提高测定选择性的方法 (1)控制溶液的酸度 例:在Fe3+和A3+离子共存时,假设其浓度均为 0.01mol/L, 滴定Fe3+最低pH:1.2, 滴定A3+最低pH:4.0, 实现共存离子的分步测定(或称连续测定)。 在相同pH,当cc时; AgKY≥6可分步测定。 页 下页返回
二、配位滴定法及其应用 1.提高测定选择性的方法 (1) 控制溶液的酸度 例:在Fe3 + 和Al3+ 离子共存时,假设其浓度均为 0.01mol/L, 滴定Fe3+ 最低pH:1.2, 滴定Al3+ 最低pH:4.0, 实现共存离子的分步测定(或称连续测定)。 在相同pH,当cM =cN时; ΔlgKMY ≥6 可分步测定

(2) 利用掩蔽法对共存离子进行分别测定 a.配位掩蔽法 通过加入一种能与干扰离子生成更稳定配合物的掩蔽剂 来消除干扰。 b.氧化还原掩蔽法 例如:Fe3+干扰Zr+的测定,加入盐酸羟胺等还原剂使 Fe3+还原生成Fe+,达到消除干扰的目的。 c.沉淀掩蔽法 例如:为消除Mg2+对Ca+测定的干扰,利用pHE12时, Mg2+与OH一生成Mg(OD2沉淀,可消除Mg2+对Ca2+测定的 干扰。 下页 返回
(2) 利用掩蔽法对共存离子进行分别测定 a. 配位掩蔽法 通过加入一种能与干扰离子生成更稳定配合物的掩蔽剂 来消除干扰。 b. 氧化还原掩蔽法 例如: Fe3+干扰Zr++的测定,加入盐酸羟胺等还原剂使 Fe3+还原生成Fe2+ ,达到消除干扰的目的。 c. 沉淀掩蔽法 例如:为消除Mg2+对Ca2+测定的干扰,利用pH≥12时, Mg2+与OH-生成Mg(OH)2沉淀,可消除Mg2+对Ca2+测定的 干扰