
第一章绪论 1.1有机化合物和有机化学 1.2 有机化合物的特性 1.3分子结构和结构式 1.4 共价键 1.4.1共价键的形成 (1)价键理论 2)轨道杂化 3)分子轨道理论 1.4.2共价键的属性 (1) 键长 (2) 键能 3) 键角
第一章 绪 论 1.1 有机化合物和有机化学 1.2 有机化合物的特性 1.3 分子结构和结构式 1.4 共价键 1.4.1 共价键的形成 (1) 价键理论 (2) 轨道杂化 (3) 分子轨道理论 1.4.2 共价键的属性 (1) 键长 (2) 键能 (3) 键角

④)键的极性和诱导效应 1.4.3共价键的断裂和有机反应的类型 1.5分子间相互作用力 1.5.1偶极-偶极相互作用 1.5.2 van der Waals力 1.5.3 氢键 1.6酸碱的概念 1.6.1 Bronsted酸碱理论 1.6.2 Lewis酸碱理论 1.6.3硬软酸碱原理 1.7有机化合物的分类 1.8有机化合物的研究程序
(4) 键的极性和诱导效应 1.4.3 共价键的断裂和有机反应的类型 1.5 分子间相互作用力 1.5.1 偶极-偶极相互作用 1.5.2 van der Waals 力 1.5.3 氢键 1.6 酸碱的概念 1.6.1 Brønsted 酸碱理论 1.6.2 Lewis 酸碱理论 1.6.3 硬软酸碱原理 1.7 有机化合物的分类 1.8 有机化合物的研究程序
1.1有机化合物和有机化学 有机化合物的组成 基本元素:C 其它元素:H,N,O,X,S,P,Si等 有机化合物为碳氢化合物及其衍生物 有机化学是研究C化合物的化学 有机化学的研究内容: 组成 有机化合物 结构 性质 有机反应 性质的变化规律 结构与反应性之间的关系
1.1 有机化合物和有机化学 有机化合物的组成 基本元素:C 其它元素: H, N, O, X, S, P, Si 等 有机化合物为碳氢化合物及其衍生物 有机化学是研究 C 化合物的化学 有机化合物 性质的变化规律 性质 有机反应 结构与反应性之间的关系 组成 结构 有机化学的研究内容:

1.2有机化合物的特性 1.3分子结构和结构式 分子(molecules): 组成的原子一 定的排列顺序相互影响 相互作用结合的整体 分子结构 原子排列的顺序和相互作用 分子式 表示组成分子的原子种类和数目 CH3CH2OH C2H6O 乙醇 CH3OCH3 甲醚
1.3 分子结构和结构式 分子(molecules): 组成的原子 一定的排列顺序 相互影响 相互作用 结合的整体 分子结构 原子排列的顺序和相互作用 1.2 有机化合物的特性 分子式 表示组成分子的原子种类和数目 C2H6O CH3CH2OH CH3OCH3 乙醇 二甲醚
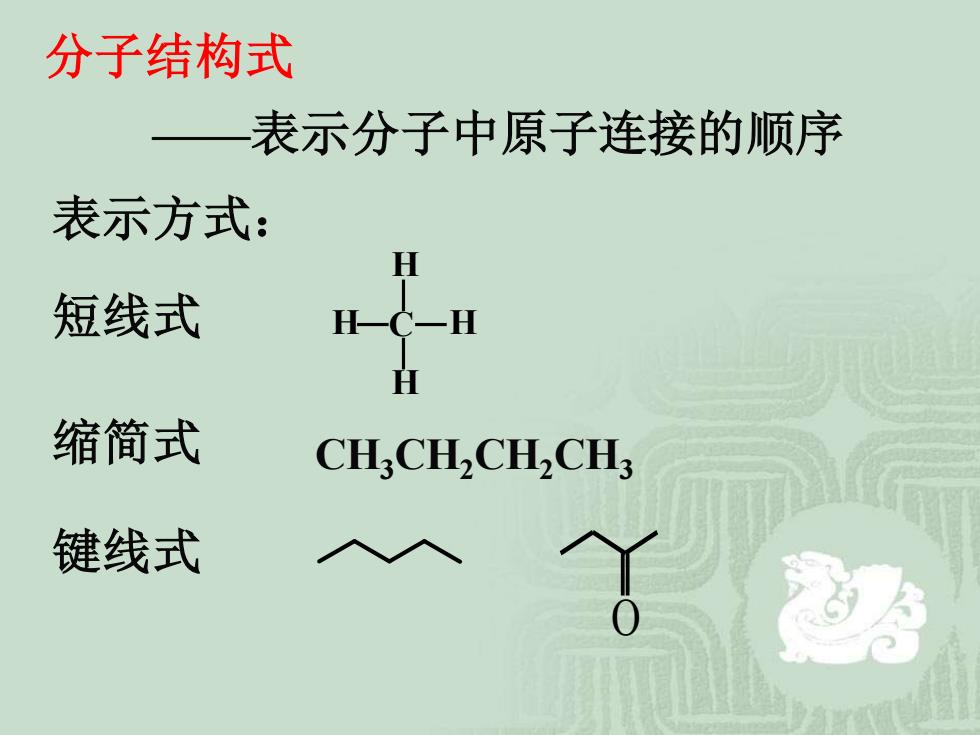
分子结构式 表示分子中原子连接的顺序 表示方式: H 短线式 H-C一H 缩简式 CH. I,CH.CH3 键线式
分子结构式 ——表示分子中原子连接的顺序 表示方式: 短线式 缩简式 键线式 CH3CH2CH2CH3 C H H H H O

1.4共价键 有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合 1.4.1共价键的形成 离子键的形成: 一个或更多的电子从一个原子转移到 另一个原子形成离子时产生的键。 它是带有相反电荷的质体间的吸引力。 Na汽)->Na气)+e Cl气)+e- C气) Na气)+ Cl气)NaCl气
1.4 共价键 有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合 1.4.1 共价键的形成 离子键的形成: 一个或更多的电子从一个原子转移到 另一个原子形成离子时产生的键。 它是带有相反电荷的质体间的吸引力。 Na (气 ) Na(气 ) + e Cl(气 ) + e Cl(气 ) Na (气 ) + Cl(气 ) Na Cl(气 )
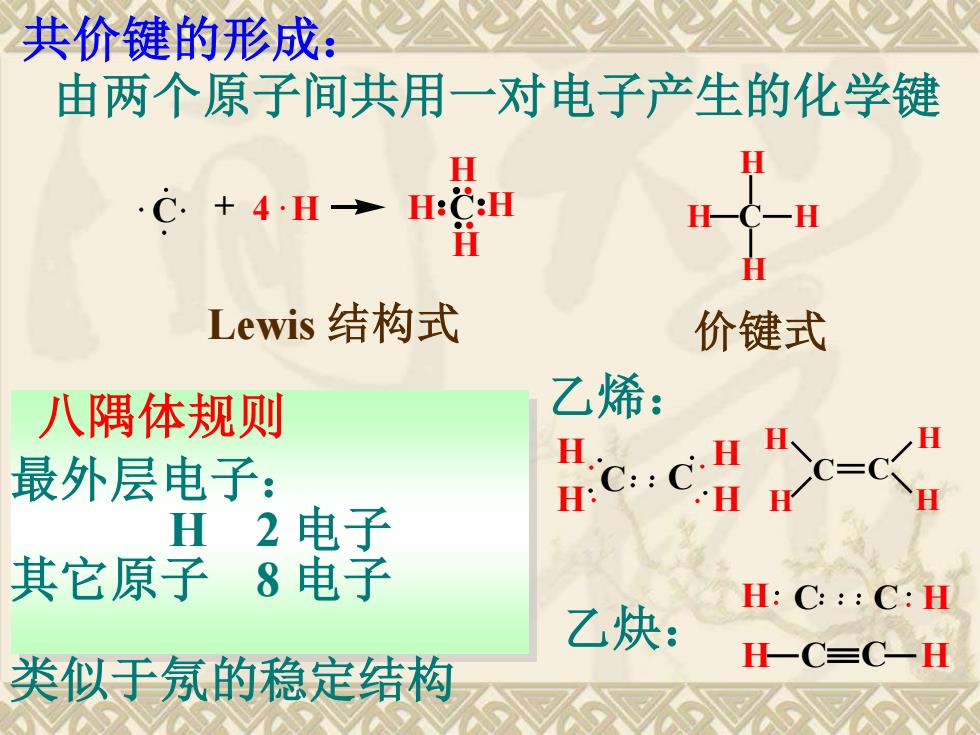
共价键的形成: 由两个原子间共用一对电子产生的化学键 H H C.+4.H-H:C:H 一C-H H Lewis结构式 价键式 八隅体规则 乙烯: 最外层电子: H2电子 其它原子8电子 H:C:::C:H 乙炔: 一CC一H 类似手氖的稳定结构
共价键的形成: 由两个原子间共用一对电子产生的化学键 C + 4 H C H H H H H C H H H Lewis 结构式 价键式 八隅体规则 最外层电子: H 2 电子 其它原子 8 电子 类似于氖的稳定结构 乙烯: C H H C H H C C H H H H 乙炔: H C C H H C C H
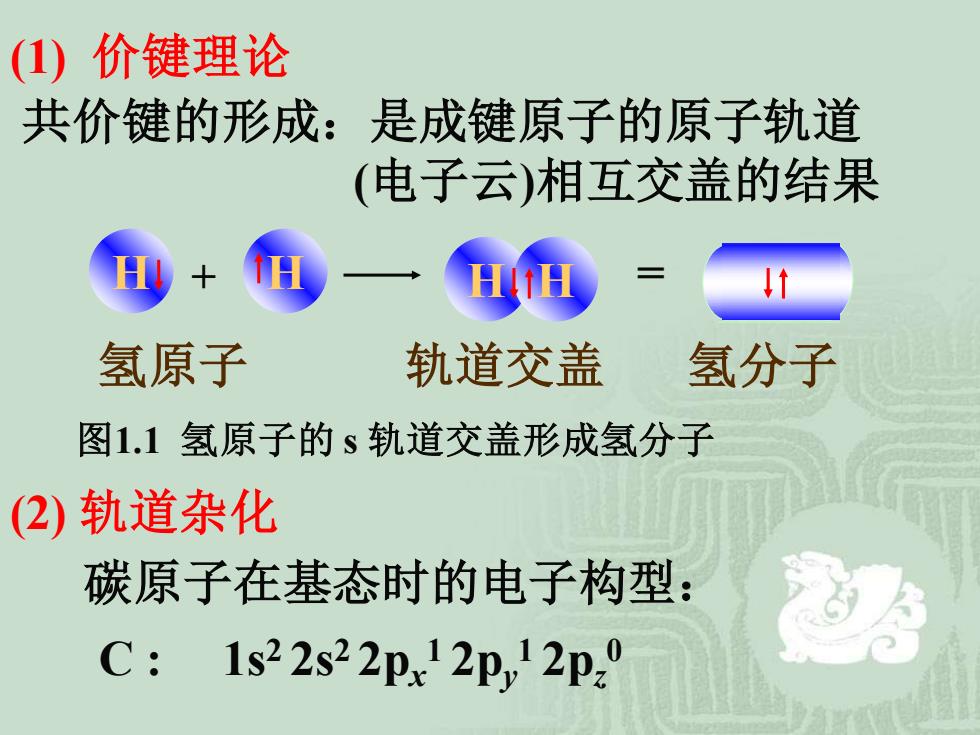
(1)价键理论 共价键的形成:是成键原子的原子轨道 (电子云)相互交盖的结果 氢原子 轨道交盖 氢分子 图1.1氢原子的s轨道交盖形成氢分子 (2)轨道杂化 碳原子在基态时的电子构型: C: 1s22s22px2p,12p
(1) 价键理论 共价键的形成:是成键原子的原子轨道 (电子云)相互交盖的结果 (2) 轨道杂化 C : 1s2 2s2 2px 1 2py 1 2pz 0 碳原子在基态时的电子构型: H + H H H = 氢原子 轨道交盖 氢分子 图1.1 氢原子的 s 轨道交盖形成氢分子
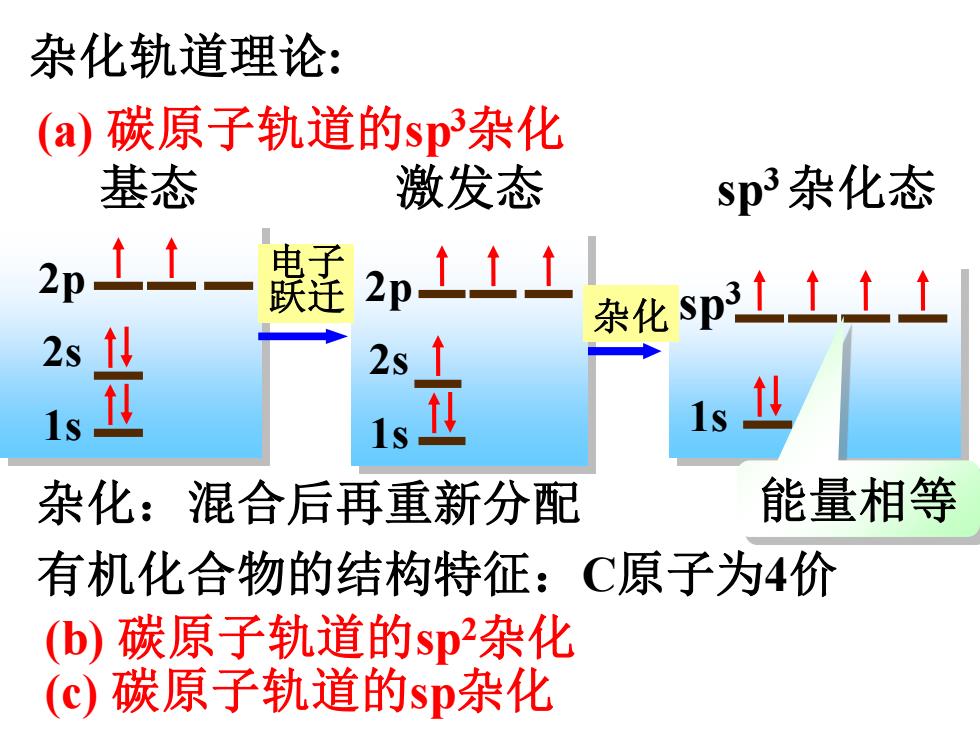
杂化轨道理论: (a)碳原子轨道的sp杂化 基态 激发态 sp3杂化态 2p11- 2pt11 杂化sp3士t土1 2s1: 1s Is 杂化:混合后再重新分配 能量相等 有机化合物的结构特征:C原子为4价 (b)碳原子轨道的sp杂化 (c)碳原子轨道的sp杂化
杂化轨道理论: 基态 2p 2s 1s 激发态 2p 2s 1s sp3 杂化态 1s sp3 杂化 杂化:混合后再重新分配 能量相等 (a) 碳原子轨道的sp3杂化 (b) 碳原子轨道的sp2杂化 (c) 碳原子轨道的sp杂化 电子 跃迁 有机化合物的结构特征:C原子为4价
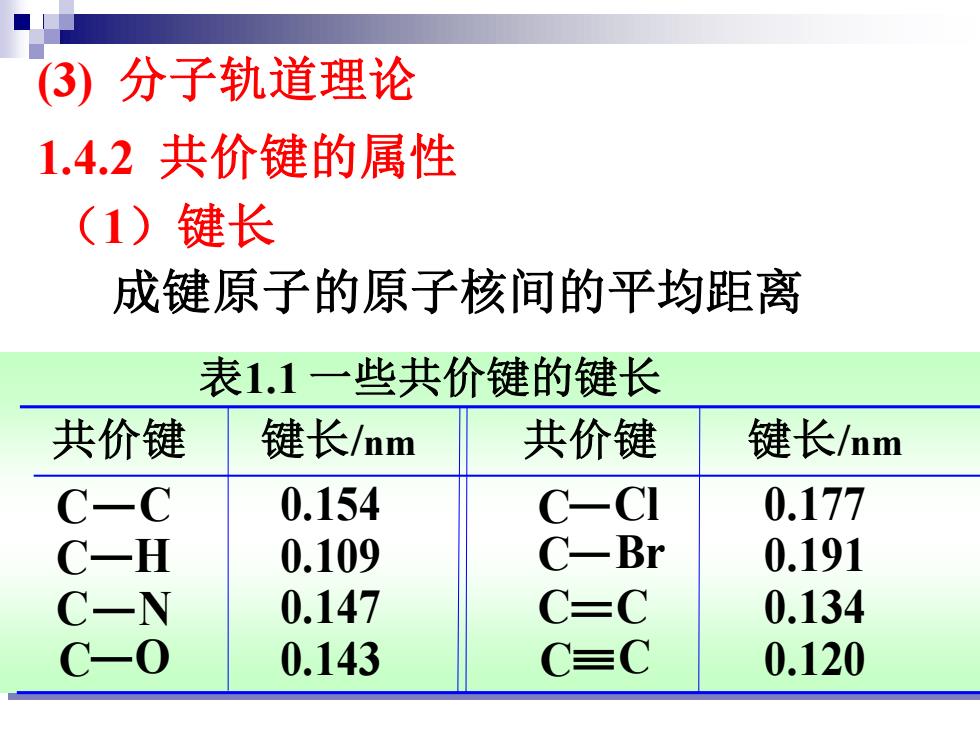
(3)分子轨道理论 1.4.2共价键的属性 (1)键长 成键原子的原子核间的平均距离 表1.1一些共价键的键长 共价键 键长/nm 共价键 键长/nm -C 0.154 C-CI 0.177 一H 0.109 C一Br 0.191 -N 0.147 C-C 0.134 -0 0.143 C=C 0.120
共价键 键长/nm 共价键 键长/nm C C C H C N C O 0.154 0.109 0.147 0.143 C Cl C Br C C C C 0.177 0.191 0.134 0.120 表1.1 一些共价键的键长 成键原子的原子核间的平均距离 (3) 分子轨道理论 1.4.2 共价键的属性 (1)键长