
第三章蛋白质 第一节概述 第二节氨基酸 第三节蛋白质的一级结构 第四节蛋自质的空间结构与功能 第五节蛋白质的重要理化性质 第六节蛋白质相对分子量的测定 本课件由西华大学生物工程学院车振明制作
第三章 蛋白质 第一节 概述 第二节 氨基酸 第三节 蛋白质的一级结构 第四节 蛋白质的空间结构与功能 第五节 蛋白质的重要理化性质 第六节 蛋白质相对分子量的测定 本课件由西华大学生物工程学院车振明制作

第一节概述 一、蛋白质的概念 二、蛋白质的研究简史 三、蛋白质的化学组成 四、蛋白质的分类 五、蛋白质的分布 六、蛋白质的生物学功能
第一节 概述 一、蛋白质的概念 二、蛋白质的研究简史 三、蛋白质的化学组成 四、蛋白质的分类 五、蛋白质的分布 六、蛋白质的生物学功能

蛋白质的概念:蛋白质是一切生物体 中善遍存在的,由天然氨基酸通过 肽健连接而成的生物大分子;其种 类繁多,各具有一定的相对分子质 量、复杂的分子结构和特定的生物 功能,是表达生物遗传性状的一类 主要物质
蛋白质的概念:蛋白质是一切生物体 中普遍存在的,由天然氨基酸通过 肽键连接而成的生物大分子;其种 类繁多,各具有—定的相对分子质 量、复杂的分子结构和特定的生物 功能,是表达生物遗传性状的一类 主要物质

1838年Auller班空了血法朵法 多1960年Anfinsen证明蛋白质的一级 结构决定其立体结构。 81980年代蛋白质工程的兴起。 冬1997年提出蛋白组学研究的概念。 必1999年蛋白质芯片技术出现。 出肽键理论。 1924年Svedberg发明超离心机
❖1838年 Muller研究了血清、蛋清、 蚕丝等物质的元素组成后, 发现它们 均可以用C40H62N10O12 来表示, 命名 为“Protein” ,并发展成 “基团” 学 说 。 ❖19世纪末 从蛋白质水解产物分离得 到了13种氨基酸, 基团学说销声匿迹。 ❖1902年 Fischer, Hofmeister同时提 出肽键理论。 ❖1924年 Svedberg 发明超离心机。 ❖1930年代 Bergmann合成出只含L型 氨基酸的多肽。 ❖1950年Pauling提出蛋白质的二级 结构的基本单位:α-螺旋和β-折叠。 ❖1953年Sanger确定了牛胰岛素的一 级结构。 ❖1958年 Perutz & Kendrew用X光衍 射法确定了肌红蛋白的立体结构 ❖1960年 Anfinsen证明蛋白质的一级 结构决定其立体结构。 ❖1980年代 蛋白质工程的兴起。 ❖1997年 提出蛋白组学研究的概念。 ❖1999年 蛋白质芯片技术出现

&1962年M.F.Perutz/J.C.Kendrew(英, 化)X射线确定蛋白质的立体结构 0 1972年G.M.Edelman/R.R.Porter(美, 医)抗体的化学构造与功能的解明。 1972年W.H.Stein,/S.More(美,4化) RNase的一级结构和活性中心的解明。 1972年C.B.Anfinsen(美,化)蛋白 质的一级结构决定其立体结构。 1998年S.B.Prusiner(美,医)Prion:蛋 白立体机构的变化导致疾病
对蛋白质化学有突出贡献的Nobel奖 获得者: •1902年 H.E.Fischer (德,化) 肽键理 论,多肽合成。 •1910年 A.Kossel (德,医) 组氨酸、 组蛋白的发现,碱基的发现。 •1915年 W.H.Bragg/W.L.Bragg (德, 物) 用X射线测定晶体物质结构。 •1926年 T.Svedberg (瑞,化) 用超离 心手段决定蛋白质的分子量。 ❖1946年 J.B.Summer (美,化) 蛋白质 酶的结晶,证明酶的本质为Pr。 ❖1948年 A.W.K.Tiselius (瑞,化) 电泳 装置的开发,血清蛋白的研究。 ❖1952年 A.J.P.Martin/R.L.M.Synge (英, 化)分配层析发明,氨基酸的分离。 ❖1954年 L.Pauling (美,化) 蛋白质二 级结构,抗原抗体反应理论。 ❖1958年 F.Sanger (英,化) 胰岛素一级 结构的测定。 ❖1962年 M.F.Perutz/J.C.Kendrew (英, 化) X射线确定蛋白质的立体结构 。 ❖1972年 G.M.Edelman/R.R.Porter (美, 医)抗体的化学构造与功能的解明。 ❖1972年 W.H.Stein/S.More (美,化) RNase的一级结构和活性中心的解明。 ❖1972年 C.B.Anfinsen (美,化) 蛋白 质的一级结构决定其立体结构。 ❖1998年 S.B.Prusiner (美,医) Prion:蛋 白立体机构的变化导致疾病
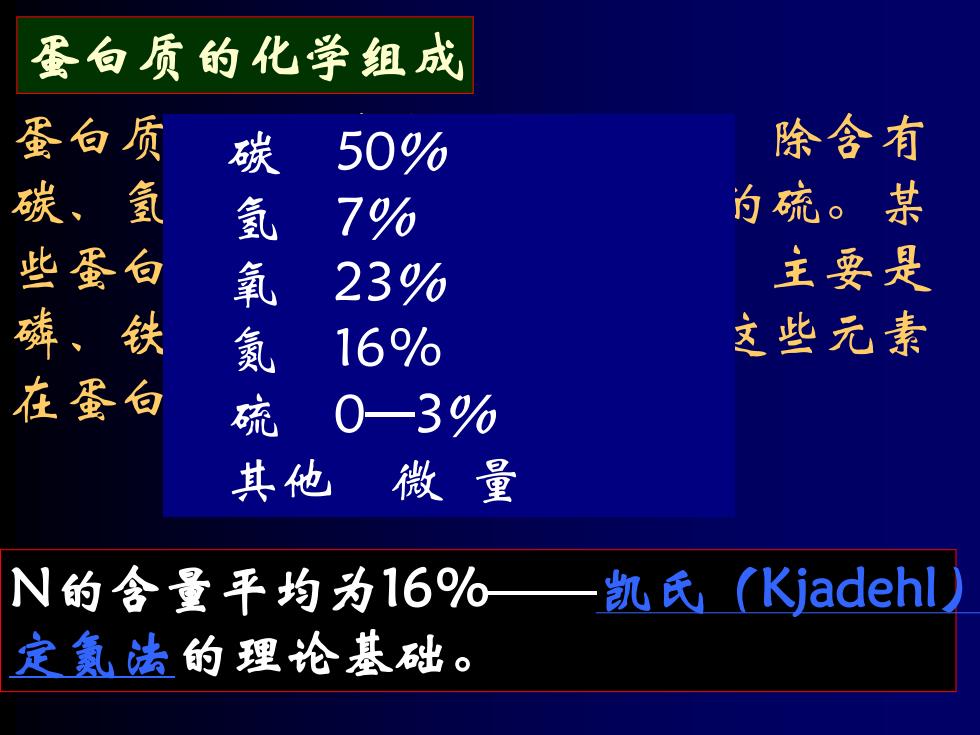
蛋白质的化学组成 蛋白质 碳 50% 除含有 氢 氩 7% 为硫。某 蛋 氧 239% 主要是 氨 16% 这些元素 0—3% 其他 微量 N的含量平均为16% 凯氏(Kjadehl 定氮法的理论基础
蛋白质的化学组成 蛋白质是一类含氮有机化合物,除含有 碳、氢、氧外,还有氮和少量的硫。某 些蛋白质还含有其他一些元素,主要是 磷、铁、碘、碘、锌和铜等。这些元素 在蛋白质中的组成百分比约为: 碳 50% 氢 7% 氧 23% 氮 16% 硫 0—3% 其他 微 量 N的含量平均为16%——凯氏(Kjadehl) 定氮法的理论基础

蛋白质含量的测定: 凯氏定氮法 (测定氨的经典方法) 优点:对原料无选择性,仪器简单, 方法也简单; 缺点:易将无机氨(如核酸中的氮) 都归入蛋白质中,不精确。 一般,样品含氨量平均在16%,取其倒 数100/16=6.25,即为蛋白质换算系数,其 含义是样品中每存在1g元素氨,就说明合有 6.25g蛋白质);故:※蛋白质含量=氮 的量×100/16×6.25
蛋白质含量的测定: 凯氏定氮法 (测定氮的经典方法) 优点:对原料无选择性,仪器简单, 方法也简单; 缺点:易将无机氮(如核酸中的氮) 都归入蛋白质中,不精确。 一般,样品含氮量平均在16%,取其倒 数100/16=6.25,即为蛋白质换算系数,其 含义是样品中每存在1g元素氮,就说明含有 6.25g 蛋白质);故: ※ 蛋白质含量=氮 的量×100/16×6.25

活性蛋白质分类 1.酶类(占细胞内蛋白质种类的绝大部分); 2.运输蛋白; 3.收缩运动蛋白; 4.激素蛋白; 5.细胞激动素; 6.受体蛋白; 7.毒素蛋白; 8.营养贮藏蛋白; 9.防御蛋白等
蛋白质的分类 1.按照分子组成分类 单纯蛋白质:水解产物只有氨基酸。 结合蛋白质:水解产物中除了氨基 酸外,还有金属离子和其它物质(辅 基)。结合蛋白根据其辅基的不同有 好多种。 一种单纯蛋白质只能与特定的一种 或几种辅基结合。 2.按照分子形状分类 球状蛋白:分子近似球形或卵圆形, 易溶解,能结晶。 纤维状蛋白:分子纤维状,不对称。 大多数不溶于水。 3.按照生物功能分类 活性蛋白质:参与代谢反应的蛋白 质。 非活性蛋白质:对生物体起保护和 支持作用的蛋白质。 活性蛋白质分类 1. 酶类(占细胞内蛋白质种类的绝大部分); 2. 运输蛋白; 3. 收缩运动蛋白; 4. 激素蛋白; 5. 细胞激动素; 6. 受体蛋白; 7. 毒素蛋白; 8. 营养贮藏蛋白; 9. 防御蛋白等
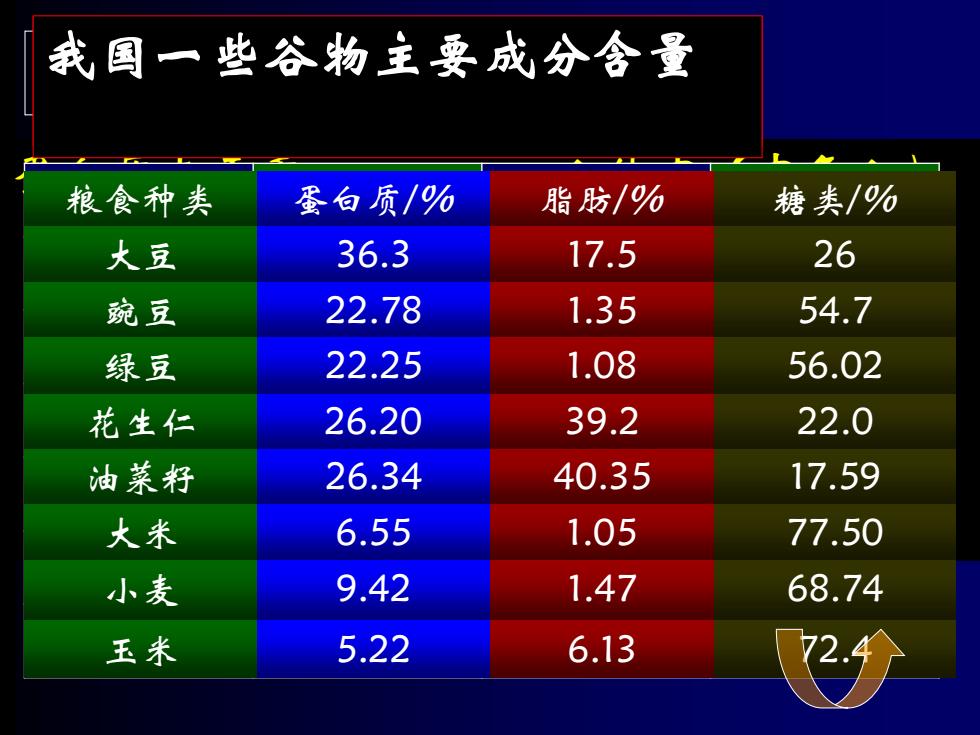
我国一些谷物主要成分含量 粮食种类 蛋白质/% 脂肪/% 糖类/% 大豆 36.3 17.5 26 豌豆 22.78 1.35 54.7 绿豆 22.25 1.08 56.02 花生仁 26.20 39.2 22.0 油菜籽 26.34 40.35 17.59 大米 6.55 1.05 77.50 小麦 9.42 1.47 68.74 玉米 5.22 6.13
蛋白质占干重 人体中(中年人) 人体 45% 水55% 细菌 50%~80% 蛋白质19% 真菌 14%~52% 脂肪19% 酵母菌 14%~50% 糖类<1% 白地菌50% 无机盐7% 植物:主要在种子中含量较高。 蛋白质的分布 人体各组织器官中蛋白质含量 (蛋白质g / 100g干组织) 器官或组织 蛋白质含量 器官或组织 蛋白质含量 体液 85 心 60 脾 84 肝 57 肺 82 胰 47 横纹肌 80 脑神经 45 肾 72 骨骼 28 消化道 63 脂肪组织 14 我国一些谷物主要成分含量 粮食种类 蛋白质/% 脂肪/% 糖类/% 大豆 36.3 17.5 26 豌豆 22.78 1.35 54.7 绿豆 22.25 1.08 56.02 花生仁 26.20 39.2 22.0 油菜籽 26.34 40.35 17.59 大米 6.55 1.05 77.50 小麦 9.42 1.47 68.74 玉米 5.22 6.13 72.4

蛋白质的生物学功能 1.生物体的组成成分 结构蛋白 2.催化 酶蛋白 3. 运输 4. 运动 5. 抗体 免疫球蛋白 0 龙素 7.遗传信息的控制 8.细胞膜的通透性 9.高等动物的记忆、识别机构
蛋白质的生物学功能 1.生物体的组成成分 2. 催化 3. 运输 4. 运动 5. 抗体 6. 干扰素 7. 遗传信息的控制 8. 细胞膜的通透性 9. 高等动物的记忆、识别机构 酶蛋白 结构蛋白 免疫球蛋白