
第十一章化学动力学
第十一章 化学动力学

化学热力学的研究对象和局限性 研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: △,G/kJ.mol1- N+,一NI,g -16.63 H2+5O2→H2O -237.19 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答
研究化学变化的方向、能达到的最大限度以及 外界条件对平衡的影响。化学热力学只能预测反应 的可能性,但无法预料反应能否发生?反应的速率 如何?反应的机理如何?例如: 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + ⎯⎯→ + ⎯⎯→ 1 r m / kJ mol 16.63 237.19 G − − − $ 热力学只能判断这两个反应都能发生,但如何使它发 生,热力学无法回答。 化学热力学的研究对象和局限性

化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 例如: 动力学认为: 1 N2+ 3 H2→NH,(g)需一定的T,p和催化剂 2 502→H200) 点火,加温或催化剂
化学动力学研究化学反应的速率和反应的机理以及 温度、压力、催化剂、溶剂和光照等外界因素对反应 速率的影响,把热力学的反应可能性变为现实性。 化学动力学的研究对象 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + → + → 例如: 动力学认为: 需一定的T,p和催化剂 点火,加温或催化剂

热力学:研究过程的可能性 动力学:研究过程的现实性 热力学不考虑时间因素,所以热力学上 可以发生的过程只是现实可能发生的过 程,不是必然发生的。比如一个化学反 应的摩尔反应吉布斯函数变尽管为负, 但由于反应阻力很大,有可能实际上并 不发生,因而必须研究动力学问题,即 过程发生的速度问题 但热力学上不能发生的过程,在现实中 肯定是不能发生的
• 热力学:研究过程的可能性 • 动力学:研究过程的现实性 • 热力学不考虑时间因素,所以热力学上 可以发生的过程只是现实可能发生的过 程,不是必然发生的。比如一个化学反 应的摩尔反应吉布斯函数变尽管为负, 但由于反应阻力很大,有可能实际上并 不发生,因而必须研究动力学问题,即 过程发生的速度问题。 • 但热力学上不能发生的过程,在现实中 肯定是不能发生的

化学动力学发展简史 1848年 dInk van't Hoff dlnK。△Us Ea k 提出: dT RT2 dT RT2 K。 kip 1891年 Arrhenius k=Aexp( RT 设E,为与T无关的常数 1935年Eyring?等提出过渡态理论 1960年交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖
•1848年 van’t Hoff 提出: 2 c a 2 d ln d ln d d K k E T RT T T U R = = $ b f c k k K = •1891年 Arrhenius a exp( ) E k A RT = − 设 Ea 为与T无关的常数 •1935年 Eyring等提出过渡态理论 •1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 化学动力学发展简史

§11.1化学反应的反应速率及速率方程
§11.1 化学反应的反应速率及速率方程

1.反应速率的定义 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量,无方向性,都是正值。 例如: R→P 速度 d[R] o dt dt 速率 -dR]_ d[P] >0 dr dt
1.反应速率的定义 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量 ,无方向性,都是正值。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t − 速率 = 例如: R P ⎯⎯→
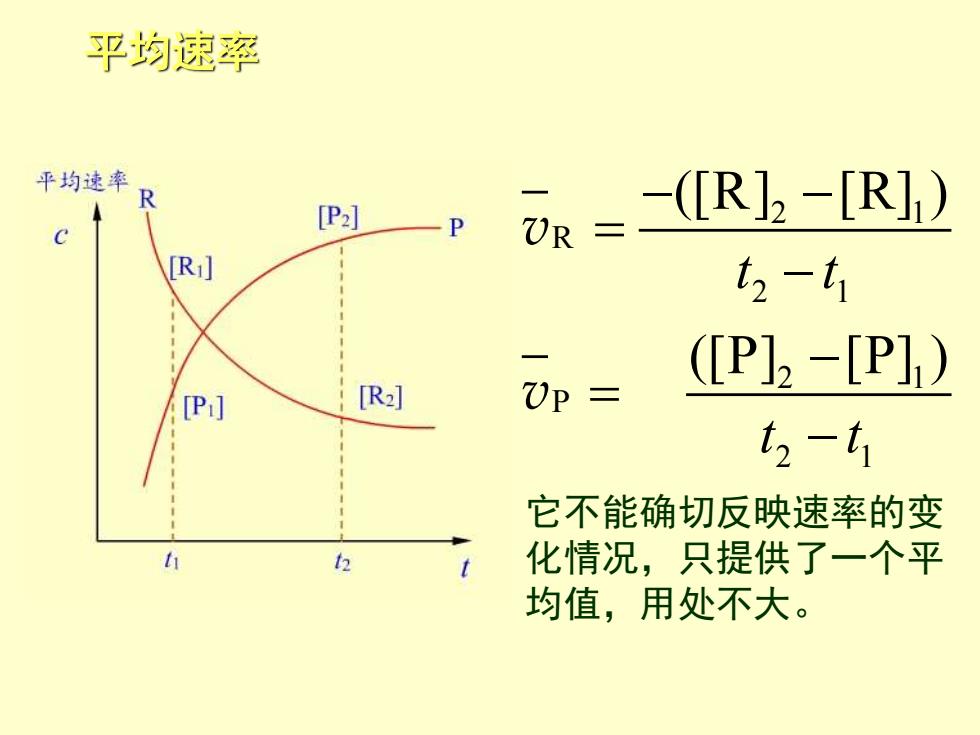
平均速率 平均速率 [P2] -(R]2-[R]1) UR= R t2-t1 (P]2-[P]) [P:] [R] )P= t2-t1 它不能确切反映速率的变 h 2 t 化情况,只提供了一个平 均值,用处不大
平均速率 2 1 R 2 1 2 1 P 2 1 ([R] [R] ) ([P] [P] ) t t t t − − = − − = − v v 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大
平均速率 平均速率 R [P2] P [R] [P:] [R2] 1
平均速率
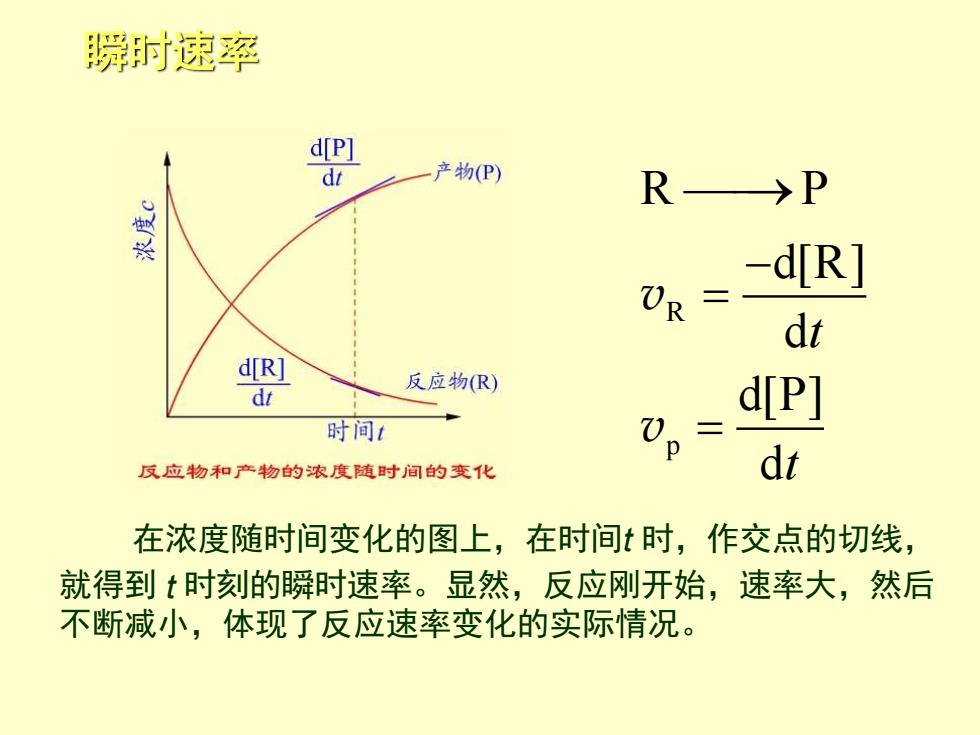
瞬时速率 d[P] dt 产物(P) R>P d[R] UR dt d[R] 反应物(R) dt d[P] 时间1 反应物和产物的浓度随时间的变化 dt 在浓度随时间变化的图上,在时间t时,作交点的切线, 就得到t时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况
瞬时速率 R p R P d[R] d d[P] d t t ⎯⎯→ − = = v v 在浓度随时间变化的图上,在时间t 时,作交点的切线, 就得到 t 时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况