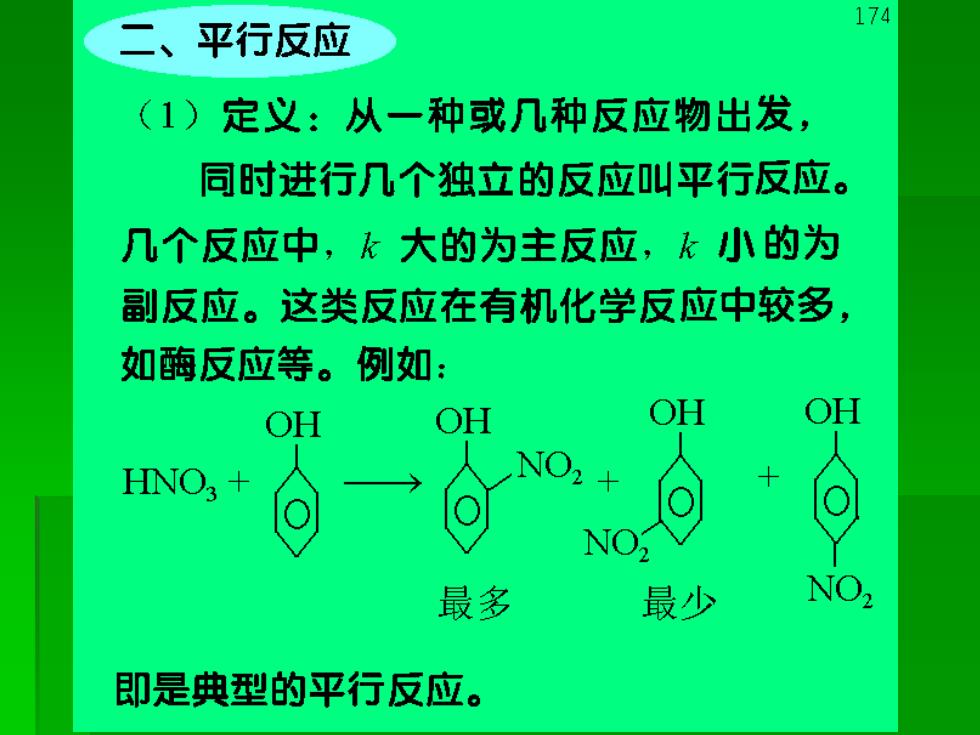
二、平行反应 174 (1)定义:从一种或几种反应物出发, 同时进行几个独立的反应叫平行反应。 几个反应中,k大的为主反应,k小的为 副反应。这类反应在有机化学反应中较多, 如酶反应等。例如: OH OH OH OH 最多 最少 NO, 即是典型的平行反应

75 (2)最简单的平行反应 一两个一 级基元反应 组成的平行反应 kB A B t=0 a 0 0 C t=t X y Z 速率方程: -(1 dy 1 dt -(), dz dt 总反应: 盛=-(),-(),=r+=(k+)x dx dt =kx,k=k+名为表观速率常数

176 积分:-变=0kd,血音=-kt x=ae4=ae-(+k)t 架=kx=a。 dy=后ae+td y=- 同理 kza Z- k1十 (1-e6+) 或者 z=a-x-y

177 (3)说明: 反应过程中两种产物的速率之比、 两种产物的数量之比都保持恒定, 与a,t无关。 dy dt k dz kx dt 在这种级数相同的反应中,两种产物的速 率、浓度、产量的比值都为一个常数冬· 不论反应进行到和种程度

178 根据动力学方程可求出k=%1+2 两种产物的浓度比,÷名 k 可求出无1、k2。 也可求出表观活化能E d In E dT RT2 d In ( E=RT2 RT2 dT dT

179 RT2d(k+名2) E=k+k2 dT d In k +] 点+」 k1E1+2E2 k1+k2 平行反应中的表观活化能与各反应的 活化能E,和E2有关但不等于二者之和

80 ③三种物质的浓度x、y、z与t关系曲线 (4)如何控制平行反应 若想改变产物的比例, 只有改变k1,2,方法是: )改变催化剂以便改变反应机理; )改变T使,发生不同程度的变化

181 现在只讨论T的影响 E E2-E e i RT E2 A,e 由于指前因子随T变化不大,只讨论 指数项的影响(极大)。 若△E=E2·E1>0 T个,↓.文, 对生成C有利 E2-E T↓,e↑个,〤个,对生成B有利

182 T个对活化能大的反应有利,T↓对活化能小的 反应有利;若△E≈0,改变T变化不明显, 这时只能寻找合适的催化剂,使其中一个反应 的活化能降低,以便改变产物的比值。也就是 使用选择性好的催化剂。 三、连续(串)反应 (1) 定义:是一连串接续进行的反应,反应 是由几种反应物构成的,第一个反应的产物是 第二个反应的反应物,第二产物为第三个反 应的反应物

183 (2)最简单的连串反应(由两个反应构成) t=0 a 0 0 t=t y Z dCA dx dt dt =k1X d dy dt dt =kix-k2 y .② 光 求动力学方程。 x+y+z=a dt +=0 dt 表示三个方程中有两个是独立的