
001 第八章 电化学 绪言: 1. 研究对象:研究电现象与化学现象之间的内在联系 以及电能与化学能之间转换规律的一门科学。 研究装置:电池,又可分为: 原电池:化学能→电能,通过自动发生的化学反 应向外输送电能,如干电池、蓄电池。 电解池:电能→ 化学能,输入电能使之发生化学 变化,如蓄电池充电、电解冶炼等。 最早在1799年,Volta(伏打)电池获得了直流电, 后来人们又实现了其逆过程,把直流电通入电解质溶 液,即电解。 1870年后发明了直流发电机,获得了比较廉价的直 流电,大量研究了电能转化成化学能的工作,电解法广 泛应用于工业生产中

002 2.本章内容: 一、电解质溶液理论:研究电解质溶液的性质,导电机 理,是电化学的基础。 二、电化学平衡:做电功情况下的化学平衡问题,如可 逆电极,可逆电池,电动势等,为本章的重点。 三、不可逆电极过程(电极过程动力学):电极过程是指, 当电流通过电极/溶液界面时,引起一系列变化的 过程。在界面上有电子导体和离子导体之间的电荷 接力传递。内容包括电解,腐蚀等,与应用密切相 关

003 3.作用与应用: 电化学应用于国民经济的各个领域,与生产,生活, 实验密切相关。 ①电冶金:许多有色和稀有金属的提炼和精制需用电解法: 如Li,Na,K,Mg,Al等金属的冶炼,Cu,Pb,Zn的精炼。 ②腐蚀和防腐:许多金属生锈腐蚀的原因与电化学有关, 可利用电化学的原理和方法来防腐。 ③电化学分析:电位(导)滴定,库仑分析,级谱分析, 电位扫描伏安法,循环伏安法等。 ④化学电源:可大大提高能量利用率,方便使用,如电池。 热电法:效率仅40%;燃料电池:能量利用率可达80%
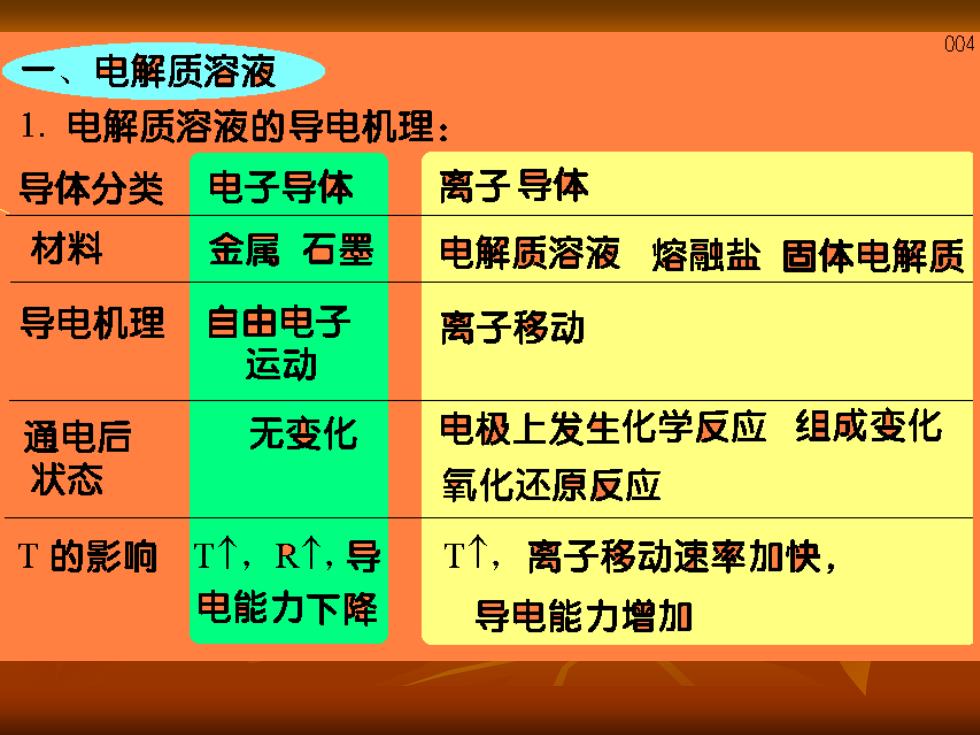
004 一、电解质溶液 1.电解质溶液的导电机理: 导体分类 电子导体 离子导体 材料 金属石墨 电解质溶液 熔融盐固体电解质 导电机理 自由电子 离子移动 运动 通电后 无变化 电极上发生化学反应组成变化 状态 氧化还原反应 T的影响 T个,R↑,导 T个,离子移动速率加快, 电能力下降 导电能力增加
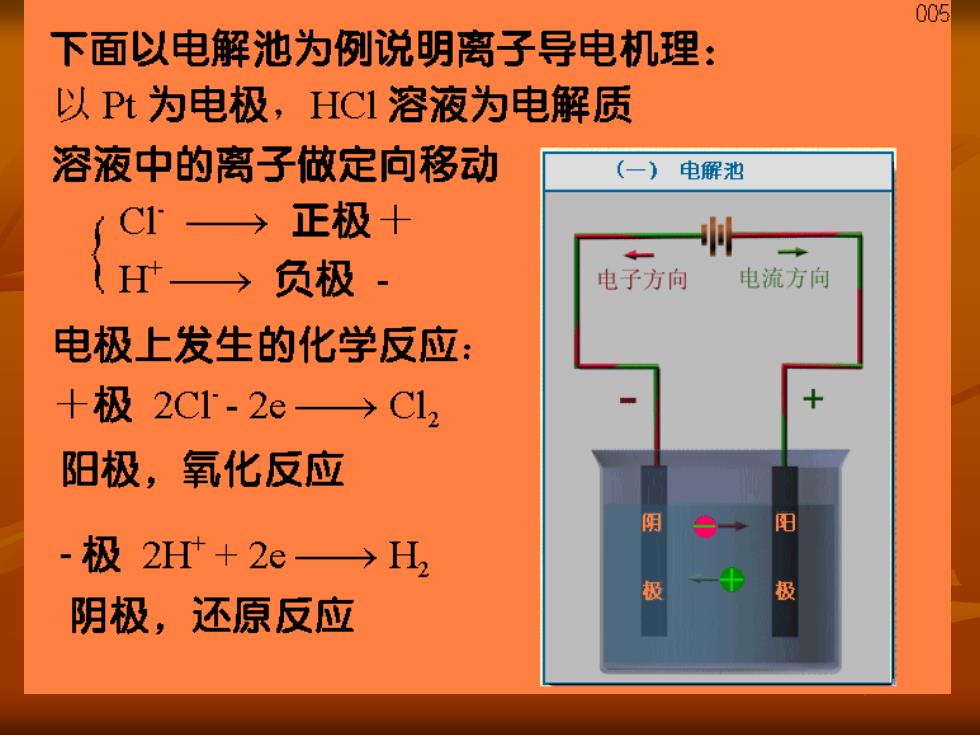
005 下面以电解池为例说明离子导电机理: 以Pt为电极,HC1溶液为电解质 溶液中的离子做定向移动 (一) 电解池 C1→正极十 →负极 电子方向 电流方向 电极上发生的化学反应: +极2C1-2e→C12 阳极,氧化反应 阳 -极2H+2e→H, 极 极 阴极,还原反应
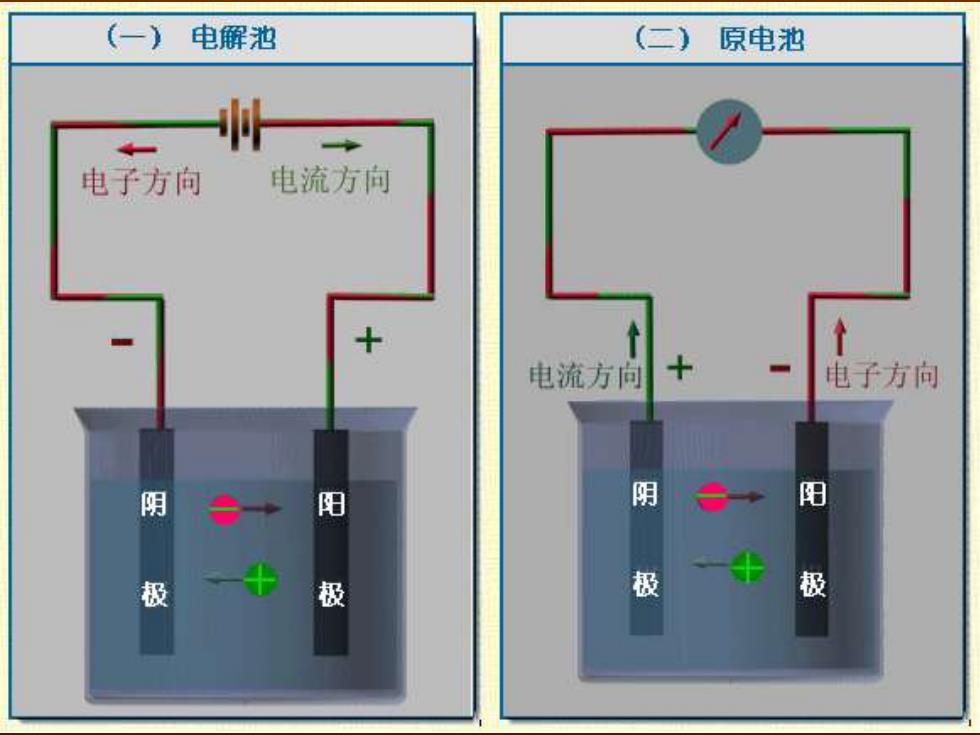
(一)电解池 (二) 原电池 电子方向 电流方向 个 电流方向 电子方向 阴 阳 阴 阳 极 极 极 极

006 2.Faraday定律(1833年) 电解时,在电极上发生反应的物质的数 量与通入的电量Q成正比。 例如:电极上发生如下反应 A++Z,e→A 则有:Q= 费ZF=n☑,R式中 Q:通入的电量(库仑) m:电极上发生反应的物质的质量 M:该物质的摩尔质量 乙:电极反应中电子的计量系数 n:电极上发生反应的量 F:1摩尔电子的电荷,称作Faraday 常数 F=N,e=6.022×105mo1×1.602×1019C =96484.6C.mol≈96500C.mo 上式表示,有1摩尔物质在电极上反应, 需要通过ZN。个电子,即通过的电量为ZF 以上公式无任何限制条件,对电池、电解 池均适用

007 $8.1溶液的电导 (一)电导定义 G- R员全=水全= ①:电阻率:单位长度,单位截面积导体的电阻; 则R= 承大 L:导线长度,与电阻成正比: A:导体的截面积,与电阻成反比。 ②量纲:21(欧姻)一西门子,用S表示, 1西门子=1安培.伏特1 ③对电解质溶液,L:两电极间的距离 A:电极的面积 ④G测定方便 一用惠斯通交流电桥直接测定, 但因为它不是特征量,使用时不方便。它与电池, 电解池的电极面积及两电极间的距离有关,也 与溶液的种类及浓度有关

008 二)电导率(比电导)K 单位面积(1m),单位长度(1m)导体的电导。 0=员=G大 K为边长1m的立方体的电解质溶液的电导, 单位是:2m1(西门子.米-1或S.m)。 ②K与几何因素L,A无关(指定边长1米),但还与电 解质性质,C,T有关(一般T个,k个)。对于强电 解质,由于浓度增加时离子数增加,故开始时C个, K个,C达到一定程度后正负离子之间的相互作用增加 使电导率下降。弱电解质K随C变化不大
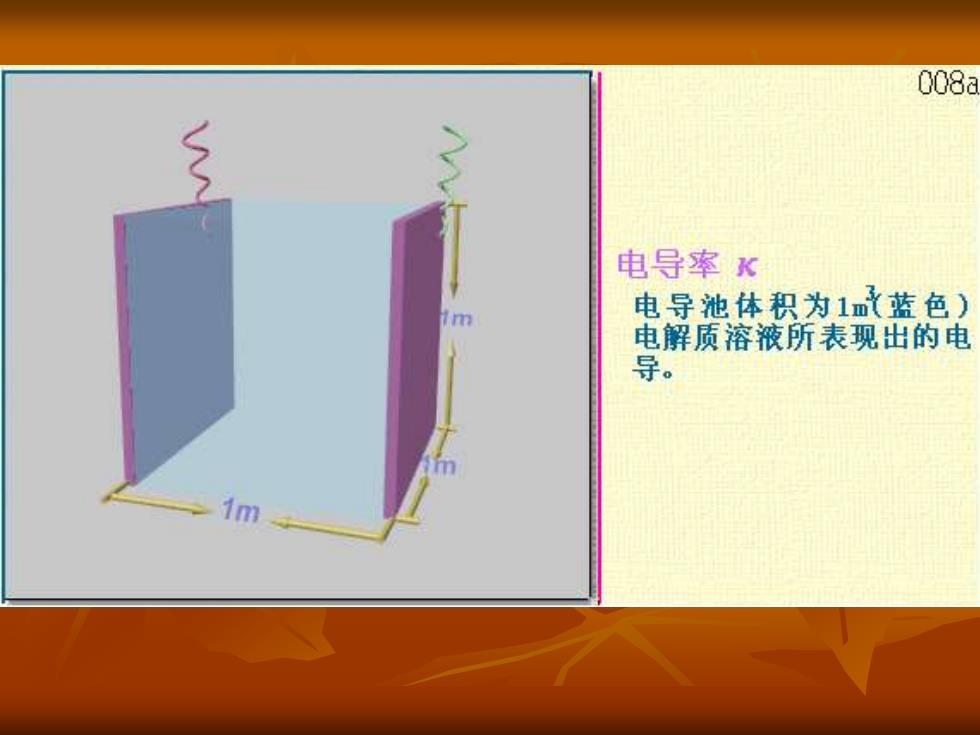
008a 电导率 电导池体积为1m蓝色) 电解质溶液所表现出的电 导