
050 §8.7电解质溶液的活度 活度概念是在热力学中引入的,用于讨论非理想溶液 的性质。 理想体系:u;=ug+RTln (8,Ci.) 非理想体系:u;=u+RT In a;, a= Yi m 对于电解质溶液,由于溶液中有正负离子,互相间有 库仑作用力(f©∝),使电解质溶液对理想溶液有偏差, 为了保留化学势公式的形式,也用活度进行校正,即 =+RT In a, a为电解质活度

05] 因为溶液中有正负离子,各自都有自己的化学势: u+RT In a, Y+ m u-=ue +RT In a, a_=Y m 以上二式仅限于理论推导,因为a+、a-、Y+、Y 都是无法测量的。 (因为正负离子总是同时出现,实验只能测出它们 共同作用的平均结果) 为使活度可以测量,有实用价值,引入±,a±, 此二值不仅可测,还可以通过理论计算获得

052 (一)离子的平均活度a+,平均活度系数y±(几何平均) (I)a与a、a_的关系: 设n摩尔强电解质,溶于n摩尔的溶剂中,全部电 离,即 MvAy.V:MZ++v.Az. 体系中有三种物质:溶剂、2+、A2, { n+三v+n n.=v.n 若体系发生一个微变,其自由能变化为: dG=-Sdr+VdP+Σμidn

053 等T,P条件下: dG=Σuidn;=μsdh。+μ+dn4+μ.dh us dns+(V+v.u.dn 若溶剂n。保持不变 aG dG=(v+v.u.dn =V+从++V.u 工,P,ng 此式的物理意义:在等T,P及n,不变时,在无限大体系 中加入1摩尔电解质(完全电离)引起体系自由能的变 化。根据定义,它是电解质的化学势μ,或自由能随电解 质的变化率 =V+u+十V.μ T,P,ns

054 并且有: 4+=u9 +RT In a+ 4-=u9 +RT In a_ a 离子活度 u=u+RT In a a: 电解质活度 .u=u+RT In a =(vu+v.ue)+vRT In a v.RT In a. 在标态时u9=V+u♀十V.u9 有a=a+.a 其中 a+=Y+ m+ m m a m a=

(2)电解质的平均活度a+,平均活度系数Y± 055 )定义: a上=(a4,a)+v=(a,a)=a 1 Y±=(Y¥.y) m±=(m.m) =(v4 )m V=V+V. m=v m m.=v.m

056 过关系 a国a.a)=(0)”(]月 =()()] + =¥mm.(品)》 =Y±·m±· 1 m士 m
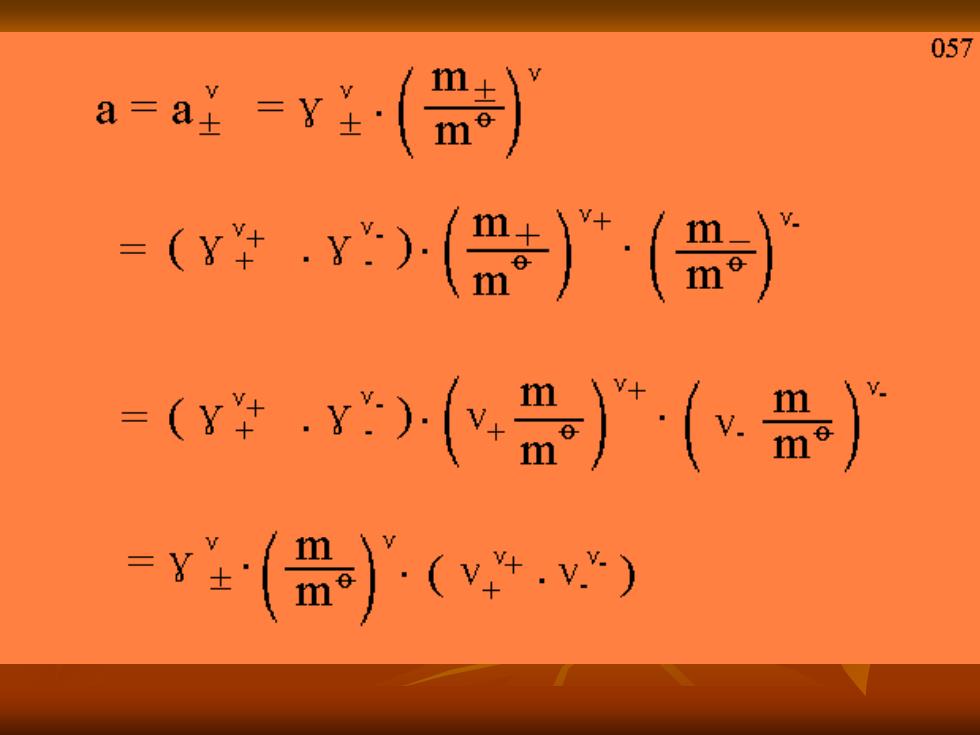
057 a=a好=y()》 =(y)()”(盘)》 =(y学.)()广() =y()(.)

058 例: H,SO→2H+SO4 m,=v+m=2m, =3 m.=v.mm, m±=(m+.m)÷-[(2m)2-ms=(4m33=418m ay±()¥44(册 a=ai=4v.( m 说明:a可由实验测定,冰点下降法、蒸汽压法、 电动势法、溶解度法等;m已知,m指定值,则 Y±可测,也可从理论上计算。Y±的大小反映了由 离子间的静电作用引的,与理想溶液的偏差程度, 也可计算:故a+可得

习题:573页 4,9,23,26
习题: 573页 4, 9, 23, 26