
理想溶液
理 想 溶 液

第四节 理想溶液 (ideal solutiom) ●一。 拉乌尔定律(Raoult'slaw: ·法国科学家于1887年发表了稀溶液溶剂的蒸汽 压与溶质量的关系的论文,认为: ·在定温下,稀溶液溶剂的蒸汽压等于此温度下 纯溶剂的蒸汽压与溶液中溶剂摩尔分数的乘积, 数学表达式为: PA-PA XA (1) ·P⅓:相同温度下纯溶荆的饱和蒸汽压. ·此规律称为拉乌尔定律(Raoult'slaw)
第四节 理想溶液 (ideal solutiom) • 一 . 拉乌尔定律(Raoult’s law): • 法国科学家于1887年发表了稀溶液溶剂的蒸汽 压与溶质量的关系的论文,认为: • 在定温下,稀溶液溶剂的蒸汽压等于此温度下 纯溶剂的蒸汽压与溶液中溶剂摩尔分数的乘积. 数学表达式为: • pA=pA * xA (1) • pA *:相同温度下纯溶剂的饱和蒸汽压. • 此规律称为拉乌尔定律(Raoult’s law)

·若溶质是非挥发性物质,溶液的蒸汽压等于溶 剂的蒸汽压,加入的溶质愈多,溶液的蒸汽压下 降得愈厉害. ·【a定律一般只适用于非电解质溶液,电解质 溶液因为存在电离现象,溶质对溶剂蒸汽压的 影响要更复杂一些。 ·应用拉乌尔定律时,溶剂的摩尔质量采用其气 态时的摩尔质量,不考虎分子缔合等因素,如 H20仍为18g.mo1
• 若溶质是非挥发性物质,溶液的蒸汽压等于溶 剂的蒸汽压,加入的溶质愈多,溶液的蒸汽压下 降得愈厉害. • Rault定律一般只适用于非电解质溶液,电解质 溶液因为存在电离现象,溶质对溶剂蒸汽压的 影响要更复杂一些. • 应用拉乌尔定律时,溶剂的摩尔质量采用其气 态时的摩尔质量,不考虑分子缔合等因素,如 H2O仍为18g.mol-1

亨利定律(Henry'slaw): ·英国科学亨利于1803年根据实验结果总 结出溶液的另一条经验定律,称为亭利 定律: ·在一定温度并达平新状态时,气态在液体 中的溶解度与该气体在气相中的分压成 正比。数学表达式为: PB=Kx XB (2) XB是溶质B在溶液中的摩尔分数;k是一比 例常数,称为亨利常数,k的值与溶质,溶剂 的性质,体系的温度,压力等因素有关
• 二. 亨利定律(Henry’s law): • 英国科学亨利于1803年根据实验结果总 结出稀溶液的另一条经验定律,称为亨利 定律: • 在一定温度并达平衡状态时,气态在液体 中的溶解度与该气体在气相中的分压成 正比.数学表达式为: • pB=kx xB (2) • xB是溶质B在溶液中的摩尔分数;kx是一比 例常数, 称为亨利常数,kx的值与溶质,溶剂 的性质,体系的温度,压力等因素有关

·拉乌尔定律所描述的是稀溶液中溶剂的 性质;亨利定律所描述的是稀溶液中溶质 的性质. ·稀溶液中溶质的浓度一毅很低,故实际上 常常用和C表示溶液的浓度,当采用不同 的浓度表示法时,亨利定律的表达式也有 所区别. ·若溶液采用质量摩尔浓度,则亨利定律的 表达式为: PB=km mB (3)
• 拉乌尔定律所描述的是稀溶液中溶剂的 性质;亨利定律所描述的是稀溶液中溶质 的性质. • 稀溶液中溶质的浓度一般很低,故实际上 常常用m和c表示溶液的浓度,当采用不同 的浓度表示法时,亨利定律的表达式也有 所区别. • 若溶液采用质量摩尔浓度, 则亨利定律的 表达式为: • pB=km mB (3)

km和k的关系: p=KxXB ● =kxng/(nA+nB) ● ≈kng/n4 当Xg→0时 ● =k MAnB/(nAMA) ● -(k MA)nE/(nAMA) =(k MA)ng/WA ● =(KMA)mB ● =kmmB ·令 km=KxMA (4)
km和kx的关系: • p=kxxB • =kxnB /(nA+nB ) • ≈ kxnB /nA 当xB→0时 • =kxMAnB /(nAMA) • =(kxMA)nB /(nAMA) • = (kxMA)nB /WA • = (kxMA)mB • =kmmB • 令 km=kxMA (4)
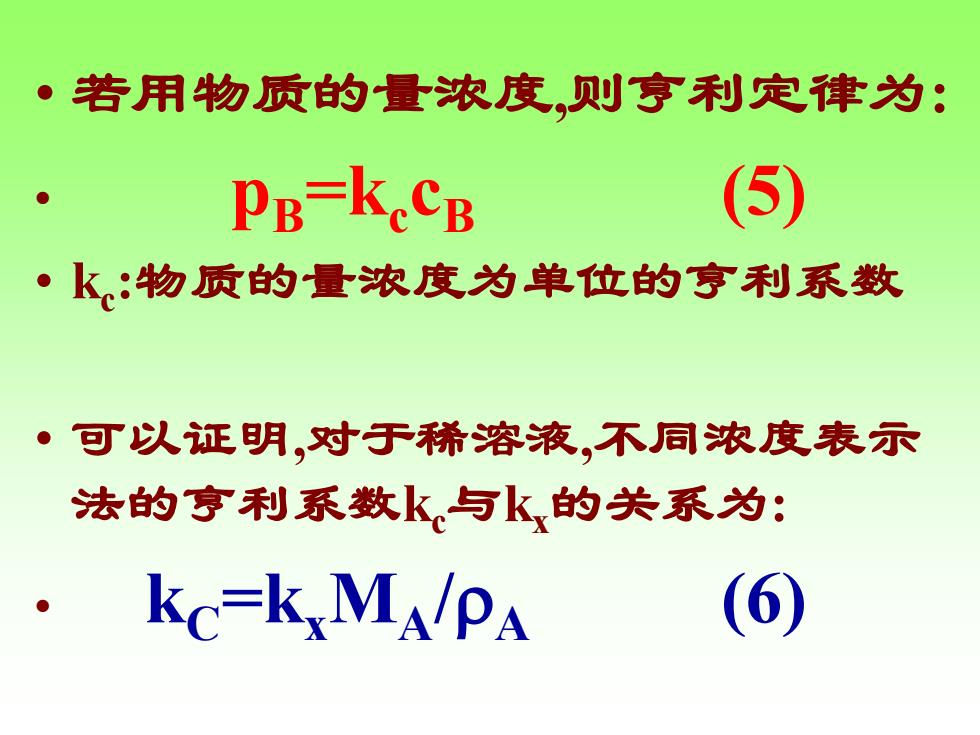
·若用物质的量浓度贝则亨利定律为: ● PB=kcCB 5 ·k:物质的量浓度为单位的亨利系数 ·可以证明,对于稀溶液,不同浓度表示 法的亨利系数k与k的关系为: KC=KXMAPA (6)
• 若用物质的量浓度,则亨利定律为: • pB=kc cB (5) • kc :物质的量浓度为单位的亨利系数 • 可以证明,对于稀溶液,不同浓度表示 法的亨利系数kc与kx的关系为: • kC=kxMA/A (6)

。亨利定律的适用范围: ·1。适用于稀溶液,浓度大时偏差较大; ·。溶质在气相和液湘中的分子形态应一 致,若两相中分子的形态不一致,则 不适用. ·如: ·HC在气相中以HC分子的形式存在,当 其溶于水溶液中后,HC将电离成H+离子 和C离子,故HC在水溶液中和气湘中的 粒子形态不相同,故亨利定律不能用于盐 酸溶液
• 亨利定律的适用范围: • 1. 适用于稀溶液, 浓度大时偏差较大; • 2. 溶质在气相和液相中的分子形态应一 致, 若两相中分子的形态不一致,则 不适用. • 如: • HCl在气相中以HCl分子的形式存在, 当 其溶于水溶液中后, HCl将电离成H+离子 和Cl-离子,故HCl在水溶液中和气相中的 粒子形态不相同, 故亨利定律不能用于盐 酸溶液

·三。理想溶液(ideal solution) ·热力学定义: 若溶液中任一组分在全部浓度范围内 (0≤x≤1)均服从拉乌尔定律,则其为 理想溶液. ·理想溶液的理论模型:满足以下条件的体系为 理想溶液以二元溶液为例): ·1.A、B分子的大小相同,形状相似: ·2.A-A:A-B:B-B分子对之间具有相 同的势能函数
• 三. 理想溶液(ideal solution) • 热力学定义: 若溶液中任一组分在全部浓度范围内 (0≦xi≦1)均服从拉乌尔定律,则其为 理想溶液. • 理想溶液的理论模型: 满足以下条件的体系为 理想溶液(以二元溶液为例): • 1. A、B分子的大小相同,形状相似; • 2. A-A;A-B;B-B分子对之间具有相 同的势能函数

● 理想溶液模型和理想气体模型的区别: ·1.理想气体分子间无作用力;理想溶液 的分子间存在作用力,但只强调分子间 的作用力相以。 ·2.理想气体要求分子的体积为零;理想 溶液不要求分子体积为零,但要求各种 分子的大小,形状相以。 ·许多实际溶液体系性质很接近理想溶液: ● 同系物混合所组成的溶液, 同分异构体所组成的溶液等
• 理想溶液模型和理想气体模型的区别: • 1. 理想气体分子间无作用力;理想溶液 的分子间存在作用力,但只强调分子间 的作用力相似。 • 2. 理想气体要求分子的体积为零;理想 溶液不要求分子体积为零,但要求各种 分子的大小,形状相似. • 许多实际溶液体系性质很接近理想溶液: • 同系物混合所组成的溶液, 同分异构体所组成的溶液等