
单组分相图
单组分相图

第二节 单组分相图 ·单组分体系只有一个物种,故此节所研究的是纯物 质的相平衡. 。单组分体系的相律为: ● f=K一Φ+2=1一Φ+2 f=3一Φ (1) Φmax=3一0=3单组分平衡体系最多能3相共存 一个纯物质可以有许多不同的相态。 ·如C:其不同的相态有:气相,液相,各种不同形态的固相:无 定形碳;石墨;金刚石;富勒烯族(C等). ·但碳的相图中最多只能三相共存,不可能四相共存
第二节 单组分相图 • 单组分体系只有一个物种, 故此节所研究的是纯物 质的相平衡. • 单组分体系的相律为: • f = K- + 2 =1 - + 2 • f =3 - (1) • max= 3-0 = 3 单组分平衡体系最多能3相共存 • 一个纯物质可以有许多不同的相态。 • 如C: 其不同的相态有:气相, 液相, 各种不同形态的固相:无 定形碳; 石墨; 金刚石; 富勒烯族(C60等). • 但碳的相图中最多只能三相共存,不可能四相共存

·一.克-克方程(Clausius-Clapeyron equation) 。 当单组分体系两相共存时,自由度3一2=1, 体系只有一个自由度。 ·单组分的相变温度与压力之间存在一定的关 系,此关系即为克-克方程. ·设一纯物质在T,p下达两相平衡: (T,p)=(T,p) 在T+dT,p+dp下仍达平衡: ue(T+dT,p+dp)=ug(T+dT,p+dp)
• 一 .克-克方程(Clausius-Clapeyron equation) • 当单组分体系两相共存时,自由度f=3-2=1, 体系只有一个自由度。 • 单组分的相变温度与压力之间存在一定的关 系, 此关系即为克-克方程. • 设一纯物质在T,p下达两相平衡: 在T+dT, p+dp下仍达平衡: ( , ) ( , ) B B T p T p = ( , ) ( , ) B B T dT p dp T dT p dp + + = + +
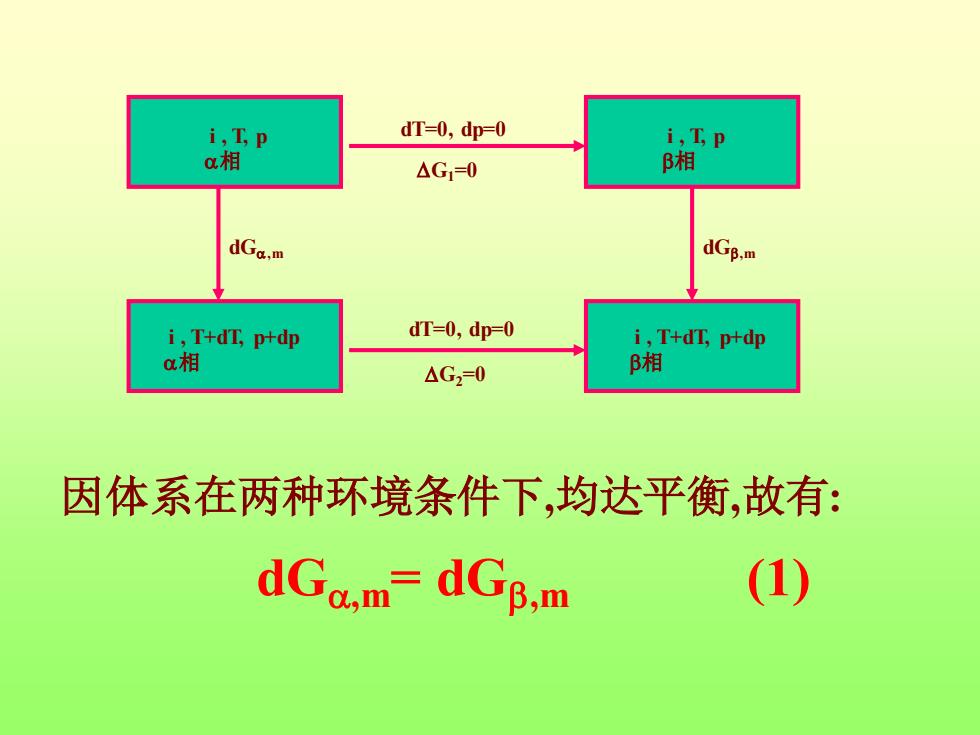
i,Tp dT=0,dp-0 i,Tp a相 △G1=0 β相 dGa.m dGg.m i,T+dT,p+dp dT=0,dp=0 i,T+dn,p叶dp a相 △G2=0 B相 因体系在两种环境条件下,均达平衡,故有: dGc.m=dGB.m (1)
i , T, p 相 i , T, p 相 dT=0, dp=0 G1=0 i , T+dT, p+dp 相 i , T+dT, p+dp 相 G2=0 dT=0, dp=0 dG,m dG,m 因体系在两种环境条件下,均达平衡,故有: dG,m= dG,m (1)

·由热力学基本关系式: dG=-SdT+Vdp -Sc.m dT+Va.m dp=-Sp.m dT+VB.m dp ● (Sp.m-Sa.m)dT=(Vp.m-Va.m)dp dp/dT=(SB.m-Sc.m)/(VB.m-Va.m) 整理上式: dp/dT=△Sm/△Vm (2) ·式中:△Sm为1mol物质由a相变为β相的熵变; △Vm为1mol物质由o相变为B相的体积变化
• 由热力学基本关系式: • dG=-SdT+Vdp • -S,m dT + V,m dp = -S,m dT + V,m dp • (S,m -S,m)dT = (V,m-V,m)dp • dp/dT = (S,m-S,m)/(V,m-V,m) • 整理上式: • dp/dT = Sm/Vm (2) • 式中: Sm为1mol物质由相变为相的熵变; • Vm为1mol物质由相变为相的体积变化

·因为是平衡相变,有: ● ASm-Lm/T ● Lm:物质的相变潜热; ● T:平衡相变的温度 代入(2)式: dp/dT=Lm/T△Vm (3) ·(3)式称为克拉贝龙方程 ·克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广
• 因为是平衡相变,有: • Sm=Lm/T • Lm: 物质的相变潜热; • T : 平衡相变的温度. • 代入(2)式: • dp/dT=Lm/TVm (3) • (3)式称为克拉贝龙方程. • 克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广

。1.气-液,气-固两相平衡: ·纯物质的两相平衡中有一相为气相,另一相必为 凝聚相.以气-液平衡为例,有: dp/dT=AH/TAVm=AHn/T(Vm.g-Vm. (4) ● Vmg一Vm≥Vmg-RT/p ·代入(4)式: dp/dT=△H./T(RT/pl dInp/dT=AH/RT2=Lm/RT2 (5) 。上式即为克拉贝龙-克劳修斯方程.表示纯物质 的蒸汽压与相变温度的关系
• 1. 气-液,气-固两相平衡: • 纯物质的两相平衡中有一相为气相,另一相必为 凝聚相. 以气-液平衡为例,有: • dp/dT=Hm/TVm= Hm/T(Vm,g-Vm,l) (4) • ∵ Vm,g>>Vm,l • ∴ Vm,g-Vm,l≈ Vm,g=RT/p • 代入(4)式: • dp/dT= Hm/[T(RT/p)] • dlnp/dT=Hm/RT2=Lm/RT2 (5) • 上式即为克拉贝龙-克劳修斯方程. 表示纯物质 的蒸汽压与相变温度的关系

·对(⑤)式积分可得: In(p2/P)=AHm/R(T2-T/TT2 (6) ·(6)式为克-克方程的积分式。 ·若对(⑤)式作不定积分: lnp=-Lm/R·(1/T)+K (7) ·式中:K为积分常数, ·将np~l/T作图可得一直线,由直线的斜率 可求得液体的蒸发潜热Lm
• 对(5)式积分可得: • ln(p2 /p1 )=Hm/R·(T2-T1 )/T1T2 (6) • (6)式为克-克方程的积分式. • 若对(5)式作不定积分: • lnp=-Lm/R·(1/T) + K (7) • 式中: K为积分常数. • 将lnp~1/T作图可得一直线,由直线的斜率 可求得液体的蒸发潜热Lm

·Troutoni规则: 。 克-克方程式可求出不同温度下物质的蒸汽压, 但必须知道物质的相变潜热。 ·对于气液的相变热,Trouton提出一个近似的 规则. 。 楚顿规则认为对于正常液体(非极性,分子间不 发生缔合的液体),其气化潜热与其正常沸点之 间有下列关系存在: Lm,vap~88Tp J.K-1.mol-1 (8) Troutoni规则适用于有机非极性物质,但对于极 性强的液体,如水,就不适用
• Trouton规则: • 克-克方程式可求出不同温度下物质的蒸汽压, 但必须知道物质的相变潜热. • 对于气液的相变热, Trouton提出一个近似的 规则. • 楚顿规则认为对于正常液体(非极性,分子间不 发生缔合的液体), 其气化潜热与其正常沸点之 间有下列关系存在: • Lm,vap≈88Tb J.K-1 .mol-1 (8) • Trouton规则适用于有机非极性物质,但对于极 性强的液体,如水,就不适用

·2.疑聚相间的相平衡: 。疑聚相间的相平衡衡,由克氏方程: dp/dT=△Hm/T△Vm dp=△Hm/△Vm(dT/T) ·因为疑聚相的体积随压力的变化很小,可 以视为常数。积分: p2-p1=△Hm/△Vmln(T2/T) (9)
• 2. 凝聚相间的相平衡: • 凝聚相间的相平衡,由克氏方程: • dp/dT=Hm/TVm • dp=Hm/Vm·(dT/T) • 因为凝聚相的体积随压力的变化很小,可 以视为常数. 积分: p2-p1= Hm/Vm·ln(T2 /T1 ) (9)