
158 §8.15金属的电沉积 金属阳离子的电还原是电解过程的主要 目的,也是电解冶炼的重要内容,原则上 讲,只要电极电位达到了金属离子的析出 电位,就会有金属在电极上沉积出来。 )阴极反应 电解时,在阴极上发生还原反应,在电解 时为负极,在它周围必是阳离子,常为金 属阳离子和氢离子。若体系中有多种阳离 子和,哪种阳离子先在电极上析出, 或那种先发生还原反应,取决于每种离子 在阴极上的还原电势,即阴极电势之大 小。中阴越高越先析出

中阴大者先在阴极上还原,中阴小的后在阴极上 还原。 外电压E=中阳中阴,设中阳不变,中阴 阳 越大,E越小,即沉积电压越小。 中阴=中阴(平阴=中- a还原态 nF 一1阴 氧化态 阴1 考察中阴时要考虑三部分内容:中,a,1阴。 例:电解ZnSO,(a=1),用两种电极(Pt,Pb), 考察Zn艹,H两种离子的析出顺序。 查表: Φ8=-0.763V,Φ0=0,PH=7,a=107。 在Pt电极上,两离子的过电势都可看作零

160 RT nF n a还原态 Zn+/Zn Zn/Zn a氧化态 =-0.763-部n} =-0.763V =e RT a还原态 H/H a氧化态 0-部 =-0.41V H 高,H先析出。 (a=107,P=P) 在Pb电极上,查表nn→0, nr=1.09V,求出 Φ22=-0.763V,Φt=-0.41-nr=-1.50V 这时,Zn的电极电位高,Zn先析出来。 在电解中,Zn先析出,使a2下降,导致中 下降,要维持电解继续进行,必须加大外加电压, 以适应降低的中阴。 当g由-0.763→-1.50V时,开始有H2析出, 此时[Zn竹已很小

除H之外,混合阳离子溶液在电解时有两种情况: )电解分离(分别析出) 若溶液中有多种金属离子,其各自的电极电势不同, 可以控制外加分解电压的大小,使金属离子先后依次 析出一电解分离法。 由于阳离子在阴极上析出时是按析出电势Φ阳由高到 低顺序进行,电解时控制外加电压由小到大,相当于 阴极电势逐步降低,就可做到使金属依次析出。 计算表明,当两种金属离子的析出电势相差0.2V时 (2价型),待第二种离子开始析出时,第一种金属离子 的浓度就下降为原来浓度的 实际上已经分离得 十分完全了

162 )同时沉积(合金电镀) 欲将两种金属同时在阴极上沉积出来(生成合金), 应该满足的条件是二析出电势中,=中2 ,=°-1nn,,中,=°-n -12 a, nF a 若n1≈n2 Φ°+ ha=中+部n a)当中°与中,°相差不大时,可以调节a1,a2使之满 足上式

163 b)当中°与,°相差很大,调节a1,a 也不能满足条件,可用改变中·的方 法。例如加入络合剂使两种离子生成 络离子,两种络离子的Φ°相差不大, 就可满足上式。例如Zn,Cu的Φe相 差很大,加入CN后,可沉积出Cu-Zn 合金。络离子为Zn(CN)4,Cu(CN)3, 中接近

164 ②)阳极反应 阳极发生氧化反应,可使阳极的金属溶解下来,或使 溶液中的阴离子发生氧化反应。 阳极反应仅决定于阳极还原电势,中阳越低,越易被 氧化。 Pt电极:为惰性电极,电解时负离子放电(C1,Br, I,OH等)。 金属电极(Zn,Cu等):为活性电极,发生金属溶解或 OH放电,主要是依赖于那一个Φ低一些: RT In a 中阳=- “还原态 “氧化态 电势低的首先被氧化,若为负离子氧化,可放出气体

165 §8.16金属的腐蚀与防腐 (1)金属的钝化 )稀,溶解 )钝化现象:Fe+HNO3 浓,不溶 化学钝化:F在稀硝酸中溶解,在浓 硝酸中不溶解,或溶解速率大大降低。在 浓硝酸中浸泡过的铁,再投入稀硝酸中也 不溶解,表明Fe表面发生了钝化,在表 面上形成了一层稳定的保护膜,称为化学 钝化。一切强氧化剂均可使金属钝化。 钝化的金属其电极电势向正方向移动
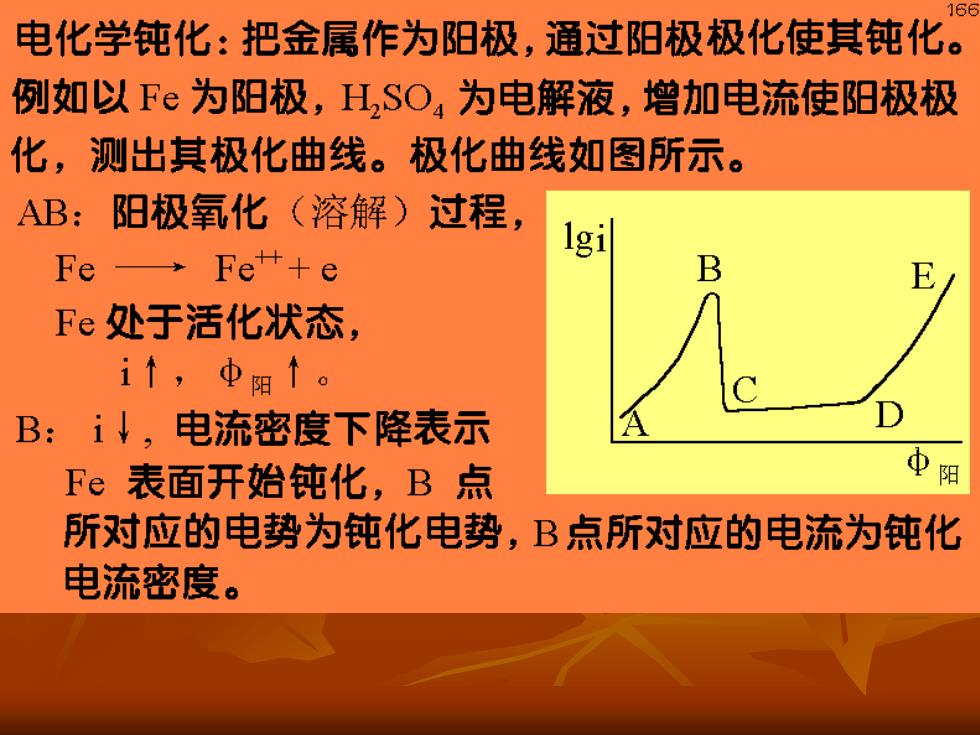
60 电化学钝化:把金属作为阳极,通过阳极极化使其钝化。 例如以Fe为阳极,H,SO,为电解液,增加电流使阳极极 化,测出其极化曲线。极化曲线如图所示。 AB:阳极氧化(溶解)过程, 1g1 Fe→Fe++e B Fe处于活化状态, i↑,中阳↑。 B:i↓,电流密度下降表示 Fe表面开始钝化,B点 中阳 所对应的电势为钝化电势,B点所对应的电流为钝化 电流密度

67 CD:金属Fe)处于稳定的钝态一 钝化 区,Fe不溶解,i值一直很小,此时的 电流称为钝态电流,只要保持电势在CD 之间,金属即处于稳定的钝化状态,保持 钝态电流。 DE:电流又再增加,表示发生了氧化反 应,称为过钝化区,Fe以Fe+溶入溶液。 由此可见,用外加电源,把被保护的金 属作为阳极,维持其电位在CD段上(钝化 区),就能防止金属腐蚀