6-8通用余焓图与通用余熵图 (Generalized enthalpy chart and generalized entropy chart) 一、通用余焓图和通用余熵图 通常,实际气体的焓、熵等以图表形式给出,这些图表是据 气体的状态方程及焓、熵等一般关系,结合实验数据制得。 缺乏图表的气体据余焓和余熵,利用通用余焓(余熵)图。 实际气体在某一状态时的焓和熵与假想把实际气体作为理 想气体在同一状态时的焓和熵的偏差 理想气体状态参数 H =H -H. nr =Sn -Sm m- 摩尔量 余焓(departure enthalpy) Hmr 余熵(departure entropy) 上游充通大学 2019年3月29日 3 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 3 ? 6-8 通用余焓图与通用余熵图 (Generalized enthalpy chart and generalized entropy chart) 通常,实际气体的焓、熵等以图表形式给出,这些图表是据 气体的状态方程及焓、熵等一般关系,结合实验数据制得。 缺乏图表的气体 余焓(departure enthalpy) 余熵(departure entropy) Hm r m r S *——理想气体状态参数 * H H H m r m m * m r m m S S S 一、通用余焓图和通用余熵图 据余焓和余熵,利用通用余焓(余熵)图。 实际气体在某一状态时的焓和熵与假想把实际气体作为理 想气体在同一状态时的焓和熵的偏差 m—摩尔量

据焓的一般方程和余函数的概念可导得Hmr=f(Zc,T,p) 据对应态原理,若z。取定值(如0.27),则Hmr=f(T,p) 可编制Z、=0.27时的图通用焓图PPT。类似的图通用熵图PPT 二、利用通用焓(熵)图求解过程的焓 (熵)变量 焓和熵都是状态参数,过程的焓差和熵差与中间途径无关, 因此,气体从平衡态1到平衡态2的焓差或熵差: Hm2-Hm=(Hm2-Hm2)-(HmI-Hm)+(Hm2-Hm) Hm2-Hm=(Hm-Hm)-(Hm-Hm2)+(Hm2Hm) H-=|匹。 RTer RTot 4 上游气通大学 2019年3月29日 4 SHANGHAI JIAO TONG UNIVERSITY
2019年3月29日 4 据焓的一般方程和余函数的概念可导得 4 mr cr r r H f Z T p ( , , ) 据对应态原理,若Zcr取定值(如0.27),则 mr r r H f T p ( , ) 可编制Zc = 0.27 时的图\通用焓图.PPT。类似的图\通用熵图.PPT 。 二、利用通用焓(熵)图求解过程的焓(熵)变量 * * * * m2 m1 m2 m2 m1 m1 m2 m1 H H H H H H H H ( ) ( ) ( ) * * * * m2 m1 m1 m1 m2 m2 m2 m1 H H H H H H H H ( ) ( ) ( ) 焓和熵都是状态参数,过程的焓差和熵差与中间途径无关, 因此,气体从平衡态1到平衡态2的焓差或熵差: * * m m 1 m m 2 * * m2 m1 cr m2 m1 cr cr ( ) ( ) ( ) H H H H H H RT H H RT RT

5.0 4.0 3.0 饱和曲线 2.0 通用焓图 1.0 80 05 0.80 0.60 0.40 0.30 =3.0 0.20 4.01 0.10 0.08 0.06 0.05 0.1 0.20.30.40.60.81.0 23 4 6810 上游充: SHANGHAI JLAO TON 对比压力Pr
2019 年 3 月29 日 5 通用焓图
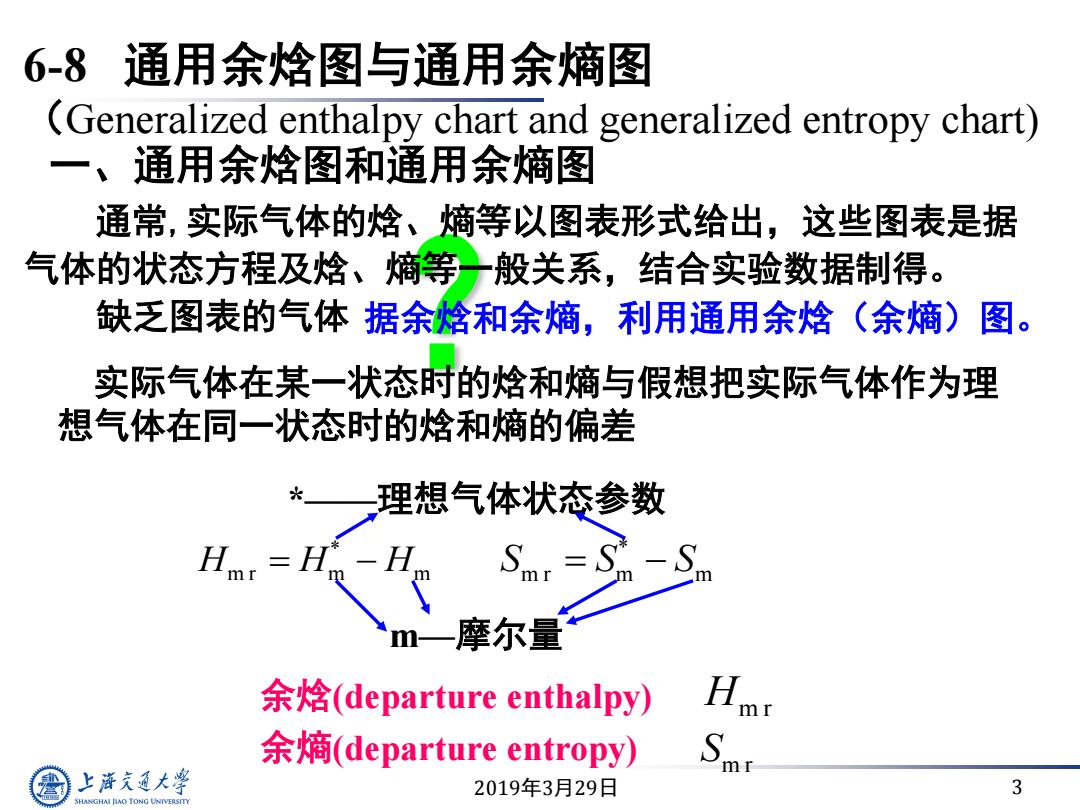
4.0 3.0 2.0 通用熵图 饱和曲线 1.0 0.80 0.60 50 60 1.7 80 0.40 0.30 T=0.90> 0.80 Q90@ T=2.0 2: 0.20 0.10 3.0 0.08 0.06 0.04 .1 0.20.30.4 0.60.81.0 2 3 4 6810 上游充通 对比压力P SHANGHAI JLAO TONG UNIVERSITY
2019 年 3 月29 日 6 通用熵图

(HH)H HH风 由图通用焓图PPT查取 理想气体状态的焓变 12 理想气体状态1和2间的 摩尔热容,与温度有关 /R/ R 由图通用熵图PPT查取 理想气体状态1和2间的熵差 7 上游通大学 2019年3月29日 7 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 7 * * m m 1 m m 2 * * m2 m1 cr m2 m1 cr cr ( ) ( ) ( ) H H H H H H RT H H RT RT 理想气体状态的焓变 2 1 * ,md T p T C T 理想气体状态1和2间的 摩尔热容,与温度有关 由 7 2 1 * * m m 1 m m 2 2 * m2 m1 ,m 1 ( ) ( ) d ln T p T S S S S T p S S R C R R R T p 由 图\通用熵图.PPT 理想气体状态1和2间的熵差 图\通用焓图.PPT查取 查取

例题1第六章1A820277 利用通用焓图和通用熵图求甲烷从6.5MPa、298.15K的初 态定压加热到400K时的热量和熵变化量。 解:由表查得,CH4的临界参数为 p.=4.64MPa T。=190.7K Pn=P= 6.5MPa =1.40 Pr2=Pr Pe 4.64Pa T 298.15K T1= =1.56 T 400K =2.10 T 190.7K T 190.7K 查通用焓图,T,=1.56p,=1.40T,=2.10p,=1.40 (Hm-Hm)=0.60 (Hm-Hm)2=0.28 上游充通大学 RT RT 8 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 8 利用通用焓图和通用熵图求甲烷从6.5MPa、298.15K的初 态定压加热到400K时的热量和熵变化量。 解:由表查得,CH4的临界参数为 pc =4.64MPa Tc =190.7K 1 1 2 1 6.5MPa 1.40 4.64MPa r r r c p p p p p 1 2 1 2 298.15K 400K 1.56 2.10 190.7K 190.7K r r c c T T T T T T 查通用焓图, 1.56 pr 1.40 Tr pr 1.40 Tr 2.10 0.28 ( ) 0.60 ( ) 2 * 1 * c m m c m m RT H H RT H H 例题\第六章\A820277

查附表8,理想气体状态CH,的摩尔焓为 Hm29815=10018.7J/mol H"4=13888.9J/mol dT=13888.9J/mol-10018.7J/mol =3870.2J/mol 所以CH焓的变化 Has-Ha-RT -car RT RT =8.3145 J ×190.7K×0.6-0.28)+3870.2J=4377.6J mol.K mol l 定压过程的热量即焓差,所以 O=H.2-Hm.=4377.6J/mol 上游充通大学 2019年3月29日 9 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 9 查附表8,理想气体状态CH4的摩尔焓为 * * ,298.15 ,400 10018.7J/mol 13888.9J/mol H H m m 2 1 * * * , ,2 ,1 13888.9J/mol 10018.7J/mol T p m m m T c dT H H =3870.2J/mol 所以CH4焓的变化 2 1 * * 1 2 * ,2 ,1 , ( ) ( ) d T m m m m m m c p m T c c H H H H H H RT C T RT RT J J J 8.3145 190.7K (0.6 0.28) 3870.2 4377.6 mol K mol mol 定压过程的热量即焓差,所以 ,2 ,1 4377.6J/mol Q H H m m

根据p和T查通用熵图,得 (Sm-Sm)=0.31 (Sm-Sm)2=0.12 R R 从附表8查得 Sm2815=186.233J/mol.K) Sm40=197.367J/mol-K) 所要求的熵变化为 R R =8.3145J/(mol.K)×(0.31-0.12)+(197.367J/(mol·K)-186.233J/(mol.K) J =12.71 mol.K 上游气通大粤 2019年3月29日 10 SHANGHAI JIAO TONG UNIVERSITY
2019年3月29日 10 根据pr和Tr查通用熵图,得 0.12 ( ) 0.31 ( ) 2 * 1 * R S S R Sm Sm m m 从附表8查得 * * ,298.15 ,400 186.233J/(mol K) 197.367J/(mol K) m m S S 所要求的熵变化为 * * 1 2 * * ,2 ,1 ,2 ,1 ( ) ( ) 8.3145J/(mol K) (0.31 0.12) (197.367J/(mol K) 186.233J/(mol K)) J 12.71 mol K m m m m m m m m S S S S S S R S S R R
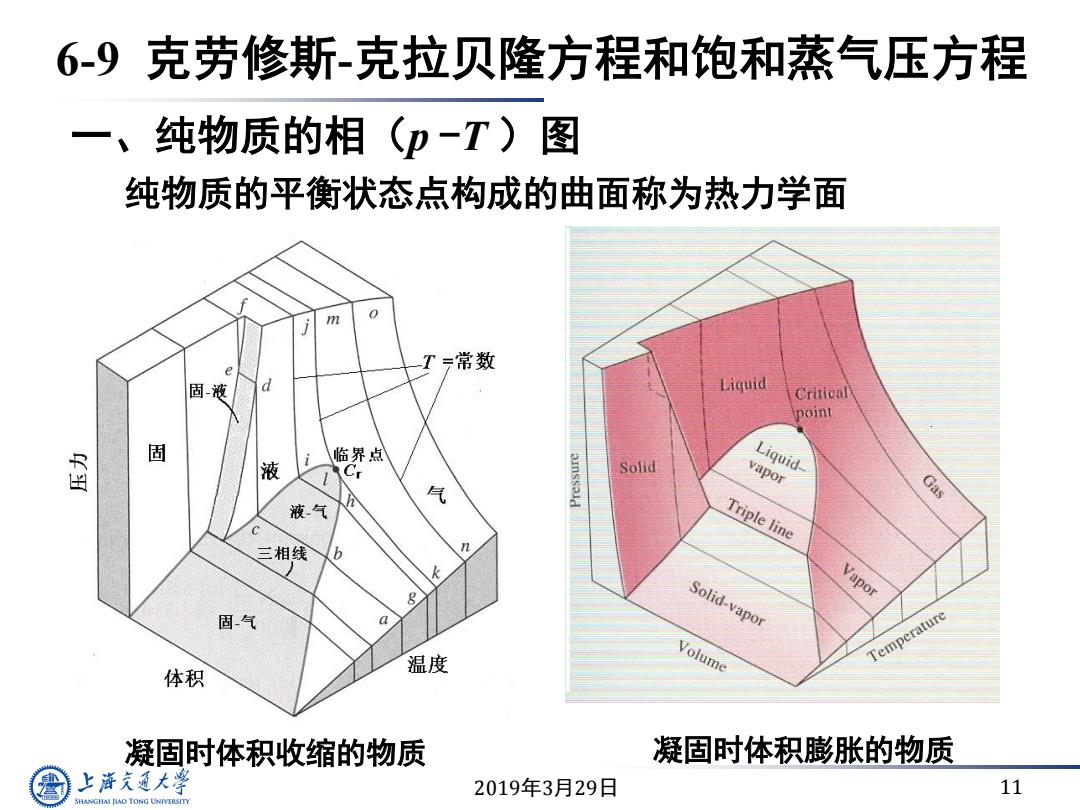
6-9克劳修斯-克拉贝隆方程和饱和蒸气压方程 一、纯物质的相(p-T)图 纯物质的平衡状态点构成的曲面称为热力学面 m T 三常数 固液 Liquid Critical point 固 国 液 i 临界点 C Solid Liquid- vapor 风 Gas 液气 Triple line 三相线 b n k Vapor 固气 Solid-vapor Volume Temperature 体积 温度 凝固时体积收缩的物质 凝固时体积膨张的物质 上游究通大粤 2019年3月29日 11 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 11 6-9 克劳修斯-克拉贝隆方程和饱和蒸气压方程 一、纯物质的相(p -T )图 纯物质的平衡状态点构成的曲面称为热力学面 凝固时体积收缩的物质 凝固时体积膨胀的物质
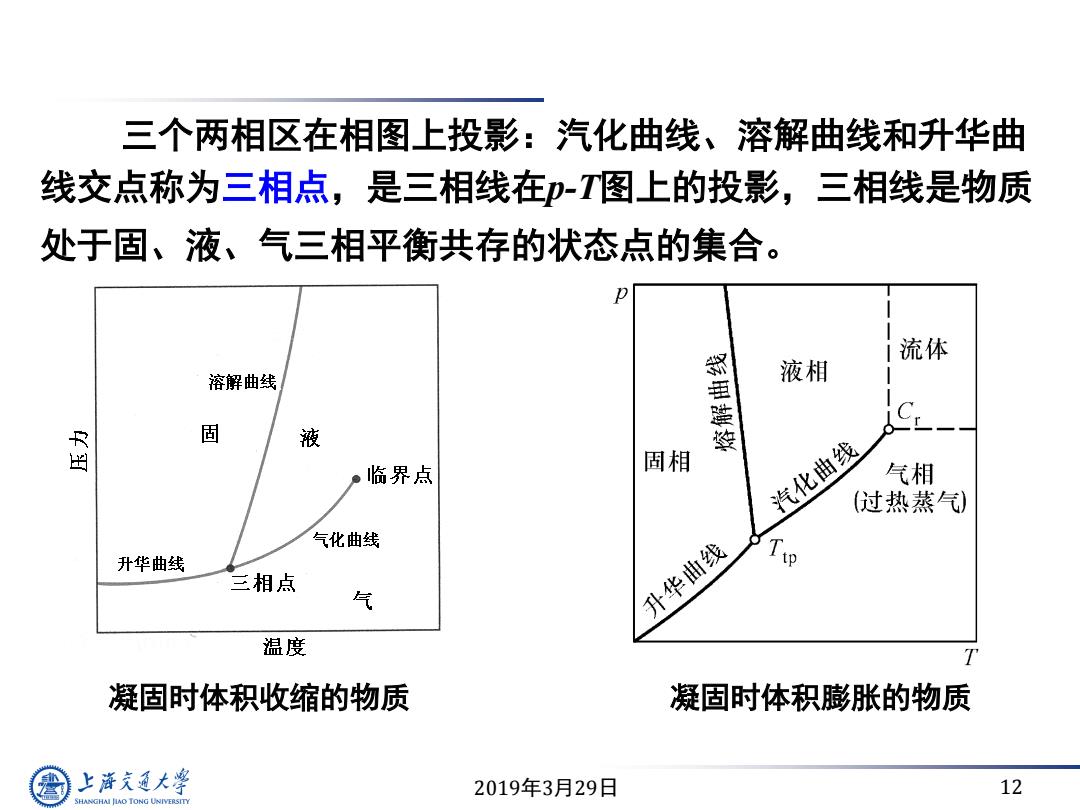
三个两相区在相图上投影:汽化曲线、溶解曲线和升华曲 线交点称为三相点,是三相线在印-T图上的投影,三相线是物质 处于固、液、气三相平衡共存的状态点的集合。 流体 溶解曲线 液相 母 固 液 。临界点 固相 汽化曲线 气相 (过热蒸气) 气化曲线 T 升华曲线 三相点 气 升华曲线 温度 T 凝固时体积收缩的物质 凝固时体积膨胀的物质 上游充通大 2019年3月29日 12 SHANGHAI JLAO TONG UNIVERSITY
2019年3月29日 12 三个两相区在相图上投影:汽化曲线、溶解曲线和升华曲 线交点称为三相点,是三相线在p-T图上的投影,三相线是物质 处于固、液、气三相平衡共存的状态点的集合。 凝固时体积收缩的物质 凝固时体积膨胀的物质