
课程编号:02110114课程英文名称:Microbiology Experiment 课程性质:必修课 开设部门:生物与制药工程系生物工程教研室 课程面向专业:生物工程 生物技术 要求先修课程:有机化学,生物化学 学分:2.5学时时:40 一、课程目标与教学任务 教学目标:学习和掌握微生物学基本的研究方法和实验操作技术。培养学生对微生物的感性认识和 实验动 手能力 教学任务:微生物学实验技术是生命科学中的独立技术,作为一门与微生物学理论课同时进行的独 立的实验课程,微生物学实验是生物工程、生物技术专业重要的专业实验课程。它的主要任务是要求 学生熟练掌握显微镜的使用方法和不同种类微生物的制片和观察方法;无菌操作技术;培养基的配 和灭菌方法;微生物纯培养的技术;微生物群体生长规律和微生物菌数的测定方法;环境条件对 微 物生长影响的研究 和测定方洁 :细菌质粒 接 转移和质粒DNA的抽提检测方法等 了达到本课程的教学目标,完成课程的教学任务,要求做到以下孔点: 1.实验前预习 学生在实验前应认真细致地阅读实验教材,了解实验的目的、原理、方法,以及实验所用的仪器等 有关情况,明确实验的具体要求与实验流程或实验过程。 金操作 实验过程中应根据实验要求与内容,严格认真地进行实验操作。实验过程中尽可能作到进行独立的 实验操作,同时应注意与同组同学的配合。实验中应仔细观察实验现象,客观、真实、准确地记录 实验现象与结果,不得随意更改。实验结束后必须将实验结果报告给老师,或给老师检查,合格后 方能结束实验。实验结束后要将实验中所用物品、仪器等收拾整洁或归还给管理人员。并将实验台 面与周围环境 地面等清扫干净后才能离开。 3.实验报告 实验报告的撰写是实验过程的重要环节之 ,应认真完成实验报告。实验报告的内容一般包括:实 验的目的、原理、仪器与试剂、实验步骤、数据处理、结果与讨论等方面。应按实验报告的统一要 求完成。并于指定时间内收集上交给实验老师,作为实验成绩的 部分己司备室 课程内容与学时分配 (一)课程内容 实验一显微镜的使用和细菌的简单染色 基本要求:掌握显微镜使用方法和细菌的制片、染色与观察方法,无菌操作方法 立哈内突· 细菌的制片与简单染色;利用显微镜观察大肠杆 、金黄色葡萄球菌等细菌的个体形 态:显微镜的使用和保养 操作要点:细菌的制片与染色技术:显微镜油镜头的使用、保养方法与调焦技术。 实验二细菌的革兰氏染色 基本要求:掌握细菌的革兰氏染色方法与操作关键。 ,大肠杆菌 金黄色葡萄球菌、枯草杆菌等细菌的制片与革兰氏染色;细菌的显微镜观察 操作要点:革兰氏染色的操作过程中的酒精脱色步骤的控制;显微镜下染色结果的判断。 实验三细菌的英膜染色和芽孢染色 基本要求:掌握细菌荚膜染色和芽孢染色方法,观察荚膜和芽孢的形态 实验内容 利用荚膜负染方法观察硅酸盐细菌的英膜形态;利用芽孢染色方法观察枯草芽孢杆菌的 芽抱升态 操作要点:产夹膜细菌的制片;用墨汁对细菌作负染;显微镜下荚膜与菌体的辨别:芽孢与菌体的 辨别。 实验四放线菌和蓝细菌的形态观察 基本要求:掌握印片法制备和观察放线菌孢子丝的形态;制备水浸片观察蓝细菌的个体形态和异形 胞的形态
课程编号:02110114课程英文名称:Microbiology Experiment 课程性质:必修课 开设部门:生物与制药工程系生物工程教研室 课程面向专业:生物工程、生物技术 要求先修课程:有机化学,生物化学 学分:2. 5学时:40 一、课程目标与教学任务 教学目标:学习和掌握微生物学基本的研究方法和实验操作技术。培养学生对微生物的感性认识和 实验动手能力。 教学任务:微生物学实验技术是生命科学中的独立技术,作为一门与微生物学理论课同时进行的独 立的实验课程,微生物学实验是生物工程、生物技术专业重要的专业实验课程。 它的主要任务是要求 学生熟练掌握显微镜的使用方法和不同种类微生物的制片和观察方法;无菌操作技术;培养基的配 制和灭菌方法;微生物纯培养的技术;微生物群体生长规律和微生物菌数的测定方法;环境条件对 微生物生长影响的研究和测定方法;细菌质粒的接合转移和质粒DNA的抽提检测方法等。 为了达到本课程的教学目标,完成课程的教学任务,要求做到以下几点: 1.实验前预习 学生在实验前应认真细致地阅读实验教材,了解实验的目的、原理、方法,以及实验所用的仪器等 有关情况,明确实验的具体要求与实验流程或实验过程。 2.实验操作 实验过程中应根据实验要求与内容,严格认真地进行实验操作。实验过程中尽可能作到进行独立的 实验操作,同时应注意与同组同学的配合。实验中应仔细观察实验现象,客观、真实、准确地记录 实验现象与结果,不得随意更改。实验结束后必须将实验结果报告给老师,或给老师检查,合格后 方能结束实验。实验结束后要将实验中所用物品、仪器等收拾整洁或归还给管理人员。并将实验台 面与周围环境、地面等清扫干净后才能离开。 3.实验报告 实验报告的撰写是实验过程的重要环节之一,应认真完成实验报告。实验报告的内容一般包括:实 验的目的、原理、仪器与试剂、实验步骤、数据处理、结果与讨论等方面。应按实验报告的统一要 求完成。并于指定时间内收集上交给实验老师,作为实验成绩的一部分记录备案。 二、课程内容与学时分配 (一)课程内容 实验一显微镜的使用和细菌的简单染色 基本要求:掌握显微镜使用方法和细菌的制片、染色与观察方法,无菌操作方法。 实验内容:细菌的制片与简单染色;利用显微镜观察大肠杆菌、金黄色葡萄球菌等细菌的个体形 态;显微镜的使用和保养。 操作要点:细菌的制片与染色技术;显微镜油镜头的使用、保养方法与调焦技术。 实验二细菌的革兰氏染色 基本要求:掌握细菌的革兰氏染色方法与操作关键。 实验内容:大肠杆菌、金黄色葡萄球菌、枯草杆菌等细菌的制片与革兰氏染色;细菌的显微镜观察 与革兰氏染色结果判别。 操作要点:革兰氏染色的操作过程中的酒精脱色步骤的控制;显微镜下染色结果的判断。 实验三细菌的荚膜染色和芽孢染色 基本要求:掌握细菌荚膜染色和芽孢染色方法,观察荚膜和芽孢的形态 实验内容:利用荚膜负染方法观察硅酸盐细菌的荚膜形态;利用芽孢染色方法观察枯草芽孢杆菌的 芽孢形态。 操作要点:产夹膜细菌的制片;用墨汁对细菌作负染;显微镜下荚膜与菌体的辨别;芽孢与菌体的 辨别。 实验四放线菌和蓝细菌的形态观察 基本要求:掌握印片法制备和观察放线菌孢子丝的形态;制备水浸片观察蓝细菌的个体形态和异形 胞的形态

实验内容:采用印片法制备和观察链霉菌孢子丝的形态;水浸片的制备与固氮鱼腥藻个体形态的观 操作要点:微生物印片法制片技术;观察水浸片时显微镜聚光器的调节 实验五霉菌水浸片的制备、观察与微生物菌落形态比较 基本要求:掌握制备水浸片观察几种常见霉菌的个体形态和产孢结构;观察和比较平板中几种常见 的细菌、放线菌、真菌的菌落形态。 实验内容:制备根霉、毛霉、黑曲霉、青霉水浸片;显微镜下观察比较根霉、毛霉的个体形态和黑 曲霉、 青霉的产孢结构;观察和描述几种常见的细菌、放线菌、真菌的菌落形态 操作要点:真菌制片时的选取合适的菌落部位;制备水浸片时分散菌丝体;观察水浸片时保持载玻 片与盖玻片之间的水层和将显微镜聚光器调至适当位置。 实验六微生物细胞的大小和显微直接计数法与酵母菌的出芽生殖观察 基本要求:掌握测定微生物细胞大小的测定原理和方法;掌握用血球计数板计数酵母菌总数的原理 和方法;观察酵母菌的出芽生殖 实验内容:使用目镜测微尺和镜台测微尺测量酵母菌细胞的大小;使用血球计数板计数斜面试管中 酵母菌总数;显微镜观察酵母菌的出芽生殖。 操作要点:目镜测微尺、镜台测微尺、血球计数板计的使用方法;酵母菌细胞的大小和总数的计算 方法 实验七培养基的制备与灭菌 要求:掌握微生物培养基的配制与灭菌方法。 实验内容:配制几种常用的细菌、放线菌、真菌培养基:无菌材料的准备;培养基及其相关实验材 料的灭菌。 操作要点:培养基的配制、分装与包装方法;固体培养基与斜面的制作;湿热高压蒸汽灭菌锅灭菌 与的操作方法, 实验八稀释平板测数法与划线分离法 基本要求:掌握稀释平板分离法与划线分离法的原理与操作方法,和用于微生物活菌数的计数的稀 释平板测数法的操作方法 实验内容:采用稀释平板法测定土壤中细菌、放线菌和真菌的数量;采用划线分离法获得单菌落 操作要点: 无菌操作技术;培养基的熔化与平板的制备;样品的系列稀释;选择合适的稀释度涂布 平板与划线;平板的培养与单菌落的计数。 实验九水中细菌总数和大肠菌群的检测 基本要求:掌握用稀释平板测数法测定水中细菌总数的方法:掌握水中大肠菌群的检测方法 实验内容:水样的乳 样稀 培养与水中细菌总数和大肠菌群的平板计数 与鉴别。 操作要点:无菌操作;合适的水样的选择;稀释度的选择;大肠杆菌在EMB培养基上菌落特征的鉴 别 实验十紫外线和化学药剂对微生物的作用 基本要求: 实验内容: 菌或抑菌效果。 操作要点:要求无菌操作;紫外线照射时间选择;化学杀菌剂和抗生素使用浓度;注意保护眼睛防 止紫外线照射。 实验十一大肠杆菌生长曲线的测定 基本要求 细菌生长曲线的特点及测定原理 学会用比浊法澳测定细菌的生长曲线 实验内容:大肠杆菌的接种与摇床培养;加酸对细菌生长的影响;用分光光度计测定菌液的OD值: 细菌生长曲线的绘制。 操作要点:接种、取样、加酸时要求做到无菌操作。 实验十 二细菌质粒接合转移与质粒DNA的提取与检测 基本要求 掌握三亲本杂交的基本原理和方法掌握质粒DNA快速检测的方法, 实验内容:带有发光酶基因的细菌质粒的接合转移;转移接合子的筛选与纯化;转移接合子的培 养,质粒DNA的提取与琼脂糖凝胶电泳与检测
实验内容:采用印片法制备和观察链霉菌孢子丝的形态;水浸片的制备与固氮鱼腥藻个体形态的观 察。 操作要点:微生物印片法制片技术;观察水浸片时显微镜聚光器的调节 实验五霉菌水浸片的制备、观察与微生物菌落形态比较 基本要求:掌握制备水浸片观察几种常见霉菌的个体形态和产孢结构;观察和比较平板中几种常见 的细菌、放线菌、真菌的菌落形态。 实验内容:制备根霉、毛霉、黑曲霉、青霉水浸片;显微镜下观察比较根霉、毛霉的个体形态和黑 曲霉、青霉的产孢结构;观察和描述几种常见的细菌、放线菌、真菌的菌落形态。 操作要点:真菌制片时的选取合适的菌落部位;制备水浸片时分散菌丝体;观察水浸片时保持载玻 片与盖玻片之间的水层和将显微镜聚光器调至适当位置。 实验六微生物细胞的大小和显微直接计数法与酵母菌的出芽生殖观察 基本要求:掌握测定微生物细胞大小的测定原理和方法;掌握用血球计数板计数酵母菌总数的原理 和方法;观察酵母菌的出芽生殖。 实验内容:使用目镜测微尺和镜台测微尺测量酵母菌细胞的大小;使用血球计数板计数斜面试管中 酵母菌总数;显微镜观察酵母菌的出芽生殖。 操作要点:目镜测微尺、镜台测微尺、血球计数板计的使用方法;酵母菌细胞的大小和总数的计算 方法。 实验七培养基的制备与灭菌 要求:掌握微生物培养基的配制与灭菌方法。 实验内容:配制几种常用的细菌、放线菌、真菌培养基;无菌材料的准备;培养基及其相关实验材 料的灭菌。 操作要点:培养基的配制、分装与包装方法;固体培养基与斜面的制作;湿热高压蒸汽灭菌锅灭菌 与的操作方法。 实验八稀释平板测数法与划线分离法 基本要求:掌握稀释平板分离法与划线分离法的原理与操作方法,和用于微生物活菌数的计数的稀 释平板测数法的操作方法。 实验内容:采用稀释平板法测定土壤中细菌、放线菌和真菌的数量;采用划线分离法获得单菌落。 操作要点:无菌操作技术;培养基的熔化与平板的制备;样品的系列稀释;选择合适的稀释度涂布 平板与划线;平板的培养与单菌落的计数。 实验九水中细菌总数和大肠菌群的检测 基本要求:掌握用稀释平板测数法测定水中细菌总数的方法;掌握水中大肠菌群的检测方法。 实验内容:水样的采集;水样稀释、培养与水中细菌总数和大肠菌群的平板计数与鉴别。 操作要点:无菌操作;合适的水样的选择;稀释度的选择;大肠杆菌在EMB培养基上菌落特征的鉴 别 实验十紫外线和化学药剂对微生物的作用 基本要求:了解紫外线和化学药剂的杀菌作用,学习紫外线杀菌试验方法。 实验内容:用大肠杆菌和金黄色葡萄球菌作指示菌测定经紫外线和化学杀菌剂、抗生素处理后的杀 菌或抑菌效果。 操作要点:要求无菌操作;紫外线照射时间选择;化学杀菌剂和抗生素使用浓度;注意保护眼睛防 止紫外线照射。 实验十一大肠杆菌生长曲线的测定 基本要求:了解细菌生长曲线的特点及测定原理,学会用比浊法测定细菌的生长曲线。 实验内容:大肠杆菌的接种与摇床培养;加酸对细菌生长的影响;用分光光度计测定菌液的OD值; 细菌生长曲线的绘制。 操作要点:接种、取样、加酸时要求做到无菌操作。 实验十二细菌质粒接合转移与质粒DNA的提取与检测 基本要求:掌握三亲本杂交的基本原理和方法;掌握质粒DNA快速检测的方法。 实验内容:带有发光酶基因的细菌质粒的接合转移;转移接合子的筛选与纯化;转移接合子的培 养,质粒DNA的提取与琼脂糖凝胶电泳与检测
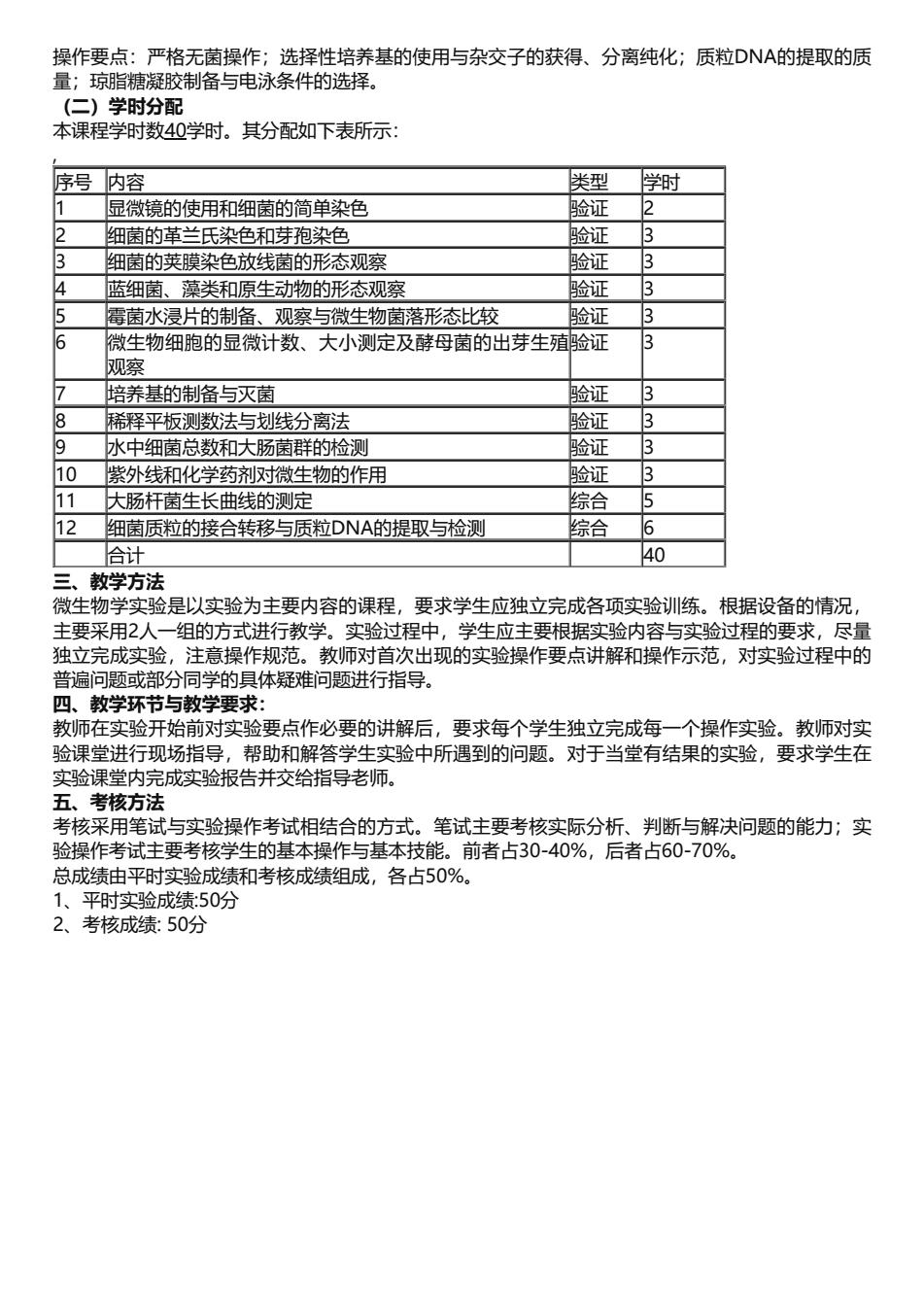
操作要点:严格无菌操作;选择性培养基的使用与杂交子的获得、分离纯化;质粒DNA的提取的质 量;琼脂糖凝胶制备与电泳条件的选择。 (二)学时分配 本课程学时数40学时。其分配如下表所示: 序号内容 类型 学时 显微镜的使用和细菌的简单染色 验证 2 2 细菌的革兰氏染色和芽孢染色 验证 3 3 细菌的英荚膜染色放线菌的形态观察 验证 3 4 蓝细菌、藻类和原生动物的形态观察 验证 3 5 霉菌水浸片的制备、观察与微生物菌落形态比较 验证 3 6 微生物细胞的显微计数、大小测定及酵母菌的出芽生殖验证 3 观察 7 培养基的制备与灭菌 验证 3 8 稀释平板测数法与划线分离法 验证 3 9 水中细菌总数和大肠菌群的检测 验证 3 10 紫外线和化学药剂对微生物的作用 验证 3 11 大肠杆菌生长曲线的测定 综合 5 12 细菌质粒的接合转移与质粒DNA的提取与检测 综合 6 合计 40 三、教学方法 微生物学实验是以实验为主要内容的课程,要求学生应独立完成各项实验训练。根据设备的情况, 主要采用2人一组的方式进行教学。实验过程中,学生应主要根据实验内容与实验过程的要求,尽量 独立完成实验,注意操作规范。教师对首次出现的实验操作要点讲解和操作示范,对实验过程中的 普遍问题或部分同学的具体疑难问题进行指导。 四、教学环节与教学要求: 教师在实验开始前对实验要点作必要的讲解后,要求每个学生独立完成每一个操作实验。教师对实 验课堂进行现场指导,帮助和解答学生实验中所遇到的问题。对于当堂有结果的实验,要求学生在 实验课堂内完成实验报告并交给指导老师。 五、考核方法 考核采用笔试与实验操作考试相结合的方式。笔试主要考核实际分析、判断与解决问题的能力;实 验操作考试主要考核学生的基本操作与基本技能。前者占30-40%,后者占60-70%。 总成绩由平时实验成绩和考核成绩组成,各占50%。 1、平时实验成绩:50分 2、考核成绩:50分
操作要点:严格无菌操作;选择性培养基的使用与杂交子的获得、分离纯化;质粒DNA的提取的质 量;琼脂糖凝胶制备与电泳条件的选择。 (二)学时分配 本课程学时数40学时。其分配如下表所示: , 序号 内容 类型 学时 1 显微镜的使用和细菌的简单染色 验证 2 2 细菌的革兰氏染色和芽孢染色 验证 3 3 细菌的荚膜染色放线菌的形态观察 验证 3 4 蓝细菌、藻类和原生动物的形态观察 验证 3 5 霉菌水浸片的制备、观察与微生物菌落形态比较 验证 3 6 微生物细胞的显微计数、大小测定及酵母菌的出芽生殖 观察 验证 3 7 培养基的制备与灭菌 验证 3 8 稀释平板测数法与划线分离法 验证 3 9 水中细菌总数和大肠菌群的检测 验证 3 10 紫外线和化学药剂对微生物的作用 验证 3 11 大肠杆菌生长曲线的测定 综合 5 12 细菌质粒的接合转移与质粒DNA的提取与检测 综合 6 合计 40 三、教学方法 微生物学实验是以实验为主要内容的课程,要求学生应独立完成各项实验训练。根据设备的情况, 主要采用2人一组的方式进行教学。实验过程中,学生应主要根据实验内容与实验过程的要求,尽量 独立完成实验,注意操作规范。教师对首次出现的实验操作要点讲解和操作示范,对实验过程中的 普遍问题或部分同学的具体疑难问题进行指导。 四、教学环节与教学要求: 教师在实验开始前对实验要点作必要的讲解后,要求每个学生独立完成每一个操作实验。教师对实 验课堂进行现场指导,帮助和解答学生实验中所遇到的问题。对于当堂有结果的实验,要求学生在 实验课堂内完成实验报告并交给指导老师。 五、考核方法 考核采用笔试与实验操作考试相结合的方式。笔试主要考核实际分析、判断与解决问题的能力;实 验操作考试主要考核学生的基本操作与基本技能。前者占30-40%,后者占60-70%。 总成绩由平时实验成绩和考核成绩组成,各占50%。 1、平时实验成绩:50分 2、考核成绩: 50分