
一、课程基本信息 课程代码:02120109 课程名称:生物化学与分子生物学实验 课程英文名称:Bioche ist & olecular biology experiment 课程所属单位:生物与制药工程系,生物技术教研室 课程面向专业:生物技术专业 课程类型:必修课 先修课程:生物化学、分子生物学 学分 学时: 72应开实验项目个数:16 二、课程性质与目的 《生物化学与分子生物学实验》是在生物技术专业中的一门非常重要的实验性专业基础课。它是在 生物化学与分子生物学等课程的基础上而开设的。通过这门课程的学习,希望学生掌握生物化学与 分子生物学常用实验的基本原理! 基本操作及其应用。通过该门课程的学习, 使学生具备一定的科 学实验能力,为学生科学素质的培养奠定基础。 三、课程内容与要求 实验一:还原糖的测定(2学时) 基本要求:掌握还原糖测定的基本原理 主要内容:测定还原糖 操作要点:分光光度计操作 主要仪器设备:恒温水浴,分光光度计 实验二:粗淀粉的测定(1%盐酸旋光法) (2学时】 其木要求,掌根旋业仪的使田 了解旋光法测粗淀粉的基本原理】 主要内容 测定淀粉的含量 操作要点:旋光仪的使用 主要仪器设备:旋光仪、水浴锅 实验三:血糖的测定(2学时) 基本要求:掌握磷钼酸比色法测定血糖的原理及方法,学会制备无蛋白血滤液 主要内容 测定血糖的浓度 操作要点:分光光度计的使用 主要仪器设备:分光光度计;电炉 实验四:脂肪酸值的测定(4学时) 基本要求:掌握测定脂肪酸值的原理和方法,了解测定脂肪酸值的意义 主要内容 定脂肪酸的酸值 操作要点:滴定操作 主要仪器设备:振荡器,天平 实验五:油脂皂化与皂化值的测定(4学时) 其木要求 堂握测定皂化值的方 主要内容 测定油脂的皂化值 操作要点:滴定操作 主要仪器设备:球形冷凝管:水浴锅 实验六:血清胆固醇的测定(2学时) 基本 胆固醇的测定方法和原理 主要内容 测定胆固醇含量 操作要点:分光光度计操作 主要仪器设备:离心机,分光光度计。 实验七:纸层折法分离鉴定氨基酸(4学时) 基本要 掌握纸 操作技术 主要内容:纸层析分离鉴定氨基酸
一、课程基本信息 课程代码:02120109 课程名称:生物化学与分子生物学实验 课程英文名称: Biochemistry & molecular biology experiment 课程所属单位:生物与制药工程系,生物技术教研室 课程面向专业:生物技术专业 课程类型:必修课 先修课程:生物化学、分子生物学 学分:4.5 学时:72应开实验项目个数:16 二、课程性质与目的 《生物化学与分子生物学实验》是在生物技术专业中的一门非常重要的实验性专业基础课。它是在 生物化学与分子生物学等课程的基础上而开设的。通过这门课程的学习,希望学生掌握生物化学与 分子生物学常用实验的基本原理、基本操作及其应用。通过该门课程的学习,使学生具备一定的科 学实验能力,为学生科学素质的培养奠定基础。 三、课程内容与要求 实验一:还原糖的测定(2学时) 基本要求:掌握还原糖测定的基本原理 主要内容:测定还原糖 操作要点:分光光度计操作 主要仪器设备:恒温水浴,分光光度计。 实验二:粗淀粉的测定(1%盐酸旋光法)(2学时) 基本要求:掌握旋光仪的使用,了解旋光法测粗淀粉的基本原理。 主要内容:测定淀粉的含量 操作要点:旋光仪的使用 主要仪器设备:旋光仪、水浴锅 实验三:血糖的测定(2学时) 基本要求:掌握磷钼酸比色法测定血糖的原理及方法,学会制备无蛋白血滤液 主要内容:测定血糖的浓度 操作要点:分光光度计的使用 主要仪器设备:分光光度计;电炉 实验四:脂肪酸值的测定(4学时) 基本要求:掌握测定脂肪酸值的原理和方法,了解测定脂肪酸值的意义 主要内容:测定脂肪酸的酸值 操作要点:滴定操作 主要仪器设备:振荡器,天平 实验五:油脂皂化与皂化值的测定(4学时) 基本要求:掌握测定皂化值的方法 主要内容:测定油脂的皂化值 操作要点:滴定操作 主要仪器设备:球形冷凝管;水浴锅 实验六:血清胆固醇的测定(2学时) 基本要求:胆固醇的测定方法和原理 主要内容:测定胆固醇含量 操作要点:分光光度计操作 主要仪器设备:离心机,分光光度计。 实验七:纸层析法分离鉴定氨基酸(4学时) 基本要求:掌握纸层析的操作技术 主要内容:纸层析分离鉴定氨基酸

操作要点:层析操作 主要仪器设备:层析缸(干燥),喷雾器,毛细管,电吹风,针,线,直尺。 实验八: 甲醛滴 法测定氨基氨含量(3学时) 基本要求:掌握甲醛滴定法的原理及方法 主要内容:测侧定氨基含量 操作要点:滴定操作 主要仪器设备:研钵微量碱式滴定管 实 九 赖氨酸含量 的测定 (3学时 本要求:掌握分光光度计的使用及测定谷物中赖氨酸的方法 主要内容:测定谷物中赖氨酸 操作要点:分光光度计的使用 主要仪器设备:温水浴、分光光度计」 实验十:蛋白质含量测定 考马斯亮蓝G-250法(2学时) 基本要求:掌握考马斯亮蓝G250染色法测定蛋白质含量的原理和方法 主要内容:测定蛋白质含量 操作要点:分光光度计的使用 主要仪器设备:分光光度计,离心机,分析天平 实验十 蛋白质含量测定 微量凯氏定氨法(6学时) 基本要求:掌握凯氏定氨法的原理及凯氏定氮仪的使用。了解凯氏定氨法测定蛋白质含量的优缺点 及蛋白质系数的意义 主要内容:微量凯氏定氮法测定蛋白质含量 操作要点:消化、蒸馏、滴定操作 主要仪器设备:全套微量凯氏定氮装置,消化仪 实验十二:酪蛋白的制备(4学时) 基本要求:掌握从牛乳中制备酪蛋白的原理和方法。 主要内容:制备酪蛋白 操作要点:采用离心、抽滤等操作 从牛乳中分离制备酪蛋白 主要仪器设备:离心机,抽滤装置, 电炉,温度计,酸度计。 实验十三:pH对酶活性的影响(3学时) 基本要求:掌握测定酶最适即H的方法 主要内容:测定酶的最适pH 操作要 主要仪器设备:白滴板,恒温水浴 实验十四:温度对酶活性的影响(3学时) 基本要求:测定酶最适温度的方法。 主要内容: 测训定海的最活温度 操作要点: 酶反应过程的控制 主要仪器设备:恒温水浴,可调电炉 实验十五:血液中转氨酶活力的测定(2学时) 基本要求:掌握转氨酶活力测定的原理和方法。 主要内容:测定转氨酶的活力 操作要点 缚反应 过程的控制及分光光度计的操作 主要仪器设备:恒温水浴;分光光度计。 实验十六:羧甲基纤维素酶活力及pH对其活力的影响(6学时) 基本要求: 1.实验前,查找有关资料,熟悉该酶的基本特性、酶活力测定的基本原则与要求,写出实验方案 包括实验原理, 试剂的配制方法,实验的每一步骤及目的、 要求、时间安排、所需仪器、 试剂 2.按照自己的实验方案,配好相应试剂,准备好相应仪器,进行实验。具体任务是:制作还原糖 吸光度的标准曲线:测定PH对羧甲基纤维素酶活力的影响曲线及该酶的最适即H值;测定固体曲中的
操作要点:层析操作 主要仪器设备:层析缸(干燥),喷雾器,毛细管,电吹风,针,线,直尺。 实验八:甲醛滴定法测定氨基氮含量(3学时) 基本要求:掌握甲醛滴定法的原理及方法 主要内容:测定氨基氮含量 操作要点:滴定操作 主要仪器设备:研钵、微量碱式滴定管。 实验九:赖氨酸含量的测定(3学时) 基本要求:掌握分光光度计的使用及测定谷物中赖氨酸的方法 主要内容:测定谷物中赖氨酸 操作要点:分光光度计的使用 主要仪器设备:温水浴、分光光度计。 实验十:蛋白质含量测定——考马斯亮蓝G-250法(2学时) 基本要求:掌握考马斯亮蓝G250染色法测定蛋白质含量的原理和方法 主要内容:测定蛋白质含量 操作要点:分光光度计的使用 主要仪器设备:分光光度计,离心机,分析天平。 实验十一:蛋白质含量测定——微量凯氏定氮法(6学时) 基本要求:掌握凯氏定氮法的原理及凯氏定氮仪的使用。了解凯氏定氮法测定蛋白质含量的优缺点 及蛋白质系数的意义 主要内容:微量凯氏定氮法测定蛋白质含量 操作要点:消化、蒸馏、滴定操作 主要仪器设备:全套微量凯氏定氮装置,消化仪。 实验十二:酪蛋白的制备(4学时) 基本要求:掌握从牛乳中制备酪蛋白的原理和方法。 主要内容:制备酪蛋白 操作要点:采用离心、抽滤等操作,从牛乳中分离制备酪蛋白 主要仪器设备:离心机,抽滤装置,电炉,温度计,酸度计。 实验十三:pH对酶活性的影响(3学时) 基本要求:掌握测定酶最适pH的方法 主要内容:测定酶的最适pH 操作要点:酶反应过程的控制 主要仪器设备:白滴板,恒温水浴。 实验十四:温度对酶活性的影响(3学时) 基本要求:测定酶最适温度的方法。 主要内容:测定酶的最适温度 操作要点:酶反应过程的控制 主要仪器设备:恒温水浴,可调电炉。 实验十五:血液中转氨酶活力的测定(2学时) 基本要求:掌握转氨酶活力测定的原理和方法。 主要内容:测定转氨酶的活力 操作要点:酶反应过程的控制及分光光度计的操作 主要仪器设备:恒温水浴;分光光度计。 实验十六:羧甲基纤维素酶活力及pH对其活力的影响(6学时) 基本要求: 1.实验前,查找有关资料,熟悉该酶的基本特性、酶活力测定的基本原则与要求,写出实验方案, 包括实验原理,试剂的配制方法,实验的每一步骤及目的、要求、时间安排、所需仪器、试剂。 2.按照自己的实验方案,配好相应试剂,准备好相应仪器,进行实验。具体任务是:制作还原糖一 吸光度的标准曲线;测定PH对羧甲基纤维素酶活力的影响曲线及该酶的最适pH值;测定固体曲中的

羧甲基纤维素酶活力,误差要求小于±10%。 主要内容:制作还原糖-吸光度的标准曲线;测定PH对羧甲基纤维素酶活力的影响曲线及该酶的最适 pH值;测定固体曲中的羧甲基纤维素酶活力 操作要点:设计实验过程, 定酶的活性,确定最适条件。 主要仪器设备:电子天平,分光光度计;恒温水浴锅。 实验十七:DNA的提取及琼脂糖凝胶电泳(6学时) 基本要求:掌握DNA提取的方法与原理,掌握琼脂糖凝胶电泳的方法与原理。 主要内容:提取DNA,电泳检测 操作要点:DNA的提取分离过程,电泳操作,紫外观察 主要仪器设备:高速冷冻离心机、低温冰箱、紫外分光光度计、紫外灯、电泳仪、电泳槽、微量加 样器。 实验十八:SDS聚丙烯酰胺凝胶电泳(6学时) 基本要求:学习SDS聚丙烯酰胺 电泳技术 ,并用于蛋白质分子量的测定 主要内容: DS聚丙烯酰凝胶电泳定白质的分子量 操作要点:SDS聚丙烯酰胺凝胶电泳及染色观察 主要仪器设备:垂直板电泳槽,电泳仪,染色盘,脱色摇床。 实验十九:凝胶层折法分离蛋白质(6学时) 基本要水 :掌握凝胶层大 法分离 白质的原理和方法 主要内容:凝胶层析法分离蛋白质 操作要点:凝胶层析柱的填装及分离过程 主要仪器设备:层析柱,核酸蛋白检测仪,自动部分收集器」 实验二十:醋酸纤维素薄膜电泳(4学时) 基本要求 掌握醋酸纤维素薄膜电泳操作技术 测定人血清中各种蛋白质的相对百分含量】 主要内容:醋酸纤维素薄膜电泳测定血清中各种蛋白质的相对百分含量 操作要点:醋酸纤维素薄膜电泳 主要仪器设备:解剖镊子及竹夹子,点样器,直尺,电泳仪及电泳槽,玻璃板(12×12),光分 光光度计,吹风机,单面刀片, 实验 质粒DNA的 e 与酶切(6学时) 基本要求:学习和掌握碱裂解法提取质粒DNA的基本原理,掌握琼脂糖凝胶电泳检测质粒DNA的大 / 主要内容:携带质粒E.co的培养,碱裂解法小量制备质粒,质粒DNA的酶切及电泳检测 湿作要占·谨防核沉浪同☑,醇 一被在去 竖4SE双'¥器'学米串遂到连'149号隆驱型器 实验二十二:PCR基因扩增(6学时) 基本要求:掌握PC反应的基本原理及实验技术」 主要内容:携带重组质粒(含已知基因序列)E.co的培养,以菌体为模板进行聚合酶链式反应 PCR产物的电泳检测 操作要点:配制反应液过程中,防止外源DNA污染。 主要仪器设备:摇床,PCR扩增仪,琼脂糖凝胶电泳系统,疑胶扫描分析系统 实验二十三:大肠杆菌感受态细胞的制备与转化(6学时) 基本要求:掌握大肠杆菌感受态细胞的制备及转化的方法与技术 主要内容:大肠杆菌感受态 细胞的制备,转化方法 操作要点:感受态的制备过程尽量在低温下(0-4℃)进行。 主要仪器设备:摇床,超净工作台,制冰机,生化培养箱,高速冷动离心机,恒温水浴锅 实验二十四:哺乳动物基因组DNA的提取(6学时) 其木要求 掌握从鼠,肝中提取基因组DNA的方法 主要内容:鼠肝提取基因组DNA,所提取DNA的电泳检测及含量、纯度测定 操作要点:防止DNA酶的污染,防止基因组DNA的机械损伤
羧甲基纤维素酶活力,误差要求小于±10%。 主要内容:制作还原糖-吸光度的标准曲线;测定PH对羧甲基纤维素酶活力的影响曲线及该酶的最适 pH值;测定固体曲中的羧甲基纤维素酶活力。 操作要点:设计实验过程,测定酶的活性,确定最适条件。 主要仪器设备:电子天平,分光光度计;恒温水浴锅。 实验十七:DNA的提取及琼脂糖凝胶电泳(6学时) 基本要求:掌握DNA提取的方法与原理,掌握琼脂糖凝胶电泳的方法与原理。 主要内容:提取DNA,电泳检测。 操作要点:DNA的提取分离过程,电泳操作,紫外观察 主要仪器设备:高速冷冻离心机、低温冰箱、紫外分光光度计、紫外灯、电泳仪、电泳槽、微量加 样器。 实验十八:SDS聚丙烯酰胺凝胶电泳(6学时) 基本要求:学习SDS聚丙烯酰胺凝胶电泳技术,并用于蛋白质分子量的测定。 主要内容:SDS聚丙烯酰胺凝胶电泳测定蛋白质的分子量 操作要点:SDS聚丙烯酰胺凝胶电泳及染色观察 主要仪器设备:垂直板电泳槽,电泳仪,染色盘,脱色摇床。 实验十九:凝胶层析法分离蛋白质(6学时) 基本要求:掌握凝胶层析法分离蛋白质的原理和方法 主要内容:凝胶层析法分离蛋白质 操作要点:凝胶层析柱的填装及分离过程 主要仪器设备:层析柱,核酸蛋白检测仪,自动部分收集器。 实验二十:醋酸纤维素薄膜电泳(4学时) 基本要求:掌握醋酸纤维素薄膜电泳操作技术。测定人血清中各种蛋白质的相对百分含量。 主要内容:醋酸纤维素薄膜电泳测定血清中各种蛋白质的相对百分含量 操作要点:醋酸纤维素薄膜电泳 主要仪器设备:解剖镊子及竹夹子,点样器,直尺,电泳仪及电泳槽,玻璃板(12×12 m),光分 光光度计,吹风机,单面刀片。 实验二十一:质粒DNA的提取与酶切(6学时) 基本要求:学习和掌握碱裂解法提取质粒DNA的基本原理,掌握琼脂糖凝胶电泳检测质粒DNA的大 小。 主要内容:携带质粒E.coli的培养,碱裂解法小量制备质粒,质粒DNA的酶切及电泳检测 操作要点:谨防核酸沉淀同乙醇一起被弃去。 主要仪器设备:高速冷动离心机,台式冷冻离心机,琼脂糖凝胶电泳系统,摇床,凝胶扫描分析系 统 实验二十二:PCR基因扩增(6学时) 基本要求:掌握PCR反应的基本原理及实验技术。 主要内容:携带重组质粒(含已知基因序列)E.coli的培养,以菌体为模板进行聚合酶链式反应, PCR产物的电泳检测 操作要点:配制反应液过程中,防止外源DNA污染。 主要仪器设备:摇床,PCR扩增仪,琼脂糖凝胶电泳系统,凝胶扫描分析系统 实验二十三:大肠杆菌感受态细胞的制备与转化(6学时) 基本要求:掌握大肠杆菌感受态细胞的制备及转化的方法与技术。 主要内容:大肠杆菌感受态细胞的制备,转化方法 操作要点:感受态的制备过程尽量在低温下(0-4℃)进行。 主要仪器设备:摇床,超净工作台,制冰机,生化培养箱,高速冷动离心机,恒温水浴锅 实验二十四:哺乳动物基因组DNA的提取(6学时) 基本要求:掌握从鼠肝中提取基因组DNA的方法。 主要内容:鼠肝提取基因组DNA,所提取DNA的电泳检测及含量、纯度测定 操作要点:防止DNA酶的污染,防止基因组DNA的机械损伤
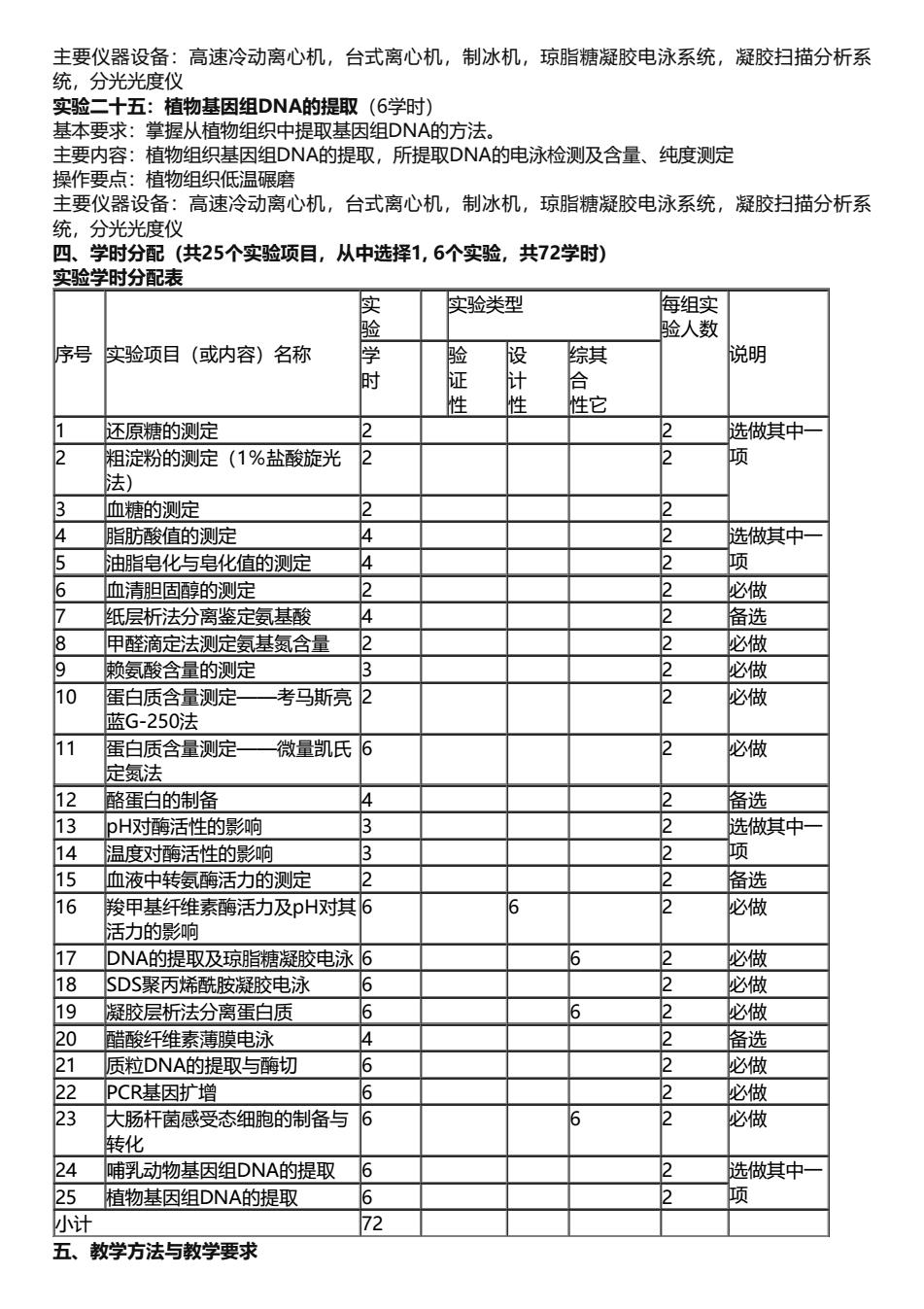
主要仪器设备:高速冷动离心机,台式离心机,制冰机,琼脂糖凝胶电泳系统,凝胶扫描分析系 统,分光光度仪 实 C十五:植物基因组DNA的提取(6学时 本要求:掌握从植物组织中提取基因组DNA的方法. 主要内容:植物组织基因组DNA的提取,所提取DNA的电泳检测及含量、纯度测定 操作要点:植物组织低温碾磨 主要仪器设备:高速冷动离心机,台式离心机,制冰机,琼脂糖凝胶电泳系统,凝胶扫描分析系 分光光度仪 四、学时分配(共25个实验项目,从中选择1,6个实验,共72学时) 实验学时分配表 实验类型 每组实 脸人数 序号实验项目(或内容)名称 设 综其 说明 时 证 合 性 性它 还原糖的测定 2 选做其中一 粗淀粉的测定(1%盐酸旋光 2 法) 血糖的测定 脂肪酸值的测定 洗做耳中一 油脂皂化与皂化值的测定 2 血清胆固醇的测定 2 以做 纸层析法分离鉴定氨基酸 2 备选 用醉商定法视侧定氖基短含最 必做 的氨酸令最的则定 必做 10 蛋白质含量测定 考马斯亮 2 必做 蓝G-250法 11 蛋白质含量测定 一微量凯氏 必做 足氨法 酪蛋白的制备 2 备选 73 pH对酶活性的影响 选做其中一 14 温度时海活性的影响 15 血液中转酶活力的定 备选 16 羧甲基纤维素酶活力及pH对 2 必做 活力的影响 17 DNA的提取及琼脂糖凝胶电泳 必做 8 SDS聚丙烯酰胺凝胶电泳 必做 9凝胶层析法分离蛋白质 必做 醋酸纤维素薄膜电泳 2 备选 21 质粒DNA的提取与晦切 必做 22PCR基因扩增 必做 大肠杆菌感受态细胞的制备与 必做 转化 哺乳动物基因组DNA的提取 洗做其中 植物基因组DNA的提取 项 小计 五、教学方法与教学要求
主要仪器设备:高速冷动离心机,台式离心机,制冰机,琼脂糖凝胶电泳系统,凝胶扫描分析系 统,分光光度仪 实验二十五:植物基因组DNA的提取(6学时) 基本要求:掌握从植物组织中提取基因组DNA的方法。 主要内容:植物组织基因组DNA的提取,所提取DNA的电泳检测及含量、纯度测定 操作要点:植物组织低温碾磨 主要仪器设备:高速冷动离心机,台式离心机,制冰机,琼脂糖凝胶电泳系统,凝胶扫描分析系 统,分光光度仪 四、学时分配(共25个实验项目,从中选择1, 6个实验,共72学时) 实验学时分配表 序号 实验项目(或内容)名称 实 验 实验类型 每组实 验人数 学 说明 时 验 证 性 设 计 性 综其 合 性它 1 还原糖的测定 2 2 选做其中一 2 粗淀粉的测定(1%盐酸旋光 项 法) 2 2 3 血糖的测定 2 2 4 脂肪酸值的测定 4 2 选做其中一 5 油脂皂化与皂化值的测定 4 2 项 6 血清胆固醇的测定 2 2 必做 7 纸层析法分离鉴定氨基酸 4 2 备选 8 甲醛滴定法测定氨基氮含量 2 2 必做 9 赖氨酸含量的测定 3 2 必做 10 蛋白质含量测定——考马斯亮 蓝G-250法 2 2 必做 11 蛋白质含量测定——微量凯氏 定氮法 6 2 必做 12 酪蛋白的制备 4 2 备选 13 pH对酶活性的影响 3 2 选做其中一 14 温度对酶活性的影响 3 2 项 15 血液中转氨酶活力的测定 2 2 备选 16 羧甲基纤维素酶活力及pH对其 活力的影响 6 6 2 必做 17 DNA的提取及琼脂糖凝胶电泳 6 6 2 必做 18 SDS聚丙烯酰胺凝胶电泳 6 2 必做 19 凝胶层析法分离蛋白质 6 6 2 必做 20 醋酸纤维素薄膜电泳 4 2 备选 21 质粒DNA的提取与酶切 6 2 必做 22 PCR基因扩增 6 2 必做 23 大肠杆菌感受态细胞的制备与 转化 6 6 2 必做 24 哺乳动物基因组DNA的提取 6 2 选做其中一 25 植物基因组DNA的提取 6 2 项 小计 72 五、教学方法与教学要求

实验中进行操作指导,实验前要求预习,实验中做好记录,实验报告要按照要求撰写;每组2人进行 实验,每次实验安排不超过34人;实验总学时为72学时
实验中进行操作指导,实验前要求预习,实验中做好记录,实验报告要按照要求撰写;每组2人进行 实验,每次实验安排不超过34人;实验总学时为72学时