
第十章 细胞外基质 EXTRACELLULAR MATRIX ECM
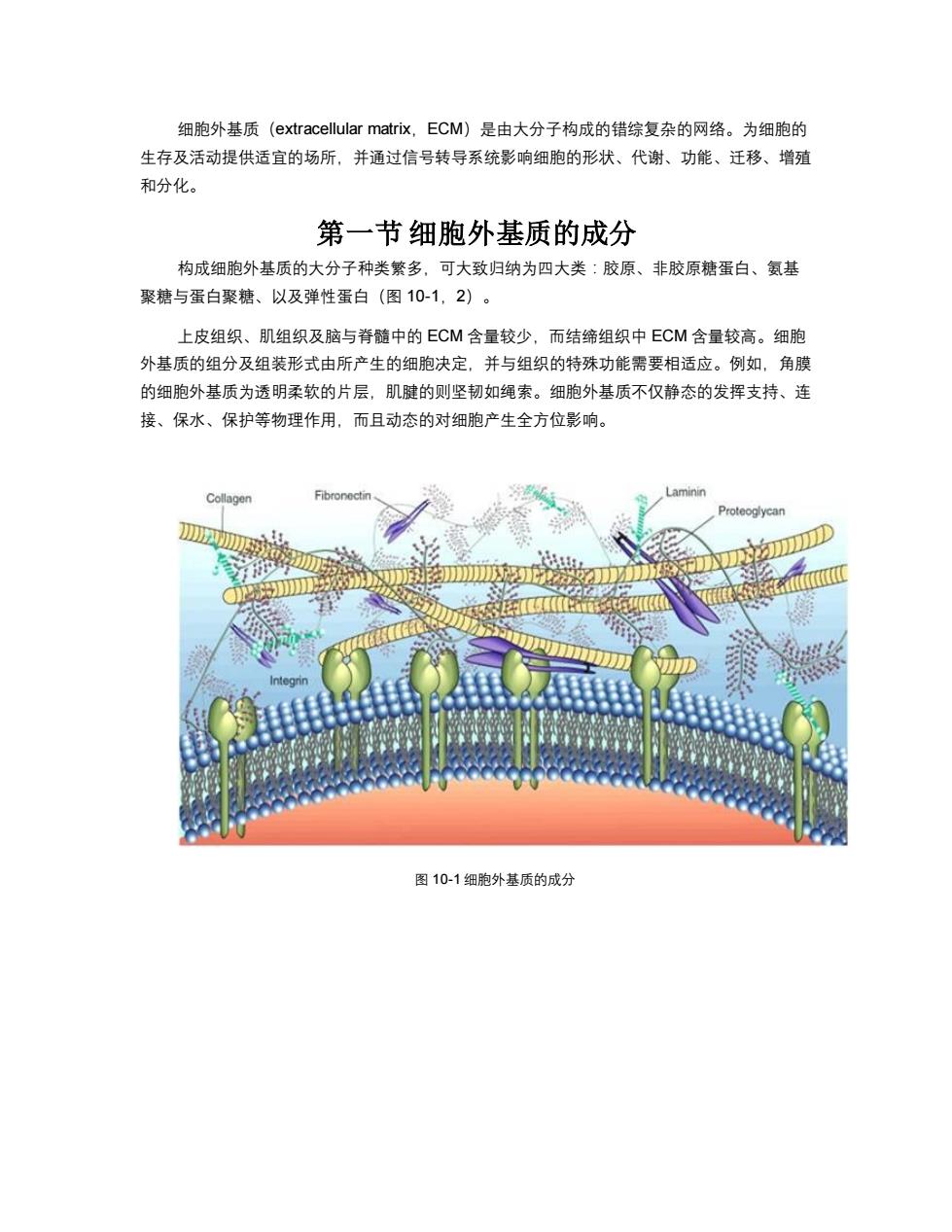
细胞外基质(extracellular matriⅸ,ECM)是由大分子构成的错综复杂的网络。为细胞的 生存及活动提供适宜的场所,并通过信号转导系统影响细胞的形状、代谢、功能、迁移、增殖 和分化。 第一节细胞外基质的成分 构成细胞外基质的大分子种类繁多,可大致归纳为四大类:胶原、非胶原糖蛋白、氨基 聚糖与蛋白聚糖、以及弹性蛋白(图10-1,2)。 上皮组织、肌组织及脑与脊髓中的ECM含量较少,而结缔组织中ECM含量较高。细胞 外基质的组分及组装形式由所产生的细胞决定,并与组织的特殊功能需要相适应。例如,角膜 的细胞外基质为透明柔软的片层,肌腱的则坚韧如绳索。细胞外基质不仅静态的发挥支持、连 接、保水、保护等物理作用,而且动态的对细胞产生全方位影响。 Collagen Fibronectin Laminin Proteoglycan D 图10-1细胞外基质的成分
细胞外基质(extracellular matrix,ECM)是由大分子构成的错综复杂的网络。为细胞的 生存及活动提供适宜的场所,并通过信号转导系统影响细胞的形状、代谢、功能、迁移、增殖 和分化。 第一节 细胞外基质的成分 构成细胞外基质的大分子种类繁多,可大致归纳为四大类:胶原、非胶原糖蛋白、氨基 聚糖与蛋白聚糖、以及弹性蛋白(图 10-1,2)。 上皮组织、肌组织及脑与脊髓中的 ECM 含量较少,而结缔组织中 ECM 含量较高。细胞 外基质的组分及组装形式由所产生的细胞决定,并与组织的特殊功能需要相适应。例如,角膜 的细胞外基质为透明柔软的片层,肌腱的则坚韧如绳索。细胞外基质不仅静态的发挥支持、连 接、保水、保护等物理作用,而且动态的对细胞产生全方位影响。 图 10-1 细胞外基质的成分
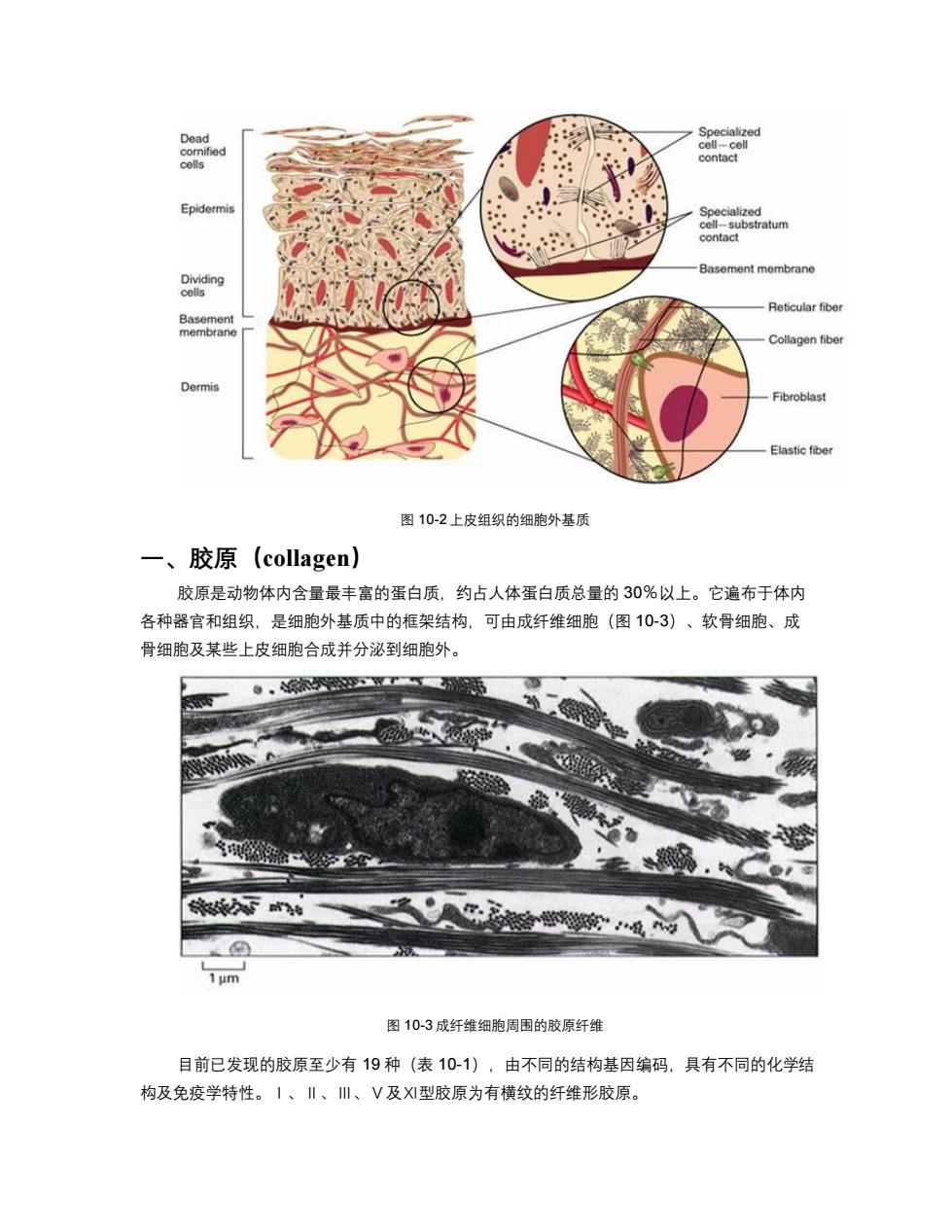
Dead Specialized cornified cell-cell contact cells Epidermis Specialized cell-substratum contact Basement membrane Dividing cells Reticular fiber Basement membrane Collagen fiber Dermis Fibroblast Elastic fiber 图10-2上皮组织的细胞外基质 一、胶原(collagen) 胶原是动物体内含量最丰富的蛋白质,约占人体蛋白质总量的30%以上。它遍布于体内 各种器官和组织,是细胞外基质中的框架结构,可由成纤维细胞(图10-3)、软骨细胞、成 骨细胞及某些上皮细胞合成并分泌到细胞外。 图10-3成纤维细胞周围的胶原纤维 目前已发现的胶原至少有19种(表10-1),由不同的结构基因编码,具有不同的化学结 构及免疫学特性。〡、‖、川、V及X型胶原为有横纹的纤维形胶原
图 10-2 上皮组织的细胞外基质 一、胶原(collagen) 胶原是动物体内含量最丰富的蛋白质,约占人体蛋白质总量的 30%以上。它遍布于体内 各种器官和组织,是细胞外基质中的框架结构,可由成纤维细胞(图 10-3)、软骨细胞、成 骨细胞及某些上皮细胞合成并分泌到细胞外。 图 10-3 成纤维细胞周围的胶原纤维 目前已发现的胶原至少有 19 种(表 10-1),由不同的结构基因编码,具有不同的化学结 构及免疫学特性。Ⅰ、Ⅱ、Ⅲ、Ⅴ及Ⅺ型胶原为有横纹的纤维形胶原

各型胶原都是由三条相同或不同的肽链形成三股螺旋,含有三种结构:螺旋区,非螺旋 区及球形结构域。其中!型胶原的结构最为典型。 表10-1胶原的类型 Approximate Type Fiber Length Occurence 1 300nm Skin,teeth,bones,tendoms,cornea 0 300nm cartilage,invertebral discs,notochord 10 300nm skin tendons,blood vessel/uterine walls IV 390nm basal laminae,kidney glomerulus, eye lens capsule V 300nm cornea,interstitial tissues VI 105nm cartilagenous/noncartilagenous connective tissues VI 450nm skin's basal lamine,tongue,cornea, sclera,amnion VII 150nm minor constituent of cartilage,sclera 200nm minor constituent of cartilage X 150nm minor constituent of cartilage,in cartilagenous regions undergoing transition to bone Ⅻ Unknown minor constituent of cartilage 11 Unknown minor constituent of tendons X11 Unknown endothelial tissues XIV Unknown fetal skin and tendon 图10-4胶原的结构(左模式图,右电镜照片)
各型胶原都是由三条相同或不同的肽链形成三股螺旋,含有三种结构:螺旋区,非螺旋 区及球形结构域。其中Ⅰ型胶原的结构最为典型。 表 10-1 胶原的类型 图 10-4 胶原的结构(左模式图,右电镜照片)

丨型胶原的原纤维平行排列成较粗大的束,成为光镜下可见的胶原纤维,抗张强度超过 钢筋。其三股螺旋由二条a1(1)链及一条a2(I)链构成。每条α链约含1050个氨基酸残 基,由重复的Gy-X-Y序列构成。X常为Pr0(脯氨酸),Y常为羟脯氨酸或羟赖氨酸残基。 重复的G引y-X-Y序列使α链卷曲为左手螺旋,每圈含3个氨基酸残基。三股这样的螺旋再相互 盘绕成右手超螺旋,即原胶原。 原胶原分子间通过侧向共价交联,相互呈阶梯式有序排列聚合成直径50~200m、长 150nm至数微米的原纤维,在电镜下可见间隔67nm的横纹。胶原原纤维中的交联键是由侧 向相邻的赖氨酸或羟赖氨酸残基氧化后所产生的两个醛基间进行缩合而形成的。 原胶原共价交联后成为具有抗张强度的不溶性胶原。胚胎及新生儿的胶原因缺乏分子间 的交联而易于抽提。随年龄增长,交联日益增多,皮肤、血管及各种组织变得僵硬,成为老化 的一个重要特征。 人α1(1)链的基因含51个外显子,因而基因转录后的拼接十分复杂。翻译出的肽链称 为前α链,其两端各具有一段不含G引y-X-Y序列的前肽。三条前α链的C端前肽借二硫键形 成链间交联,使三条前α链“对齐”排列。然后从C端向N端形成三股螺旋结构。前肽部分则呈 非螺旋卷曲。带有前肽的三股螺旋胶原分子称为前胶原(procollagen)。胶原变性后不能自 然复性重新形成三股螺旋结构,原因是成熟胶原分子的肽链不含前肽,故而不能再进行“对齐” 排列。 前α链在粗面内质网上合成,并在形成三股螺旋之前于脯氨酸及赖氨酸残基上进行羟基 化修饰,脯氨酸残基的羟化反应是在与膜结合的脯氨酰-4羟化酶及脯氨酰-3羟化酶的催化下 进行的。维生素C是这两种酶所必需的辅助因子。维生素C缺乏导致胶原的羟化反应不能充 分进行,不能形成正常的胶原原纤维,结果非羟化的前α链在细胞内被降解。因而,膳食中缺 乏维生素C可导致血管、肌腱、皮肤变脆,易出血,称为坏血病。 二、纤粘连蛋白(fibronectin,FN) FN是一种大型的糖蛋白,存在于所有脊椎动物,分子含糖4.5-9.5%,糖链结构依组织 细胞来源及分化状态而异。FN可将细胞连接到细胞外基质上(图10-5)
Ⅰ型胶原的原纤维平行排列成较粗大的束,成为光镜下可见的胶原纤维,抗张强度超过 钢筋。其三股螺旋由二条 α1(Ⅰ)链及一条 α2(Ⅰ)链构成。每条 α 链约含 1050 个氨基酸残 基,由重复的 Gly-X-Y 序列构成。X 常为 Pro(脯氨酸),Y 常为羟脯氨酸或羟赖氨酸残基。 重复的 Gly-X-Y 序列使 α 链卷曲为左手螺旋,每圈含 3 个氨基酸残基。三股这样的螺旋再相互 盘绕成右手超螺旋,即原胶原。 原胶原分子间通过侧向共价交联,相互呈阶梯式有序排列聚合成直径 50~200nm、长 150nm 至数微米的原纤维,在电镜下可见间隔 67nm 的横纹。胶原原纤维中的交联键是由侧 向相邻的赖氨酸或羟赖氨酸残基氧化后所产生的两个醛基间进行缩合而形成的。 原胶原共价交联后成为具有抗张强度的不溶性胶原。胚胎及新生儿的胶原因缺乏分子间 的交联而易于抽提。随年龄增长,交联日益增多,皮肤、血管及各种组织变得僵硬,成为老化 的一个重要特征。 人 α1(Ⅰ)链的基因含 51 个外显子,因而基因转录后的拼接十分复杂。翻译出的肽链称 为前 α 链,其两端各具有一段不含 Gly-X-Y 序列的前肽。三条前 α 链的 C 端前肽借二硫键形 成链间交联,使三条前 α 链“对齐”排列。然后从 C 端向 N 端形成三股螺旋结构。前肽部分则呈 非螺旋卷曲。带有前肽的三股螺旋胶原分子称为前胶原(procollagen)。胶原变性后不能自 然复性重新形成三股螺旋结构,原因是成熟胶原分子的肽链不含前肽,故而不能再进行“对齐” 排列。 前 α 链在粗面内质网上合成,并在形成三股螺旋之前于脯氨酸及赖氨酸残基上进行羟基 化修饰,脯氨酸残基的羟化反应是在与膜结合的脯氨酰-4 羟化酶及脯氨酰-3 羟化酶的催化下 进行的。维生素 C 是这两种酶所必需的辅助因子。维生素 C 缺乏导致胶原的羟化反应不能充 分进行,不能形成正常的胶原原纤维,结果非羟化的前 α 链在细胞内被降解。因而,膳食中缺 乏维生素 C 可导致血管、肌腱、皮肤变脆,易出血,称为坏血病。 二、纤粘连蛋白(fibronectin,FN) FN 是一种大型的糖蛋白,存在于所有脊椎动物,分子含糖 4.5-9.5%,糖链结构依组织 细胞来源及分化状态而异。FN 可将细胞连接到细胞外基质上(图 10-5)
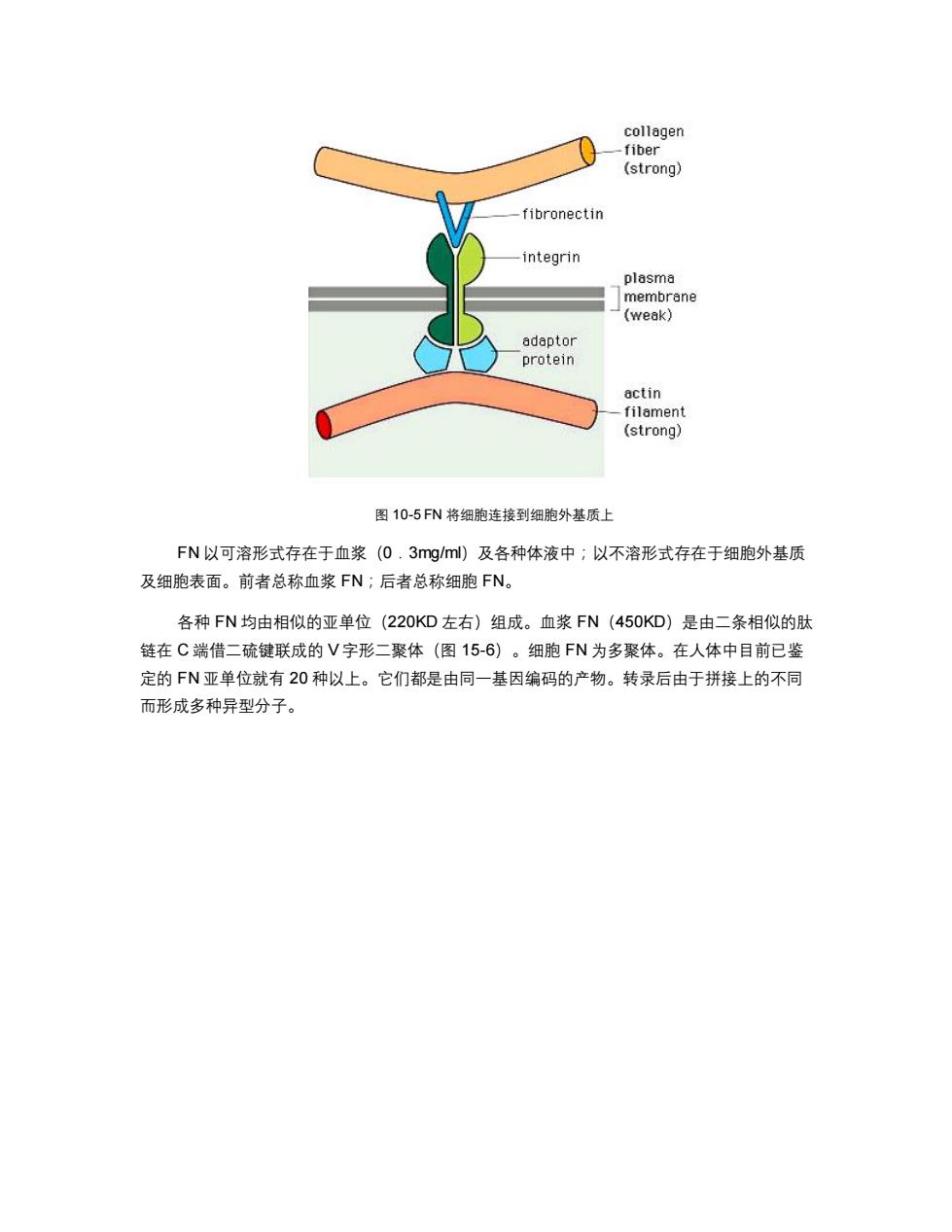
collagen fiber (strong) fibronectin integrin plasma membrane (weak) adaptor protein actin filament (strong) 图10-5FN将细胞连接到细胞外基质上 FN以可溶形式存在于血浆(0.3 mg/ml)及各种体液中;以不溶形式存在于细胞外基质 及细胞表面。前者总称血浆FN;后者总称细胞FN。 各种FN均由相似的亚单位(220KD左右)组成。血浆FN(450KD)是由二条相似的肽 链在C端借二硫键联成的V字形二聚体(图15-6)。细胞FN为多聚体。在人体中目前已鉴 定的FN亚单位就有20种以上。它们都是由同一基因编码的产物。转录后由于拼接上的不同 而形成多种异型分子
图 10-5 FN 将细胞连接到细胞外基质上 FN 以可溶形式存在于血浆(0.3mg/ml)及各种体液中;以不溶形式存在于细胞外基质 及细胞表面。前者总称血浆 FN;后者总称细胞 FN。 各种 FN 均由相似的亚单位(220KD 左右)组成。血浆 FN(450KD)是由二条相似的肽 链在 C 端借二硫键联成的 V 字形二聚体(图 15-6)。细胞 FN 为多聚体。在人体中目前已鉴 定的 FN 亚单位就有 20 种以上。它们都是由同一基因编码的产物。转录后由于拼接上的不同 而形成多种异型分子
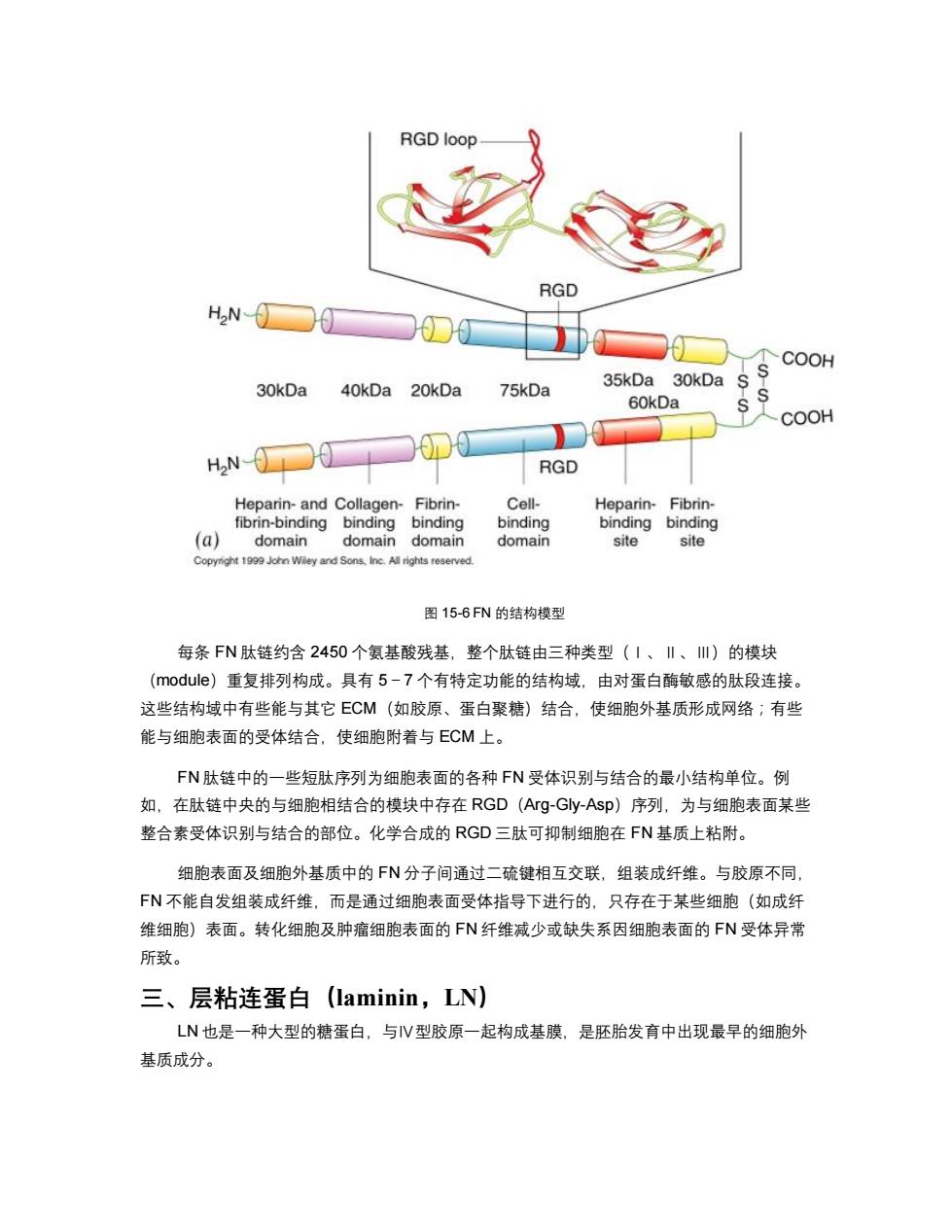
RGD loop RGD HN- TCOOH 30kDa 75kDa 35kDa 30kDa 40kDa 20kDa 60kDa COOH H2N RGD Heparin-and Collagen-Fibrin- Cell- Heparin-Fibrin- fibrin-binding binding binding binding binding binding (a) domain domain domain domain site site Copynight 1999 John Wley and Sons,Inc.All rights reserved. 图15-6FN的结构模型 每条FN肽链约含2450个氨基酸残基,整个肽链由三种类型(1、‖、Ⅲ)的模块 (module)重复排列构成。具有5-7个有特定功能的结构域,由对蛋白酶敏感的肽段连接。 这些结构域中有些能与其它ECM(如胶原、蛋白聚糖)结合,使细胞外基质形成网络;有些 能与细胞表面的受体结合,使细胞附着与ECM上。 FN肽链中的一些短肽序列为细胞表面的各种FN受体识别与结合的最小结构单位。例 如,在肽链中央的与细胞相结合的模块中存在RGD(Arg-Gly-Asp)序列,为与细胞表面某些 整合素受体识别与结合的部位。化学合成的RGD三肽可抑制细胞在FN基质上粘附。 细胞表面及细胞外基质中的FN分子间通过二硫键相互交联,组装成纤维。与胶原不同 FN不能自发组装成纤维,而是通过细胞表面受体指导下进行的,只存在于某些细胞(如成纤 维细胞)表面。转化细胞及肿瘤细胞表面的FN纤维减少或缺失系因细胞表面的FN受体异常 所致。 三、层粘连蛋白(laminin,LN) LN也是一种大型的糖蛋白,与V型胶原一起构成基膜,是胚胎发育中出现最早的细胞外 基质成分
图 15-6 FN 的结构模型 每条 FN 肽链约含 2450 个氨基酸残基,整个肽链由三种类型(Ⅰ、Ⅱ、Ⅲ)的模块 (module)重复排列构成。具有 5-7 个有特定功能的结构域,由对蛋白酶敏感的肽段连接。 这些结构域中有些能与其它 ECM(如胶原、蛋白聚糖)结合,使细胞外基质形成网络;有些 能与细胞表面的受体结合,使细胞附着与 ECM 上。 FN 肽链中的一些短肽序列为细胞表面的各种 FN 受体识别与结合的最小结构单位。例 如,在肽链中央的与细胞相结合的模块中存在 RGD(Arg-Gly-Asp)序列,为与细胞表面某些 整合素受体识别与结合的部位。化学合成的 RGD 三肽可抑制细胞在 FN 基质上粘附。 细胞表面及细胞外基质中的 FN 分子间通过二硫键相互交联,组装成纤维。与胶原不同, FN 不能自发组装成纤维,而是通过细胞表面受体指导下进行的,只存在于某些细胞(如成纤 维细胞)表面。转化细胞及肿瘤细胞表面的 FN 纤维减少或缺失系因细胞表面的 FN 受体异常 所致。 三、层粘连蛋白(laminin,LN) LN 也是一种大型的糖蛋白,与Ⅳ型胶原一起构成基膜,是胚胎发育中出现最早的细胞外 基质成分

LN分子由一条重链(α)和二条轻链(B、Y)借二硫键交联而成,外形呈十字形,三条 短臂各由三条肽链的N端序列构成。每一短臂包括二个球区及二个短杆区,长臂也由杆区及 球区构成(图10-7)。 A chain(400,000 MW) B2 chain (205,000MW) Binds to sulfated lipids B1 chain (215,000MW) Binds to collagen, Binds to type IV sulfated lipids collagen a-Helical Binds to integrins and entactin coiled coil Binds to neurites Heparan sulfate binding site 25 nm 图10-7LN的结构模型 LN分子中至少存在8个与细胞结合的位点。例如,在长臂靠近球区的。链上有KVAV 五肽序列可与神经细胞结合,并促进神经生长。鼠LNa1链上的RGD序列,可与aVβ3整合 素结合。 现已发现7种LN分子,8种亚单位(a1,a2,a3,B1,B2,β3,Y1,Y2),与FN不同的是,这 8种亚单位分别由8个结构基因编码。 LN是含糖量很高(占15-28%)的糖蛋白,具有50条左右N连接的糖链,是迄今所知 糖链结构最复杂的糖蛋白。而且LN的多种受体是识别与结合其糖链结构的。 基膜是上皮细胞下方一层柔软的特化的细胞外基质,也存在于肌肉、脂肪和许旺细胞 (schwann cell)周围。它不仅仅起保护和过滤作用,还决定细胞的极性,影响细胞的代谢、 存活、迁移、增殖和分化
LN 分子由一条重链(α)和二条轻链(β、γ)借二硫键交联而成,外形呈十字形,三条 短臂各由三条肽链的 N 端序列构成。每一短臂包括二个球区及二个短杆区,长臂也由杆区及 球区构成(图 10-7)。 图 10-7 LN 的结构模型 LN 分子中至少存在 8 个与细胞结合的位点。例如,在长臂靠近球区的。链上有 IKVAV 五肽序列可与神经细胞结合,并促进神经生长。鼠 LNα1 链上的 RGD 序列,可与 αvβ3 整合 素结合。 现已发现 7 种 LN 分子,8 种亚单位(α1,α2,α3,β1,β2,β3,γ1,γ2),与 FN 不同的是,这 8 种亚单位分别由 8 个结构基因编码。 LN 是含糖量很高(占 15-28%)的糖蛋白,具有 50 条左右 N 连接的糖链,是迄今所知 糖链结构最复杂的糖蛋白。而且 LN 的多种受体是识别与结合其糖链结构的。 基膜是上皮细胞下方一层柔软的特化的细胞外基质,也存在于肌肉、脂肪和许旺细胞 (schwann cell)周围。它不仅仅起保护和过滤作用,还决定细胞的极性,影响细胞的代谢、 存活、迁移、增殖和分化
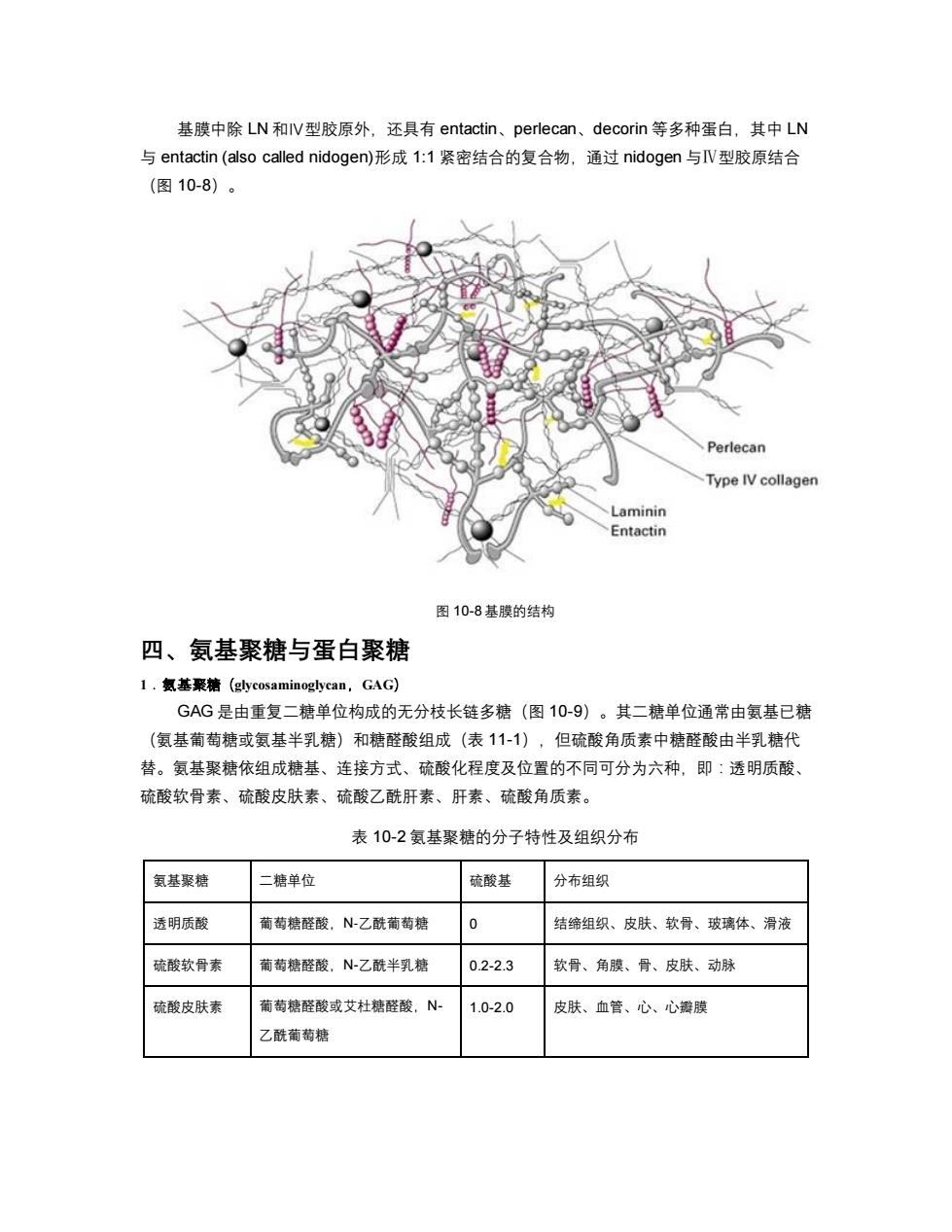
基膜中除LN和IV型胶原外,还具有entactin、perlecan、decorin等多种蛋白,其中LN 与entactin(also called nidogen)形成1:1紧密结合的复合物,通过nidogen与V型胶原结合 (图10-8)。 Perlecan Type IV collagen Laminin Entactin 图10-8基膜的结构 四、氨基聚糖与蛋白聚糖 1.氨基聚糖(glycosaminoglycan,GAG) GAG是由重复二糖单位构成的无分枝长链多糖(图10-9)。其二糖单位通常由氨基已糖 (氨基葡萄糖或氨基半乳糖)和糖醛酸组成(表11-1),但硫酸角质素中糖醛酸由半乳糖代 替。氨基聚糖依组成糖基、连接方式、硫酸化程度及位置的不同可分为六种,即:透明质酸、 硫酸软骨素、硫酸皮肤素、硫酸乙酰肝素、肝素、硫酸角质素。 表10-2氨基聚糖的分子特性及组织分布 氨基聚糖 二糖单位 硫酸基 分布组织 透明质酸 葡萄糖醛酸,N-乙酰葡萄糖 0 结缔组织、皮肤、软骨、玻璃体、滑液 硫酸软骨素 葡萄糖醛酸,N-乙酰半乳糖 0.2-2.3 软骨、角膜、骨、皮肤、动脉 硫酸皮肤素 葡萄糖醛酸或艾杜糖醛酸,N 1.0-2.0 皮肤、血管、心、心瓣膜 乙酰葡萄糖
基膜中除 LN 和Ⅳ型胶原外,还具有 entactin、perlecan、decorin 等多种蛋白,其中 LN 与 entactin (also called nidogen)形成 1:1 紧密结合的复合物,通过 nidogen 与Ⅳ型胶原结合 (图 10-8)。 图 10-8 基膜的结构 四、氨基聚糖与蛋白聚糖 1.氨基聚糖(glycosaminoglycan,GAG) GAG 是由重复二糖单位构成的无分枝长链多糖(图 10-9)。其二糖单位通常由氨基已糖 (氨基葡萄糖或氨基半乳糖)和糖醛酸组成(表 11-1),但硫酸角质素中糖醛酸由半乳糖代 替。氨基聚糖依组成糖基、连接方式、硫酸化程度及位置的不同可分为六种,即:透明质酸、 硫酸软骨素、硫酸皮肤素、硫酸乙酰肝素、肝素、硫酸角质素。 表 10-2 氨基聚糖的分子特性及组织分布 氨基聚糖 二糖单位 硫酸基 分布组织 透明质酸 葡萄糖醛酸,N-乙酰葡萄糖 0 结缔组织、皮肤、软骨、玻璃体、滑液 硫酸软骨素 葡萄糖醛酸,N-乙酰半乳糖 0.2-2.3 软骨、角膜、骨、皮肤、动脉 硫酸皮肤素 葡萄糖醛酸或艾杜糖醛酸,N- 乙酰葡萄糖 1.0-2.0 皮肤、血管、心、心瓣膜
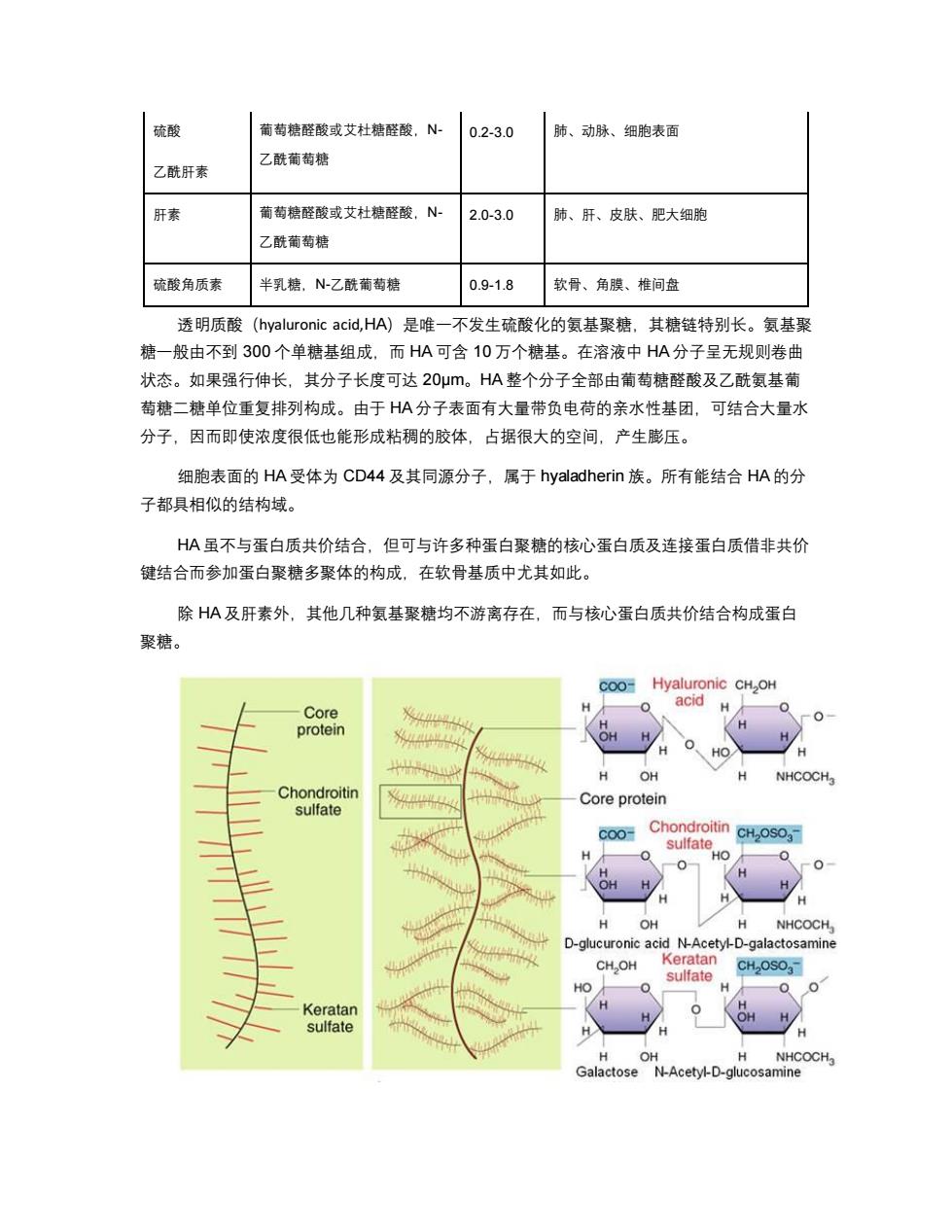
硫酸 葡萄糖醛酸或艾杜糖醛酸,八- 0.2-3.0 肺、 动脉、细胞表面 乙酰葡萄糖 乙酰肝素 肝素 葡萄糖醛酸或艾杜糖醛酸,N- 2.0-3.0 肺、肝、皮肤、肥大细胞 乙酰葡萄糖 硫酸角质素 半乳糖,N-乙酰葡萄糖 0.9-1.8 软骨、角膜、椎间盘 透明质酸(hyaluronic acid,HA)是唯一不发生硫酸化的氨基聚糖,其糖链特别长。氨基聚 糖一般由不到300个单糖基组成,而HA可含10万个糖基。在溶液中HA分子呈无规则卷曲 状态。如果强行伸长,其分子长度可达20μm。HA整个分子全部由葡萄糖醛酸及乙酰氨基葡 萄糖二糖单位重复排列构成。由于HA分子表面有大量带负电荷的亲水性基团,可结合大量水 分子,因而即使浓度很低也能形成粘稠的胶体,占据很大的空间,产生膨压。 细胞表面的HA受体为CD44及其同源分子,属于hyaladherin族。所有能结合HA的分 子都具相似的结构域。 HA虽不与蛋白质共价结合,但可与许多种蛋白聚糖的核心蛋白质及连接蛋白质借非共价 键结合而参加蛋白聚糖多聚体的构成,在软骨基质中尤其如此。 除HA及肝素外,其他几种氨基聚糖均不游离存在,而与核心蛋白质共价结合构成蛋白 聚糖。 c00 Hyaluronic CH,OH Core H acid H protein H OH H NHCOCH3 Chondroitin Core protein sulfate coo- Chondroitin CH2OSO3- sulfat H HO 0 0 OH OH NHCOCH, D-glucuronic acid N-Acetyl-D-galactosamine CH.OH Keratan CH2OSO3 sulfate HO Keratan sulfate H OH H NHCOCH Galactose N-Acetyl-D-glucosamine
硫酸 乙酰肝素 葡萄糖醛酸或艾杜糖醛酸,N- 乙酰葡萄糖 0.2-3.0 肺、动脉、细胞表面 肝素 葡萄糖醛酸或艾杜糖醛酸,N- 乙酰葡萄糖 2.0-3.0 肺、肝、皮肤、肥大细胞 硫酸角质素 半乳糖,N-乙酰葡萄糖 0.9-1.8 软骨、角膜、椎间盘 透明质酸(hyaluronic acid,HA)是唯一不发生硫酸化的氨基聚糖,其糖链特别长。氨基聚 糖一般由不到 300 个单糖基组成,而 HA 可含 10 万个糖基。在溶液中 HA 分子呈无规则卷曲 状态。如果强行伸长,其分子长度可达 20μm。HA 整个分子全部由葡萄糖醛酸及乙酰氨基葡 萄糖二糖单位重复排列构成。由于 HA 分子表面有大量带负电荷的亲水性基团,可结合大量水 分子,因而即使浓度很低也能形成粘稠的胶体,占据很大的空间,产生膨压。 细胞表面的 HA 受体为 CD44 及其同源分子,属于 hyaladherin 族。所有能结合 HA 的分 子都具相似的结构域。 HA 虽不与蛋白质共价结合,但可与许多种蛋白聚糖的核心蛋白质及连接蛋白质借非共价 键结合而参加蛋白聚糖多聚体的构成,在软骨基质中尤其如此。 除 HA 及肝素外,其他几种氨基聚糖均不游离存在,而与核心蛋白质共价结合构成蛋白 聚糖