
第九章细胞骨架 THE CYTOSKELETON
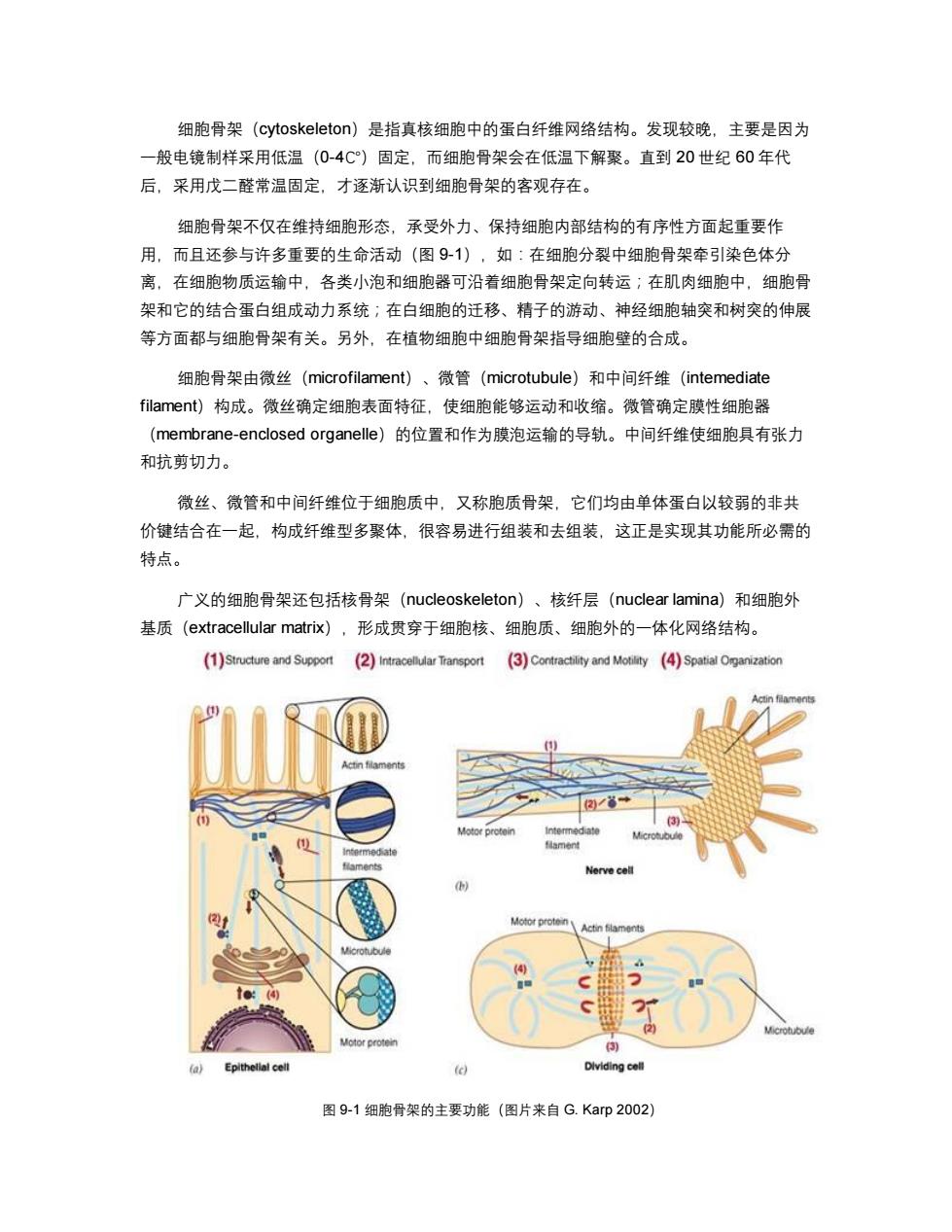
细胞骨架(cytoskeleton)是指真核细胞中的蛋白纤维网络结构。发现较晚,主要是因为 一般电镜制样采用低温(0-4C)固定,而细胞骨架会在低温下解聚。直到20世纪60年代 后,采用戊二醛常温固定,才逐渐认识到细胞骨架的客观存在。 细胞骨架不仅在维持细胞形态,承受外力、保持细胞内部结构的有序性方面起重要作 用,而且还参与许多重要的生命活动(图91),如:在细胞分裂中细胞骨架牵引染色体分 离,在细胞物质运输中,各类小泡和细胞器可沿着细胞骨架定向转运;在肌肉细胞中,细胞骨 架和它的结合蛋白组成动力系统;在白细胞的迁移、精子的游动、神经细胞轴突和树突的伸展 等方面都与细胞骨架有关。另外,在植物细胞中细胞骨架指导细胞壁的合成。 细胞骨架由微丝(microfilament)、微管(microtubule)和中间纤维(intemediate filament)构成。微丝确定细胞表面特征,使细胞能够运动和收缩。微管确定膜性细胞器 (membrane-enclosed organelle)的位置和作为膜泡运输的导轨。中间纤维使细胞具有张力 和抗剪切力。 微丝、微管和中间纤维位于细胞质中,又称胞质骨架,它们均由单体蛋白以较弱的非共 价键结合在一起,构成纤维型多聚体,很容易进行组装和去组装,这正是实现其功能所必需的 特点。 广义的细胞骨架还包括核骨架(nucleoskeleton)、核纤层(nuclear lamina)和细胞外 基质(extracellular matriⅸ),形成贯穿于细胞核、细胞质、细胞外的一体化网络结构。 (1)Structure and Support (2)Intracellular Transport (3Contractility and Motility (4)Spatial Omganization ctin filaments Motoe protein ntermed ate Actin flaments Microtubule 2 Motor protein (a) Epithelial cell (c) Dlviding celi 图9-1细胞骨架的主要功能(图片来自G.Karp2002)
细胞骨架(cytoskeleton)是指真核细胞中的蛋白纤维网络结构。发现较晚,主要是因为 一般电镜制样采用低温(0-4℃)固定,而细胞骨架会在低温下解聚。直到 20 世纪 60 年代 后,采用戊二醛常温固定,才逐渐认识到细胞骨架的客观存在。 细胞骨架不仅在维持细胞形态,承受外力、保持细胞内部结构的有序性方面起重要作 用,而且还参与许多重要的生命活动(图 9-1),如:在细胞分裂中细胞骨架牵引染色体分 离,在细胞物质运输中,各类小泡和细胞器可沿着细胞骨架定向转运;在肌肉细胞中,细胞骨 架和它的结合蛋白组成动力系统;在白细胞的迁移、精子的游动、神经细胞轴突和树突的伸展 等方面都与细胞骨架有关。另外,在植物细胞中细胞骨架指导细胞壁的合成。 细胞骨架由微丝(microfilament)、微管(microtubule)和中间纤维(intemediate filament)构成。微丝确定细胞表面特征,使细胞能够运动和收缩。微管确定膜性细胞器 (membrane-enclosed organelle)的位置和作为膜泡运输的导轨。中间纤维使细胞具有张力 和抗剪切力。 微丝、微管和中间纤维位于细胞质中,又称胞质骨架,它们均由单体蛋白以较弱的非共 价键结合在一起,构成纤维型多聚体,很容易进行组装和去组装,这正是实现其功能所必需的 特点。 广义的细胞骨架还包括核骨架(nucleoskeleton)、核纤层(nuclear lamina)和细胞外 基质(extracellular matrix),形成贯穿于细胞核、细胞质、细胞外的一体化网络结构。 图 9-1 细胞骨架的主要功能(图片来自 G. Karp 2002)

第一节微丝 微丝(microfilament,MF)是由肌动蛋白(actin)组成的直径约7nm的骨架纤维,又称肌 动蛋白纤维actin filament。微丝和它的结合蛋白(association protion)以及肌球蛋白 (yosin)三者构成化学机械系统,利用化学能产生机械运动。 一、分子结构 根据等电点的不同可将高等动物细胞内的肌动蛋白分为3类,α分布于各种肌肉细胞中, B和Y分布于肌细胞和非肌细胞中。 肌动蛋白纤维是由两条线性排列的肌动蛋白链形成的螺旋,状如双线捻成的绳子(图9 2、3),肌动蛋白的单体为球形分子,称为球形肌动蛋白G-actin(globular actin),它的多聚 体称为纤维形肌动蛋白F-actin(fibrous actin)。 (+)】 Pointed Barbed end end 图92微丝纤维的负染电镜照片 图9-3微丝纤维结构模型 肌动蛋白在进化上高度保守,酵母和兔子肌肉的肌动蛋白有88%的同源性。不同类型肌 肉细胞的α-肌动蛋白分子一级结构(约400个氨基酸残基)仅相差4~6个氨基酸残基,B-肌 动蛋白或Y-肌动蛋白与a-横纹肌肌动蛋白相差约25个氨基酸残基。 多数简单的真核生物,如酵母或粘菌,含单个肌动蛋白基因,仅合成一种肌动蛋白。真 核生物含有多个肌动蛋白基因,如海胆有11个,网柄菌属(Dictyostelium)有17个,在某些植 物中有60个。肌动蛋白要经过翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。 在适宜的温度,存在ATP、K、Mg+离子的条件下,肌动蛋白单体可自组装为纤维
第一节 微丝 微丝(microfilament,MF)是由肌动蛋白(actin)组成的直径约 7nm 的骨架纤维,又称肌 动蛋白纤维 actin filament。微丝和它的结合蛋白(association protion)以及肌球蛋白 (myosin)三者构成化学机械系统,利用化学能产生机械运动。 一、分子结构 根据等电点的不同可将高等动物细胞内的肌动蛋白分为 3 类,α 分布于各种肌肉细胞中, β 和 γ 分布于肌细胞和非肌细胞中。 肌动蛋白纤维是由两条线性排列的肌动蛋白链形成的螺旋,状如双线捻成的绳子(图 9- 2、3),肌动蛋白的单体为球形分子,称为球形肌动蛋白 G-actin(globular actin),它的多聚 体称为纤维形肌动蛋白 F-actin (fibrous actin)。 图 9-2 微丝纤维的负染电镜照片 图 9-3 微丝纤维结构模型 肌动蛋白在进化上高度保守,酵母和兔子肌肉的肌动蛋白有 88%的同源性。不同类型肌 肉细胞的 α-肌动蛋白分子一级结构(约 400 个氨基酸残基)仅相差 4~6 个氨基酸残基,β-肌 动蛋白或 γ-肌动蛋白与 α-横纹肌肌动蛋白相差约 25 个氨基酸残基。 多数简单的真核生物,如酵母或粘菌,含单个肌动蛋白基因,仅合成一种肌动蛋白。真 核生物含有多个肌动蛋白基因,如海胆有 11 个,网柄菌属(Dictyostelium)有 17 个,在某些植 物中有 60 个。肌动蛋白要经过翻译后修饰,如 N-端乙酰化或组氨酸残基的甲基化。 在适宜的温度,存在 ATP、K+、Mg2+离子的条件下,肌动蛋白单体可自组装为纤维
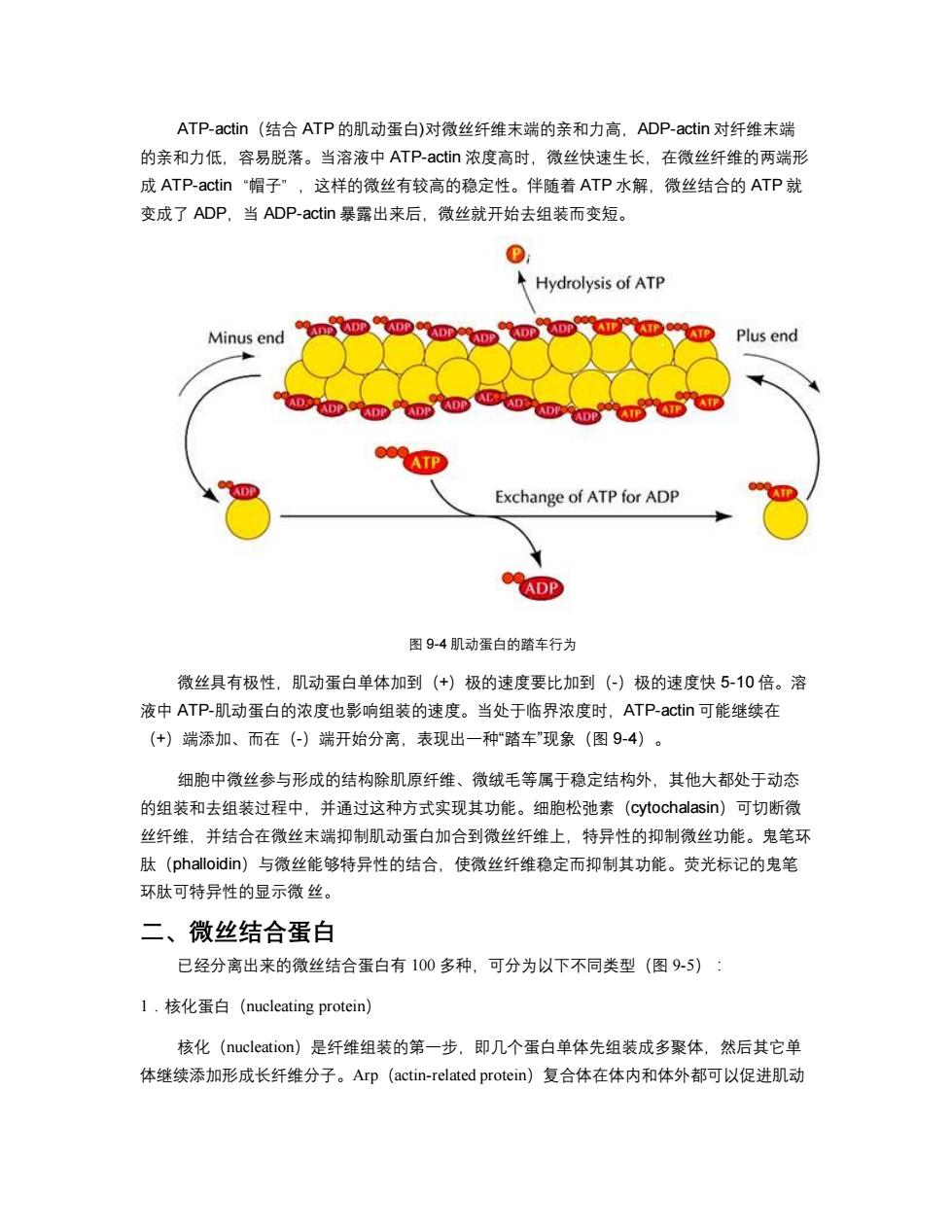
ATP-actin(结合ATP的肌动蛋白)对微丝纤维末端的亲和力高,ADP-actin对纤维末端 的亲和力低,容易脱落。当溶液中ATP-actin浓度高时,微丝快速生长,在微丝纤维的两端形 成ATP-actin"帽子”,这样的微丝有较高的稳定性。伴随着ATP水解,微丝结合的ATP就 变成了ADP,当ADP-actin暴露出来后,微丝就开始去组装而变短。 Hydrolysis of ATP Minus end ADP Plus end AD A AD LADP AIP Exchange of ATP for ADP ADP 图9-4肌动蛋白的踏车行为 微丝具有极性,肌动蛋白单体加到(+)极的速度要比加到(-)极的速度快5-10倍。溶 液中ATP-肌动蛋白的浓度也影响组装的速度。当处于临界浓度时,ATP-actin可能继续在 (+)端添加、而在(-)端开始分离,表现出一种“踏车"现象(图9-4)。 细胞中微丝参与形成的结构除肌原纤维、微绒毛等属于稳定结构外,其他大都处于动态 的组装和去组装过程中,并通过这种方式实现其功能。细胞松弛素(cytochalasin)可切断微 丝纤维,并结合在微丝末端抑制肌动蛋白加合到微丝纤维上,特异性的抑制微丝功能。鬼笔环 肽(phalloidin)与微丝能够特异性的结合,使微丝纤维稳定而抑制其功能。荧光标记的鬼笔 环肽可特异性的显示微丝。 二、微丝结合蛋白 已经分离出来的微丝结合蛋白有100多种,可分为以下不同类型(图9-5): 1.核化蛋白(nucleating protein) 核化(nucleation)是纤维组装的第一步,即几个蛋白单体先组装成多聚体,然后其它单 体继续添加形成长纤维分子。Arp(actin-.related protein)复合体在体内和体外都可以促进肌动
ATP-actin(结合 ATP 的肌动蛋白)对微丝纤维末端的亲和力高,ADP-actin 对纤维末端 的亲和力低,容易脱落。当溶液中 ATP-actin 浓度高时,微丝快速生长,在微丝纤维的两端形 成 ATP-actin“帽子”,这样的微丝有较高的稳定性。伴随着 ATP 水解,微丝结合的 ATP 就 变成了 ADP,当 ADP-actin 暴露出来后,微丝就开始去组装而变短。 图 9-4 肌动蛋白的踏车行为 微丝具有极性,肌动蛋白单体加到(+)极的速度要比加到(-)极的速度快 5-10 倍。溶 液中 ATP-肌动蛋白的浓度也影响组装的速度。当处于临界浓度时,ATP-actin 可能继续在 (+)端添加、而在(-)端开始分离,表现出一种“踏车”现象(图 9-4)。 细胞中微丝参与形成的结构除肌原纤维、微绒毛等属于稳定结构外,其他大都处于动态 的组装和去组装过程中,并通过这种方式实现其功能。细胞松弛素(cytochalasin)可切断微 丝纤维,并结合在微丝末端抑制肌动蛋白加合到微丝纤维上,特异性的抑制微丝功能。鬼笔环 肽(phalloidin)与微丝能够特异性的结合,使微丝纤维稳定而抑制其功能。荧光标记的鬼笔 环肽可特异性的显示微 丝。 二、微丝结合蛋白 已经分离出来的微丝结合蛋白有 100 多种,可分为以下不同类型(图 9-5): 1.核化蛋白(nucleating protein) 核化(nucleation)是纤维组装的第一步,即几个蛋白单体先组装成多聚体,然后其它单 体继续添加形成长纤维分子。Arp(actin-related protein)复合体在体内和体外都可以促进肌动

蛋白的核化,其作用就像一个模板,类似于微管组织中心的y球蛋白复合体,Ap复合体由 Arp2、Arp3和5种其它蛋白构成。Arp与actin在结构上具有同源性。 2.单体隐蔽蛋白(monomer sequestering protein) 细胞中约有50%的肌动蛋白为可溶性肌动蛋白,大大高于肌动蛋白组装所需的临界浓 度。但是这些蛋白与其它蛋白结合,构成一个隐蔽的蛋白库。只有当细胞需要组装纤维的时候 这些可溶性肌动蛋白才被释放出来。如:thymosin与actin结合可阻止其向纤维添加,抑制其 水解或交换结合的核苷酸。 3.封端蛋白(end-blocking protein) 作用是调节肌动蛋白纤维的长度,结合在(+)或()极形成“帽子”,阻止其它单体 添加。如骨骼肌细肌丝的(-)端被tropomodulin封闭,(+)端被CapZ封闭。 4.单体聚合蛋白(monomer polymerizing protein) 如profilin结合在actin的ATP结合位点相对的一侧,能与thymosin竞争结合actin, profilin可将结合的单体安装到纤维的(+)极。 5.微丝解聚蛋白(actin-filament depolymerizing protein) 如cofilir可结合在纤维的(-)极,使微丝去组装。这种蛋白在微管快速组装和去组装的 结构中具有重要的作用,涉及细胞的移动、内吞和胞质分裂。 6.交联蛋白(cross-linking protein) 每一种蛋白含有2至多个微丝结合部位,因此可以将2至多条纤维联系在一起形成纤维 束或网络。分为成束蛋白和成胶蛋白两类,成束蛋白如:丝束蛋白(fimbrin)、绒毛蛋白 (villin)和a-辅肌动蛋白(a-actinin),可以将肌动蛋白纤丝交联成平行排列成束的结构。成 胶蛋白,如细丝蛋白(filamin)促使形成肌动蛋白微丝网。 7.纤维切断蛋白(filament severing protein) 此类蛋白能结合在微丝中部,将微丝切断。如溶胶蛋白(g©lsolin)。 8.膜结合蛋白(membrane-binding protein) 如粘着斑蛋白(vinculin)可将肌动蛋白纤维量接在膜上,参与构成粘合带
蛋白的核化,其作用就像一个模板,类似于微管组织中心的γ球蛋白复合体,Arp 复合体由 Arp2、Arp3 和 5 种其它蛋白构成。Arp 与 actin 在结构上具有同源性。 2.单体隐蔽蛋白(monomer sequestering protein) 细胞中约有 50%的肌动蛋白为可溶性肌动蛋白,大大高于肌动蛋白组装所需的临界浓 度。但是这些蛋白与其它蛋白结合,构成一个隐蔽的蛋白库。只有当细胞需要组装纤维的时候 这些可溶性肌动蛋白才被释放出来。如:thymosin 与 actin 结合可阻止其向纤维添加,抑制其 水解或交换结合的核苷酸。 3.封端蛋白(end-blocking protein) 作用是调节肌动蛋白纤维的长度,结合在(+)或(-)极形成“帽子”,阻止其它单体 添加。如骨骼肌细肌丝的(-)端被 tropomodulin 封闭,(+)端被 CapZ 封闭。 4.单体聚合蛋白(monomer polymerizing protein) 如 profilin 结合在 actin 的 ATP 结合位点相对的一侧,能与 thymosin 竞争结合 actin, profilin 可将结合的单体安装到纤维的(+)极。 5.微丝解聚蛋白(actin-filament depolymerizing protein) 如 cofilin 可结合在纤维的(-)极,使微丝去组装。这种蛋白在微管快速组装和去组装的 结构中具有重要的作用,涉及细胞的移动、内吞和胞质分裂。 6.交联蛋白(cross-linking protein) 每一种蛋白含有 2 至多个微丝结合部位,因此可以将 2 至多条纤维联系在一起形成纤维 束或网络。分为成束蛋白和成胶蛋白两类,成束蛋白如:丝束蛋白(fimbrin)、绒毛蛋白 (villin)和 α-辅肌动蛋白(α-actinin),可以将肌动蛋白纤丝交联成平行排列成束的结构。成 胶蛋白,如细丝蛋白(filamin)促使形成肌动蛋白微丝网。 7.纤维切断蛋白(filament severing protein) 此类蛋白能结合在微丝中部,将微丝切断。如溶胶蛋白(gelsolin)。 8.膜结合蛋白(membrane-binding protein) 如粘着斑蛋白(vinculin)可将肌动蛋白纤维量接在膜上,参与构成粘合带
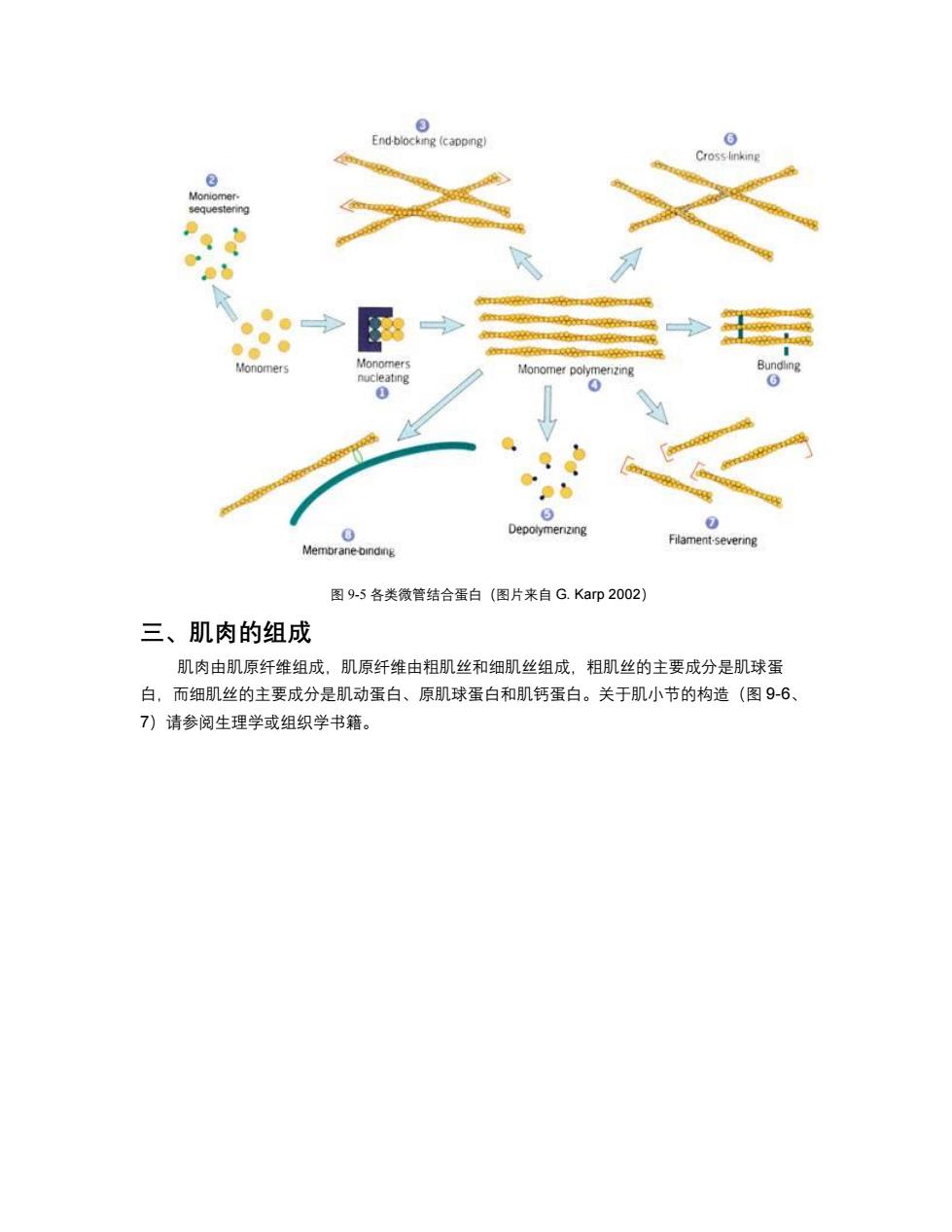
3 End-blocking (capping Cross-linking 3 Moniomer. sequestering 0 ●。 PEECRROYEELEAREE Monomers Monomers Monomer polymenzing Bundlng nucleating 0 6 0 0 Depolymerizing Filament-severing Membrane-binding 图9-5各类微管结合蛋白(图片来自G.Karp2002) 三、肌肉的组成 肌肉由肌原纤维组成,肌原纤维由粗肌丝和细肌丝组成,粗肌丝的主要成分是肌球蛋 白,而细肌丝的主要成分是肌动蛋白、原肌球蛋白和肌钙蛋白。关于肌小节的构造(图9-6、 7)请参阅生理学或组织学书籍
图 9-5 各类微管结合蛋白(图片来自 G. Karp 2002) 三、肌肉的组成 肌肉由肌原纤维组成,肌原纤维由粗肌丝和细肌丝组成,粗肌丝的主要成分是肌球蛋 白,而细肌丝的主要成分是肌动蛋白、原肌球蛋白和肌钙蛋白。关于肌小节的构造(图 9-6、 7)请参阅生理学或组织学书籍
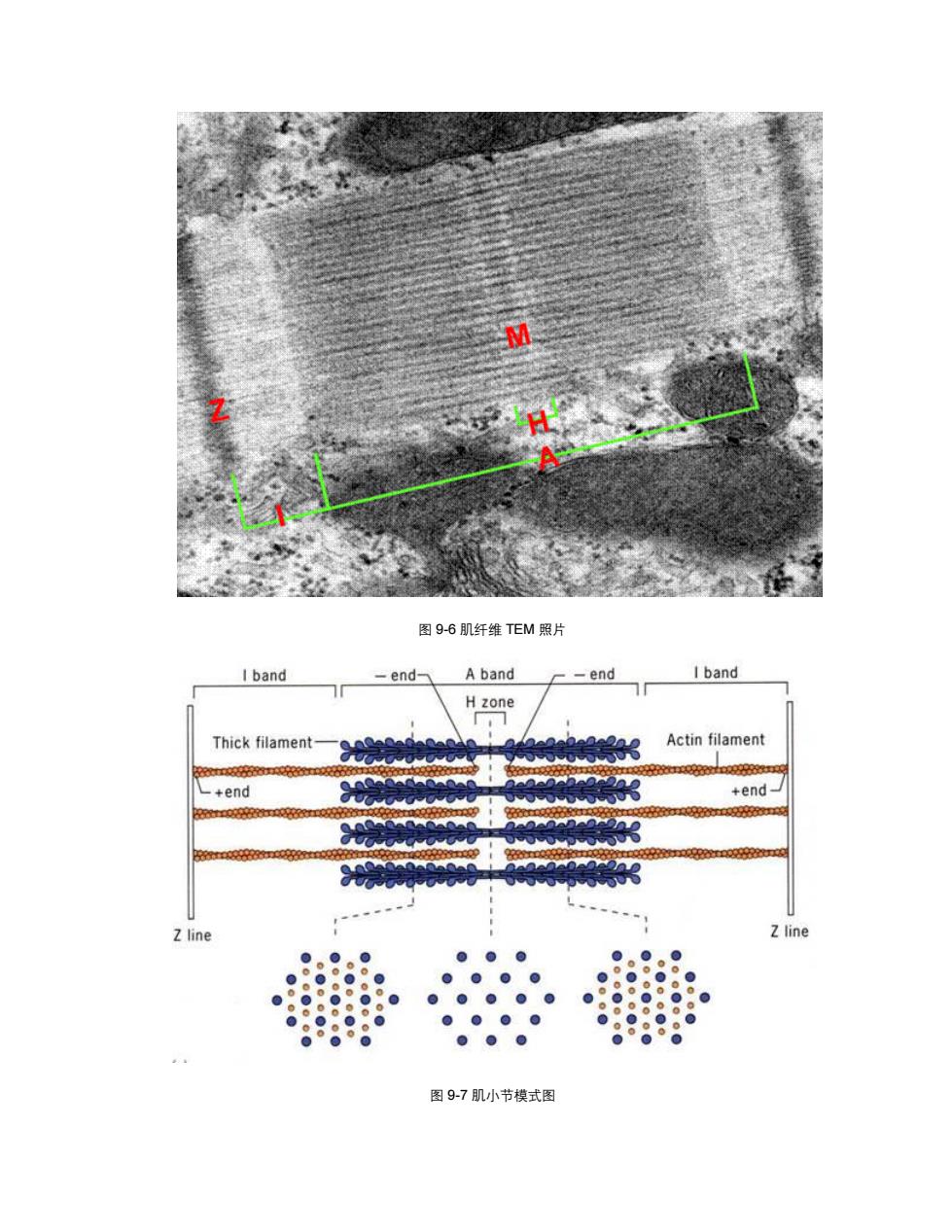
图9-6肌纤维TEM照片 I band -end- A band -end I band H zone Thick filament Actin filament +end +end Zline Z line 0 0 0 0 0 0 0 ● 8 0 0 0 0 8 0 0 ● 0 0 图97肌小节模式图
图 9-6 肌纤维 TEM 照片 图 9-7 肌小节模式图

(一)肌球蛋白(myosin) 属于马达蛋白,可利用ATP产生机械能,趋向微丝的(+)极运动(图9-8),最早发现 于肌肉组织(myosin),1970s后逐渐发现许多非肌细胞的myosin,目前已知的有15种类型 (myosin I-.XV))。 Myosin lI是构成肌纤维的主要成分之一。由两个重链和4个轻链组成,重链形成一个双 股α螺旋,一半呈杆状,另一半与轻链一起折叠成两个球形区域,位于分子一端,球形的头部 具有ATP酶活性(图9-9)。 Myosin V结构类是于myosin Il,但重链有球形尾部。 Myosin I由一个重链和两个轻链组成。 Myosin I、l、V都存在于非肌细胞中,‖型参与形成应力纤维和胞质收缩环,【、V型结 合在膜上与膜泡运输有关,神经细胞富含myosin V。 myosinl myos n-l 2 vesicle myosin-ll 心奥⊙ mvosin-l plasma membrane 图9-8 myosin ll的功能
(一)肌球蛋白(myosin) 属于马达蛋白,可利用 ATP 产生机械能,趋向微丝的(+)极运动(图 9-8),最早发现 于肌肉组织(myosin II),1970s 后逐渐发现许多非肌细胞的 myosin,目前已知的有 15 种类型 (myosin I-XV)。 Myosin II 是构成肌纤维的主要成分之一。由两个重链和 4 个轻链组成,重链形成一个双 股α螺旋,一半呈杆状,另一半与轻链一起折叠成两个球形区域,位于分子一端,球形的头部 具有 ATP 酶活性(图 9-9)。 Myosin V 结构类是于 myosin II,但重链有球形尾部。 Myosin I 由一个重链和两个轻链组成。 Myosin I、II、V 都存在于非肌细胞中,II 型参与形成应力纤维和胞质收缩环,I、V 型结 合在膜上与膜泡运输有关,神经细胞富含 myosin V 。 图 9-8 myosin II 的功能
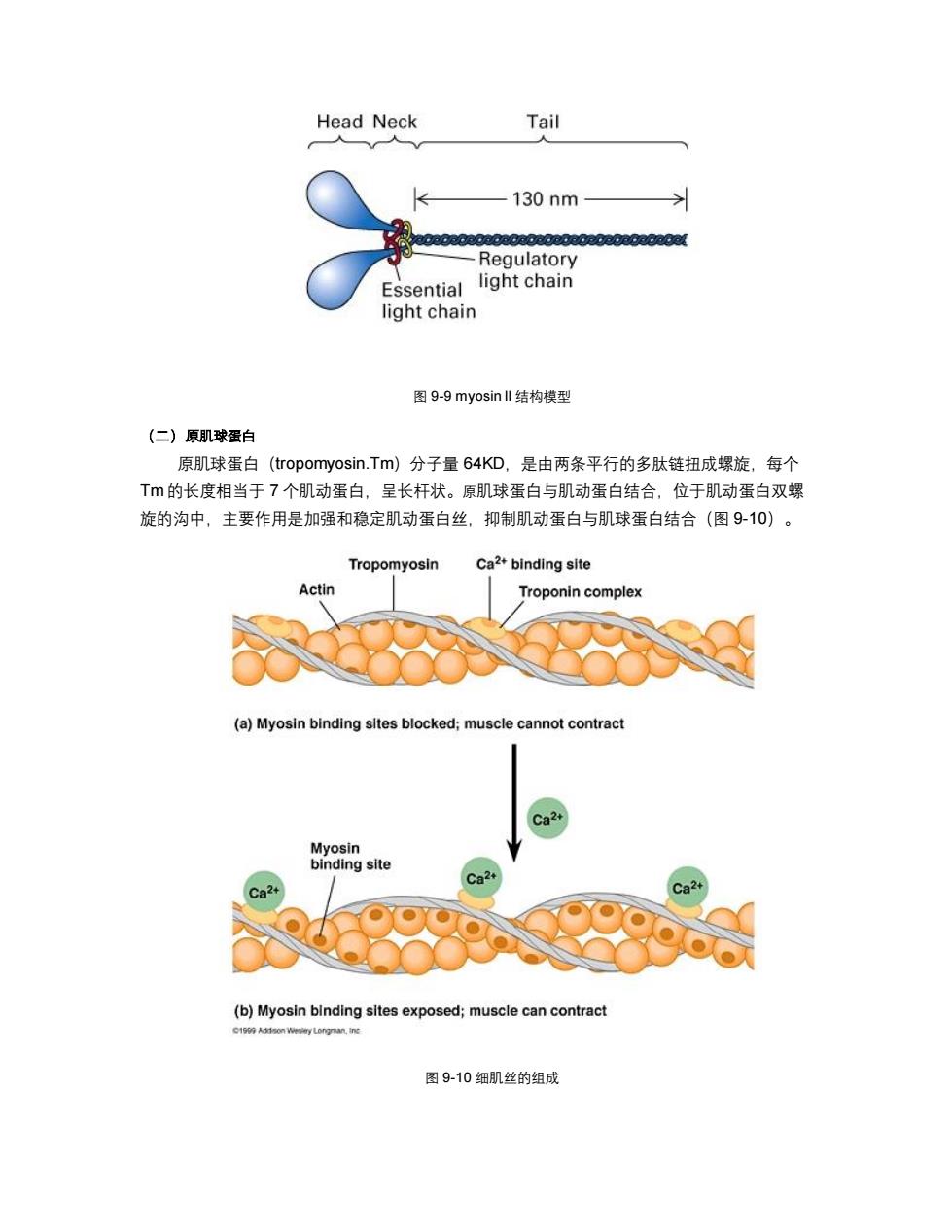
Head Neck Tail 130nm PpEeoeo8paoagasapppapanapaoo Regulatory Essential light chain light chain 图9-9 myosin ll结构模型 (二)原肌球蛋白 原肌球蛋白(tropomyosin.Tm)分子量64KD,是由两条平行的多肽链扭成螺旋,每个 T的长度相当于7个肌动蛋白,呈长杆状。原肌球蛋白与肌动蛋白结合,位于肌动蛋白双螺 旋的沟中,主要作用是加强和稳定肌动蛋白丝,抑制肌动蛋白与肌球蛋白结合(图9-10)。 Tropomyosin Ca2+binding site Actin Troponin complex (a)Myosin binding sites blocked;muscle cannot contract Ca2+ Myosin binding site a24 Ca2+ (b)Myosin binding sites exposed;muscle can contract 196 Addson Longman,inc 图9-10细肌丝的组成
图 9-9 myosin II 结构模型 (二)原肌球蛋白 原肌球蛋白(tropomyosin.Tm)分子量 64KD,是由两条平行的多肽链扭成螺旋,每个 Tm 的长度相当于 7 个肌动蛋白,呈长杆状。原肌球蛋白与肌动蛋白结合,位于肌动蛋白双螺 旋的沟中,主要作用是加强和稳定肌动蛋白丝,抑制肌动蛋白与肌球蛋白结合(图 9-10)。 图 9-10 细肌丝的组成
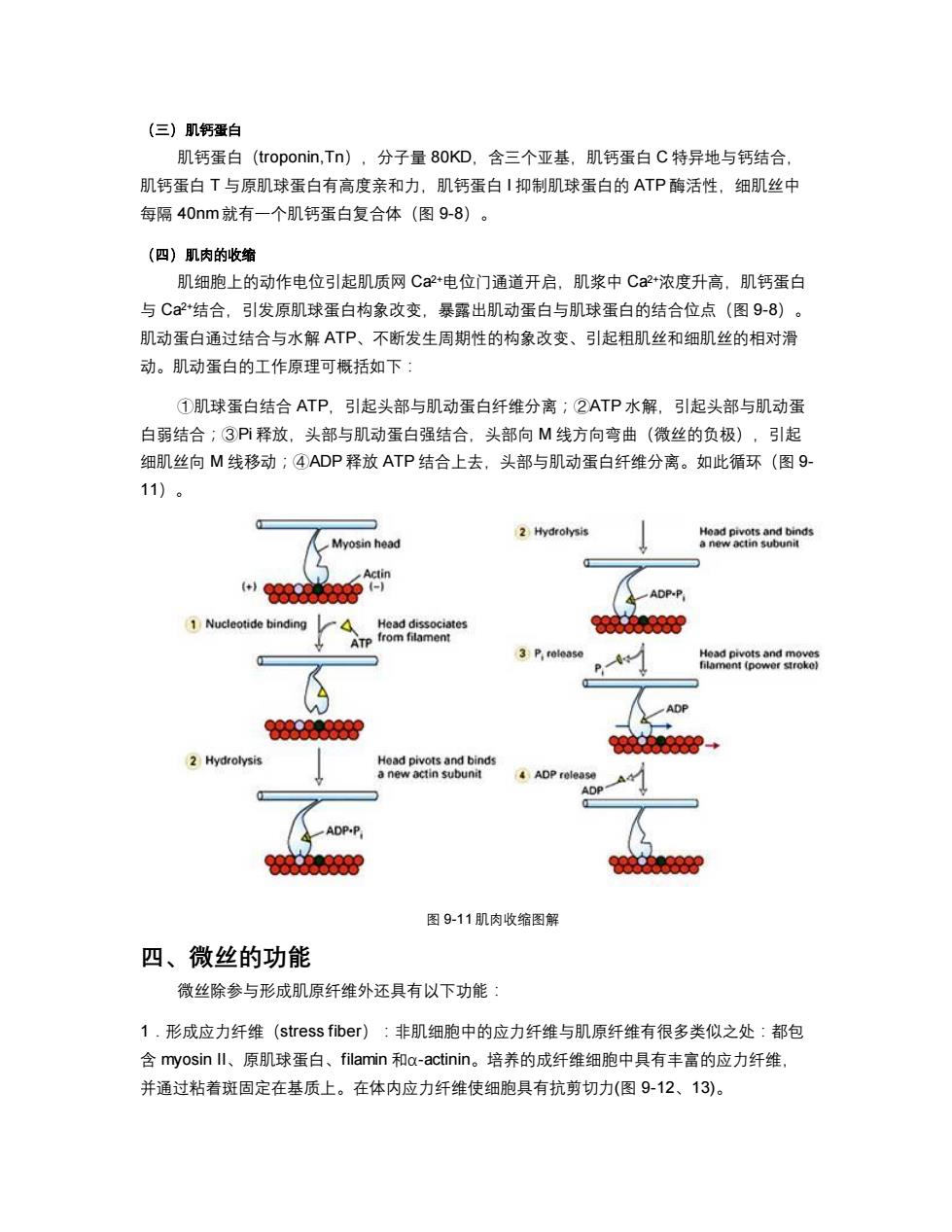
(三)肌钙蛋白 肌钙蛋白(troponin,Tn),分子量80KD,含三个亚基,肌钙蛋白C特异地与钙结合, 肌钙蛋白T与原肌球蛋白有高度亲和力,肌钙蛋白I抑制肌球蛋白的ATP酶活性,细肌丝中 每隔40nm就有一个肌钙蛋白复合体(图9-8)。 (四)肌肉的收缩 肌细胞上的动作电位引起肌质网C2+电位门通道开启,肌浆中C2+浓度升高,肌钙蛋白 与C+结合,引发原肌球蛋白构象改变,暴露出肌动蛋白与肌球蛋白的结合位点(图9-8)。 肌动蛋白通过结合与水解ATP、不断发生周期性的构象改变、引起粗肌丝和细肌丝的相对滑 动。肌动蛋白的工作原理可概括如下: ①肌球蛋白结合ATP,引起头部与肌动蛋白纤维分离;②ATP水解,引起头部与肌动蛋 白弱结合;③P释放,头部与肌动蛋白强结合,头部向M线方向弯曲(微丝的负极),引起 细肌丝向M线移动;④ADP释放ATP结合上去,头部与肌动蛋白纤维分离。如此循环(图9- 11)。 2 Hydrolysis Head pivots and binds Myosin head a new actin subunit Actin -1 ADP-P 1 Nucleotide binding Head dissociates ATP from filament 3 P,rolease Head pivots and moves filament (power stroke) 0000000000 + 2 Hydrolysis Head pivots and binds a new actin subunit 4 ADP release A ADP ADP.P 图9-11肌肉收缩图解 四、微丝的功能 微丝除参与形成肌原纤维外还具有以下功能: 1.形成应力纤维(stress fiber):非肌细胞中的应力纤维与肌原纤维有很多类似之处:都包 含myosin Il、原肌球蛋白、filamin和a-actinin。培养的成纤维细胞中具有丰富的应力纤维 并通过粘着斑固定在基质上。在体内应力纤维使细胞具有抗剪切力(图9-12、13)
(三)肌钙蛋白 肌钙蛋白(troponin,Tn),分子量 80KD,含三个亚基,肌钙蛋白 C 特异地与钙结合, 肌钙蛋白 T 与原肌球蛋白有高度亲和力,肌钙蛋白 I 抑制肌球蛋白的 ATP 酶活性,细肌丝中 每隔 40nm 就有一个肌钙蛋白复合体(图 9-8)。 (四)肌肉的收缩 肌细胞上的动作电位引起肌质网 Ca2+电位门通道开启,肌浆中 Ca2+浓度升高,肌钙蛋白 与 Ca2+结合,引发原肌球蛋白构象改变,暴露出肌动蛋白与肌球蛋白的结合位点(图 9-8)。 肌动蛋白通过结合与水解 ATP、不断发生周期性的构象改变、引起粗肌丝和细肌丝的相对滑 动。肌动蛋白的工作原理可概括如下: ①肌球蛋白结合 ATP,引起头部与肌动蛋白纤维分离;②ATP 水解,引起头部与肌动蛋 白弱结合;③Pi 释放,头部与肌动蛋白强结合,头部向 M 线方向弯曲(微丝的负极),引起 细肌丝向 M 线移动;④ADP 释放 ATP 结合上去,头部与肌动蛋白纤维分离。如此循环(图 9- 11)。 图 9-11 肌肉收缩图解 四、微丝的功能 微丝除参与形成肌原纤维外还具有以下功能: 1.形成应力纤维(stress fiber):非肌细胞中的应力纤维与肌原纤维有很多类似之处:都包 含 myosin II、原肌球蛋白、filamin 和α-actinin。培养的成纤维细胞中具有丰富的应力纤维, 并通过粘着斑固定在基质上。在体内应力纤维使细胞具有抗剪切力(图 9-12、13)