
第二章 细胞生物学实验枝术 6脆Be METHODS AND TECHNIQUES

第一节显微技术 显微镜是观察细胞的主要工具。根据光源不同,可分为光学显微镜和电子显微镜两大类。 前者以可见光(紫外线显微镜以紫外光)为光源,后者则以电子束为光源。 一、光学显微镜 (一)、普通光学显微镜 普通生物显微镜由3部分构成,即:①照明系统,包括光源和聚光器:②光学放大系 统,由物镜和目镜组成,是显微镜的主体,为了消除球差和色差,目镜和物镜都由复杂的透镜 组构成;③机械装置,用于固定材料和观察方便(图2-1)。 图2-1尼康E-600显微镜
第一节 显微技术 显微镜是观察细胞的主要工具。根据光源不同,可分为光学显微镜和电子显微镜两大类。 前者以可见光(紫外线显微镜以紫外光)为光源,后者则以电子束为光源。 —、光学显微镜 (一)、普通光学显微镜 普通生物显微镜由 3 部分构成,即:①照明系统,包括光源和聚光器;②光学放大系 统,由物镜和目镜组成,是显微镜的主体,为了消除球差和色差,目镜和物镜都由复杂的透镜 组构成;③机械装置,用于固定材料和观察方便(图 2-1)。 图 2-1 尼康 E-600 显微镜

显微镜物象是否清楚不仅决定于放大倍数,还与显微镜的分辨力(resolution)有关,分 辨力是指显微镜(或人的眼睛距目标25cm处)能分辨物体最小间隔的能力,分辨力的大小决 定于光的波长和镜口率以及介质的折射率,用公式表示为: R=0.61A/N.A.N.A.n sina/2 式中:n=介质折射率;a=镜口角(标本对物镜镜口的张角),N.A.=镜口率(numeric aperture)。镜口角总是要小于180`,所以sina/2的最大值必然小于1。 表2-1及中介质的折射率 介质 空气 水 香柏油 a溴萘 折射率 1 1.33 1.515 1.66 制作光学镜头所用的玻璃折射率为1.65~1.78,所用介质的折射率越接近玻璃的越好。对 于干燥物镜来说,介质为空气,镜口率一般为0.05~0.95;油镜头用香柏油为介质,镜口率可 接近1.5。 普通光线的波长为400~700nm,因此显微镜分辨力数值不会小于0.2ym,人眼的分辨力 是0.2mm,所以一般显微镜设计的最大放大倍数通常为1000X
显微镜物象是否清楚不仅决定于放大倍数,还与显微镜的分辨力(resolution)有关,分 辨力是指显微镜(或人的眼睛距目标 25cm 处)能分辨物体最小间隔的能力,分辨力的大小决 定于光的波长和镜口率以及介质的折射率,用公式表示为: R=0.61λ /N.A. N.A.=nsinα/2 式中:n=介质折射率;α=镜口角(标本对物镜镜口的张角),N.A.=镜口率(numeric aperture)。镜口角总是要小于 180˚,所以 sina/2 的最大值必然小于 1。 表 2-1 及中介质的折射率 介质 空气 水 香柏油 α 溴萘 折射率 1 1.33 1.515 1.66 制作光学镜头所用的玻璃折射率为 1.65~1.78,所用介质的折射率越接近玻璃的越好。对 于干燥物镜来说,介质为空气,镜口率一般为 0.05~0.95;油镜头用香柏油为介质,镜口率可 接近 1.5。 普通光线的波长为 400~700nm,因此显微镜分辨力数值不会小于 0.2μm,人眼的分辨力 是 0.2mm,所以一般显微镜设计的最大放大倍数通常为 1000X

(二)、荧光显微镜 图2-2尼康E800荧光DI1C显微镜 细胞中有些物质,如叶绿素等,受紫外线照射后可发荧光;另有一些物质本身虽不能发 荧光,但如果用荧光染料或荧光抗体染色后,经紫外线照射亦可发荧光,荧光显微镜(图2 2,3,4)就是对这类物质进行定性和定量研究的工具之一
(二)、荧光显微镜 图 2-2 尼康 E800 荧光 DIC 显微镜 细胞中有些物质,如叶绿素等,受紫外线照射后可发荧光;另有一些物质本身虽不能发 荧光,但如果用荧光染料或荧光抗体染色后,经紫外线照射亦可发荧光,荧光显微镜(图 2- 2,3,4)就是对这类物质进行定性和定量研究的工具之一

3 second barrier filter:cuts out unwanted fluorescent signals, passing the specific green fluorescein emission between 520 and 560 nm LIGHT SOURCE 2 beam-splitting mirror:reflects light below 510 nm but transmits light above 510 nm 1 first barrier filter:lets through only blue light with a wavelength between 450 and 490 nm objective lens object 图2-3落射式照明原理 荧光显微镜和普通显微镜有以下的区别: 1.照明方式通常为落射式,即光源通过物镜投射于样品上(图2-3): 2.光源为紫外光,波长较短,分辨力高于普通显微镜; 3.有两个特殊的滤光片,光源前的用以滤除可见光,目镜和物镜之间的用于滤除紫外线, 用以保护人目
图 2-3 落射式照明原理 荧光显微镜和普通显微镜有以下的区别: 1. 照明方式通常为落射式,即光源通过物镜投射于样品上(图 2-3); 2. 光源为紫外光,波长较短,分辨力高于普通显微镜; 3. 有两个特殊的滤光片,光源前的用以滤除可见光,目镜和物镜之间的用于滤除紫外线, 用以保护人目
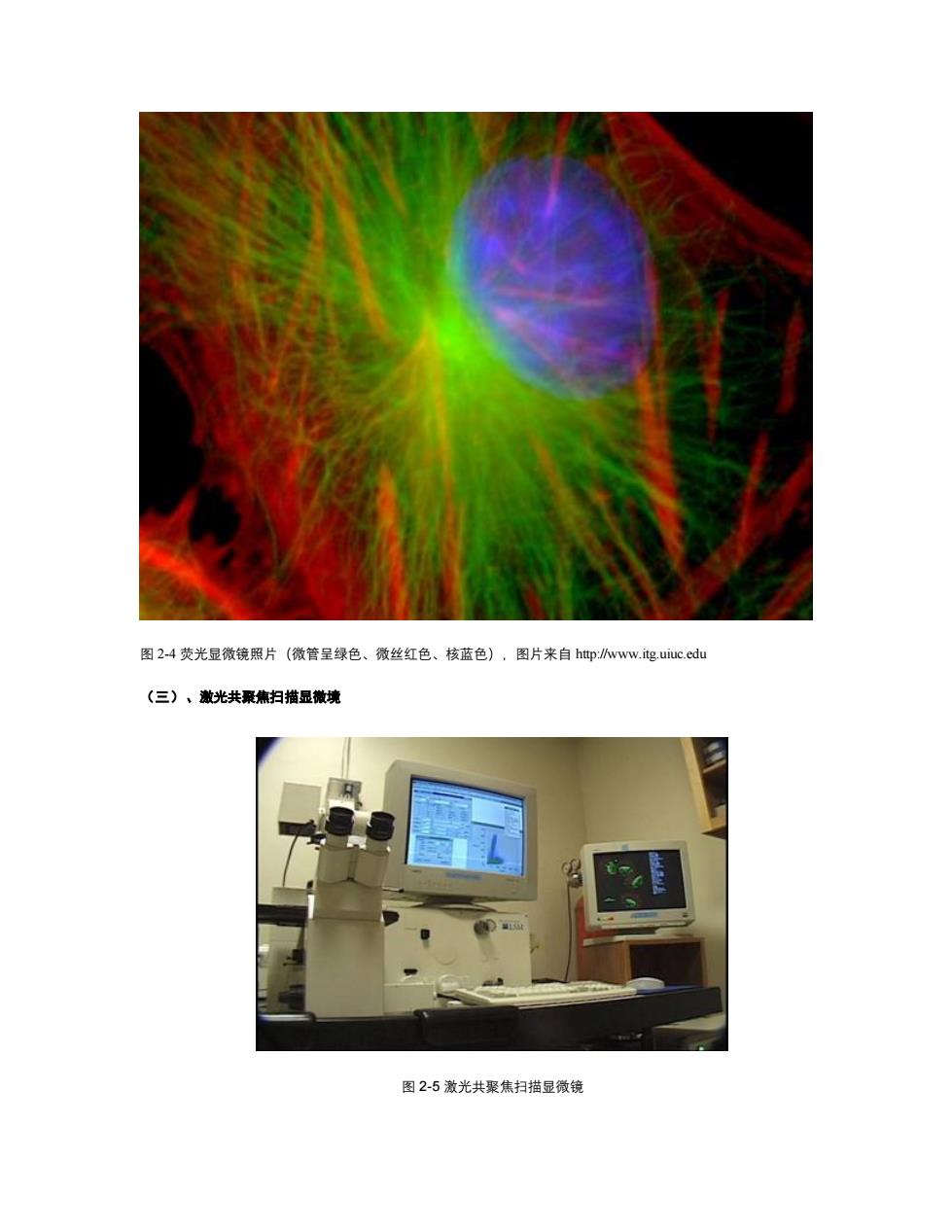
图24荧光显微镜照片(微管呈绿色、微丝红色、核蓝色),图片来自htp:www.itg.uiuc.edu (三)、激光共聚焦扫描显微境 图2-5激光共聚焦扫描显微镜
图 2-4 荧光显微镜照片(微管呈绿色、微丝红色、核蓝色),图片来自 http://www.itg.uiuc.edu (三)、激光共聚焦扫描显微境 图 2-5 激光共聚焦扫描显微镜
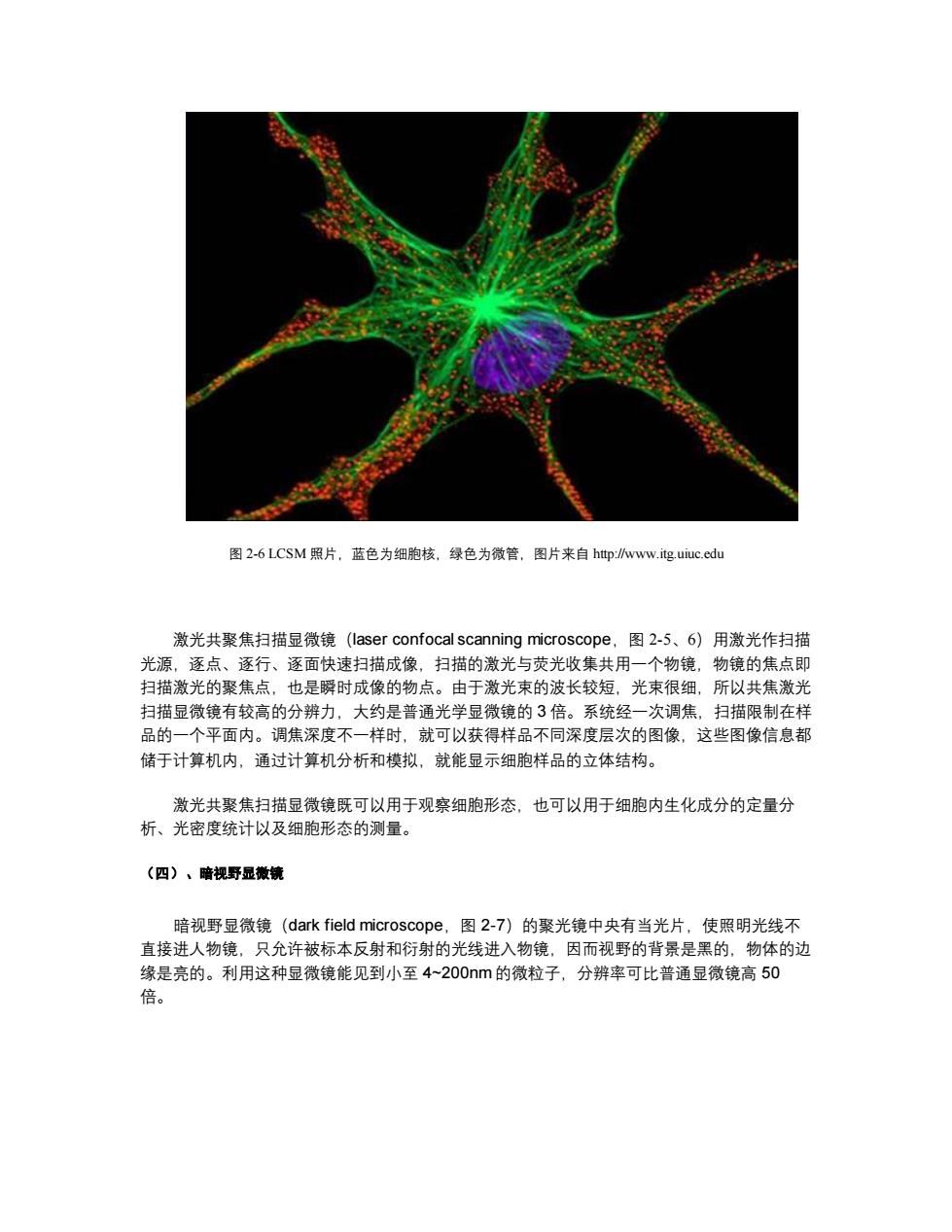
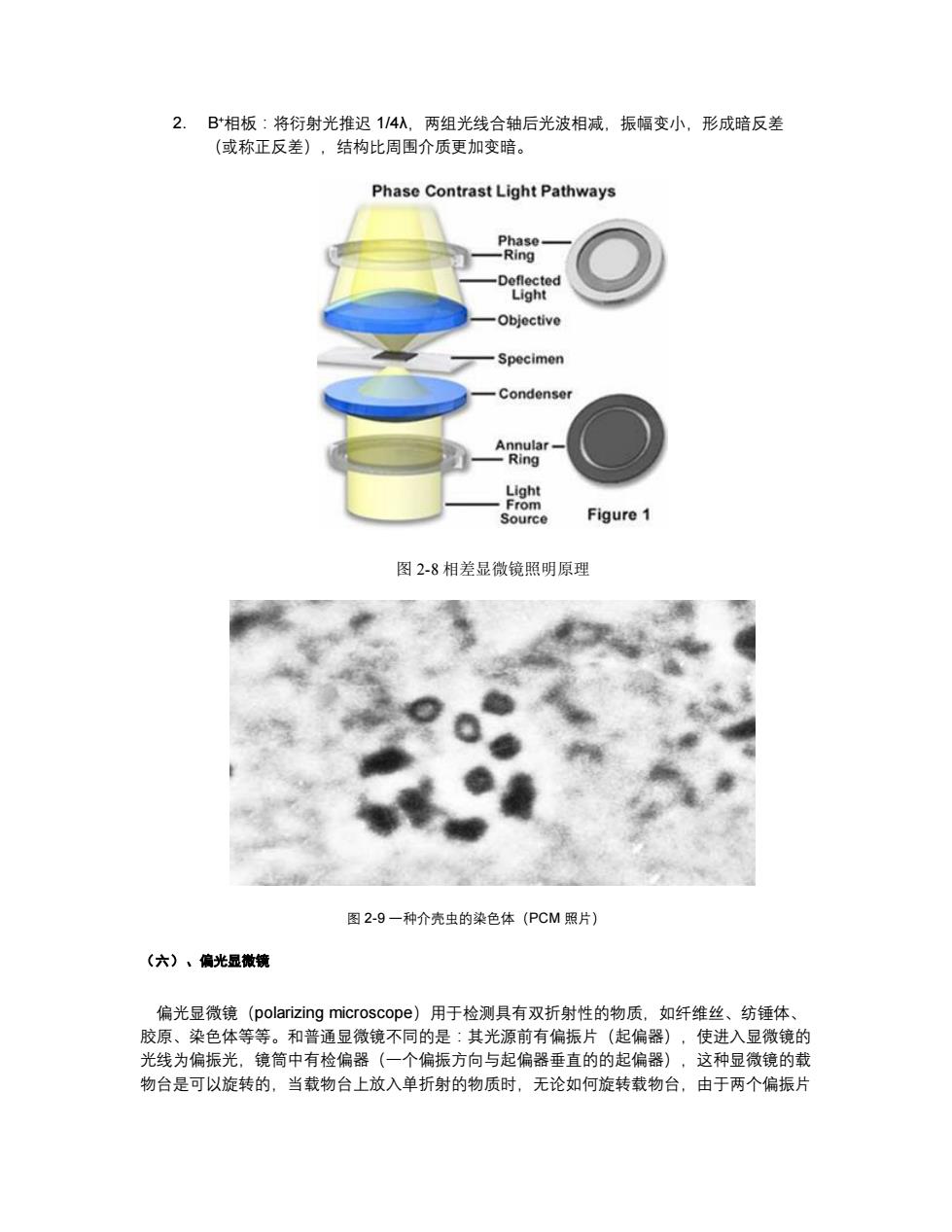
图2-6LCSM照片,蓝色为细胞核,绿色为微管,图片来自http:www.itg.uiuc.edu 激光共聚焦扫描显微镜(laser confocal scanning microscope,图2-5、6)用激光作扫描 光源,逐点、逐行、逐面快速扫描成像,扫描的激光与荧光收集共用一个物镜,物镜的焦点即 扫描激光的聚焦点,也是瞬时成像的物点。由于激光束的波长较短,光束很细,所以共焦激光 扫描显微镜有较高的分辨力,大约是普通光学显微镜的3倍。系统经一次调焦,扫描限制在样 品的一个平面内。调焦深度不一样时,就可以获得样品不同深度层次的图像,这些图像信息都 储于计算机内,通过计算机分析和模拟,就能显示细胞样品的立体结构。 激光共聚焦扫描显微镜既可以用于观察细胞形态,也可以用于细胞内生化成分的定量分 析、光密度统计以及细胞形态的测量。 (四)、暗视哥显微镜 暗视野显微镜(dark field microscope,图2-7)的聚光镜中央有当光片,使照明光线不 直接进人物镜,只允许被标本反射和衍射的光线进入物镜,因而视野的背景是黑的,物体的边 缘是亮的。利用这种显微镜能见到小至4~200nm的微粒子,分辨率可比普通显微镜高50 倍
图 2-6 LCSM 照片,蓝色为细胞核,绿色为微管,图片来自 http://www.itg.uiuc.edu 激光共聚焦扫描显微镜(laser confocal scanning microscope,图 2-5、6)用激光作扫描 光源,逐点、逐行、逐面快速扫描成像,扫描的激光与荧光收集共用一个物镜,物镜的焦点即 扫描激光的聚焦点,也是瞬时成像的物点。由于激光束的波长较短,光束很细,所以共焦激光 扫描显微镜有较高的分辨力,大约是普通光学显微镜的 3 倍。系统经一次调焦,扫描限制在样 品的一个平面内。调焦深度不一样时,就可以获得样品不同深度层次的图像,这些图像信息都 储于计算机内,通过计算机分析和模拟,就能显示细胞样品的立体结构。 激光共聚焦扫描显微镜既可以用于观察细胞形态,也可以用于细胞内生化成分的定量分 析、光密度统计以及细胞形态的测量。 (四)、暗视野显微镜 暗视野显微镜(dark field microscope,图 2-7)的聚光镜中央有当光片,使照明光线不 直接进人物镜,只允许被标本反射和衍射的光线进入物镜,因而视野的背景是黑的,物体的边 缘是亮的。利用这种显微镜能见到小至 4~200nm 的微粒子,分辨率可比普通显微镜高 50 倍

Objective lens Stage Condenser Light Dark-field stop 图2-7暗视野照明方式 (五)、相差显微镜 相差显微镜(phasecontrast microscope,图2-8、9)由P.Zernike于1932年发明, 并因此获1953年诺贝尔物理奖。这种显微镜最大的特点是可以观察未经染色的标本和活细 胞。 相差显微镜的基本原理是,把透过标本的可见光的光程差变成振幅差,从而提高了各种结 构间的对比度,使各种结构变得清晰可见。光线透过标本后发生折射,偏离了原来的光路,同 时被延迟了114入(波长),如果再增加或减少1/4入,则光程差变为1/2入,两束光合轴后干涉 加强,振幅增大或减下,提高反差。在构造上,相差显微镜有不同于普通光学显微镜两个特殊 之处: 1.环形光阑(annular diaphragm)位于光源与聚光器之间,作用是使透过聚光器的光线形 成空心光锥,焦聚到标本上。 2.相位板(annular phaseplate)在物镜中加了涂有氟化镁的相位板,可将直射光或衍射光 的相位推迟114入。分为两种: 1.A*相板:将直射光推迟114入,两组光波合轴后光波相加,振幅加大,标本结构比周 围介质更加变亮,形成亮反差(或称负反差)
图 2-7 暗视野照明方式 (五)、相差显微镜 相差显微镜(phasecontrast microscope,图 2-8、9)由 P.Zernike 于 1932 年发明, 并因此获 1953 年诺贝尔物理奖。这种显微镜最大的特点是可以观察未经染色的标本和活细 胞。 相差显微镜的基本原理是,把透过标本的可见光的光程差变成振幅差,从而提高了各种结 构间的对比度,使各种结构变得清晰可见。光线透过标本后发生折射,偏离了原来的光路,同 时被延迟了 1/4λ(波长),如果再增加或减少 1/4λ,则光程差变为 1/2λ,两束光合轴后干涉 加强,振幅增大或减下,提高反差。在构造上,相差显微镜有不同于普通光学显微镜两个特殊 之处: 1. 环形光阑(annular diaphragm) 位于光源与聚光器之间,作用是使透过聚光器的光线形 成空心光锥,焦聚到标本上。 2. 相位板(annular phaseplate)在物镜中加了涂有氟化镁的相位板,可将直射光或衍射光 的相位推迟 1/4λ。分为两种: 1. A+相板:将直射光推迟 1/4λ,两组光波合轴后光波相加,振幅加大,标本结构比周 围介质更加变亮,形成亮反差(或称负反差)
2.B+相板:将衍射光推迟114入,两组光线合轴后光波相减,振幅变小,形成暗反差 (或称正反差),结构比周围介质更加变暗。 Phase Contrast Light Pathways Phase- -Ring Deflected Light Objective Specimen Condenser Annular -Ring Light From Source Figure 1 图2-8相差显微镜照明原理 图2-9一种介壳虫的染色体(PCM照片) (六)、偏光显微镜 偏光显微镜(polarizing microscope)用于检测具有双折射性的物质,如纤维丝、纺锤体、 胶原、染色体等等。和普通显微镜不同的是:其光源前有偏振片(起偏器),使进入显微镜的 光线为偏振光,镜筒中有检偏器(一个偏振方向与起偏器垂直的的起偏器),这种显微镜的载 物台是可以旋转的,当载物台上放入单折射的物质时,无论如何旋转载物台,由于两个偏振片
2. B+相板:将衍射光推迟 1/4λ,两组光线合轴后光波相减,振幅变小,形成暗反差 (或称正反差),结构比周围介质更加变暗。 图 2-8 相差显微镜照明原理 图 2-9 一种介壳虫的染色体(PCM 照片) (六)、偏光显微镜 偏光显微镜(polarizing microscope)用于检测具有双折射性的物质,如纤维丝、纺锤体、 胶原、染色体等等。和普通显微镜不同的是:其光源前有偏振片(起偏器),使进入显微镜的 光线为偏振光,镜筒中有检偏器(一个偏振方向与起偏器垂直的的起偏器),这种显微镜的载 物台是可以旋转的,当载物台上放入单折射的物质时,无论如何旋转载物台,由于两个偏振片

是垂直的,显微镜里看不到光线,而放入双折射性物质时,由于光线通过这类物质时发生偏 转,因此旋转载物台便能检测到这种物体。 (七)、微分干涉差显微镜 1952年,Nomarski在相差显微镜原理的基础上发明了微分干涉差显微镜(differential interference contrast microscope)。DIC显微镜又称Nomarski相差显微镜(Nomarki contrast microscope),其优点是能显示结构的三维立体投影影像。与相差显微镜相比,其标 本可略厚一点,折射率差别更大,故影像的立体感更强。 DC显微镜的物理原理完全不同于相差显微镜,技术设计要复杂得多。DC利用的是偏 振光,有四个特殊的光学组件:偏振器(polarizer)、DIC棱镜、DlC滑行器和检偏器 (analyzer)。偏振器直接装在聚光系统的前面,使光线发生线性偏振。在聚光器中则安装了 石英Vollaston棱镜,即DIC棱镜,此棱镜可将一束光分解成偏振方向不同的两束光(x和 y),二者成一小夹角。聚光器将两束光调整成与显微镜光轴平行的方向。最初两束光相位一 致,在穿过标本相邻的区域后,由于标本的厚度和折射率不同,引起了两束光发生了光程差。 在物镜的后焦面处安装了第二个Vollaston棱镜,即DIC滑行器,它把两束光波合并成一束。 这时两束光的偏振面(x和y)仍然存在。最后光束穿过第二个偏振装置,即检偏器。在光束 形成目镜DIC影像之前,检偏器与偏光器的方向成直角。检偏器将两束垂直的光波组合成具 有相同偏振面的两束光,从而使二者发生干涉。X和y波的光程差决定着透光的多少。光程差 值为0时,没有光穿过检偏器;光程差值等于波长一半时,穿过的光达到最大值。于是在灰色 的背景上,标本结构呈现出亮暗差。为了使影像的反差达到最佳状态,可通过调节DIC滑行 器的纵行微调来改变光程差,光程差可改变影像的亮度。调节DIC滑行器可使标本的细微结 构呈现出正或负的投影形象,通常是一侧亮,而另一侧暗,这便造成了标本的人为三维立体 感,类似大理石上的浮雕(图2-10)
是垂直的,显微镜里看不到光线,而放入双折射性物质时,由于光线通过这类物质时发生偏 转,因此旋转载物台便能检测到这种物体。 (七)、微分干涉差显微镜 1952 年,Nomarski 在相差显微镜原理的基础上发明了微分干涉差显微镜(differential interference contrast microscope)。DIC 显微镜又称 Nomarski 相差显微镜(Nomarki contrast microscope),其优点是能显示结构的三维立体投影影像。与相差显微镜相比,其标 本可略厚一点,折射率差别更大,故影像的立体感更强。 DIC 显微镜的物理原理完全不同于相差显微镜,技术设计要复杂得多。DIC 利用的是偏 振光,有四个特殊的光学组件:偏振器(polarizer)、DIC 棱镜、DIC 滑行器和检偏器 (analyzer)。偏振器直接装在聚光系统的前面,使光线发生线性偏振。在聚光器中则安装了 石英 Wollaston 棱镜,即 DIC 棱镜,此棱镜可将一束光分解成偏振方向不同的两束光(x 和 y),二者成一小夹角。聚光器将两束光调整成与显微镜光轴平行的方向。最初两束光相位一 致,在穿过标本相邻的区域后,由于标本的厚度和折射率不同,引起了两束光发生了光程差。 在物镜的后焦面处安装了第二个 Wollaston 棱镜,即 DIC 滑行器,它把两束光波合并成一束。 这时两束光的偏振面(x 和 y)仍然存在。最后光束穿过第二个偏振装置,即检偏器。在光束 形成目镜 DIC 影像之前,检偏器与偏光器的方向成直角。检偏器将两束垂直的光波组合成具 有相同偏振面的两束光,从而使二者发生干涉。x 和 y 波的光程差决定着透光的多少。光程差 值为 0 时,没有光穿过检偏器;光程差值等于波长一半时,穿过的光达到最大值。于是在灰色 的背景上,标本结构呈现出亮暗差。为了使影像的反差达到最佳状态,可通过调节 DIC 滑行 器的纵行微调来改变光程差,光程差可改变影像的亮度。调节 DIC 滑行器可使标本的细微结 构呈现出正或负的投影形象,通常是一侧亮,而另一侧暗,这便造成了标本的人为三维立体 感,类似大理石上的浮雕(图 2-10)