
1-溴丁烷的制备 一、教学目标: 1、使学生学习并掌握以正丁醇、浓H2$0,和溴化钠制备1-溴丁烷的原理和方法: 2、使学生掌握带有有害气体吸收装置的回流操作: 3、巩固分液漏斗的使用方法以及液体产品干燥、蒸馏的基本操作 教学方法与教学手段: 讲解法、学生实验法、巡回指导法 教学重点与教学难点: 重点:氯代烷的制备原理及方法,有害气体的回收及回收装置的组装和使用 难点:氯代烷的制备方法 思政元素:结合尾气吸收转置运用的作用,进行环保教有,结合反应过程中硫酸浓 度大学与加热火力大小控制,引导学生进行凡事有度,过犹不及教育,倡导采取科学方 法。 思政预期效果:引导学生养成环保意识,注意养成环保意识,废酸废碱和有毒反应 物不要随意丢弃,应置于制定容器,统一无害化处理,做事应采取科学方法,凡是有度, 过有不及处事方式。 二、实验原理 实验室中,芳卤一般通过芳烃在催化剂作用下直接卤化制备,卤代烷烃一般通过相 应的醇与氢卤酸之间的亲核取代反应制备(可逆反应)。溴化钠与浓硫酸反应,放出溴 化氢,溴化氢与正丁醇生成1-溴丁烷。 主反应: NaBr+H2SO4- →HBr+HSO4 n--CaHgOH+HBr ±n-C4HgBr+H20 副反应: CH2CH2CH2CH2OH CHCHCH-CH CHgCH-CHCHH2O 硫酸在反应中起催化剂和脱水剂作用 三、实验材料 11s
1 / 5 1-溴丁烷的制备 一、教学目标: 1、使学生学习并掌握以正丁醇、浓 H2SO4 和溴化钠制备 1-溴丁烷的原理和方法; 2、使学生掌握带有有害气体吸收装置的回流操作; 3、巩固分液漏斗的使用方法以及液体产品干燥、蒸馏的基本操作。 教学方法与教学手段: 讲解法、学生实验法、巡回指导法 教学重点与教学难点: 重点:氯代烷的制备原理及方法,有害气体的回收及回收装置的组装和使用 难点:氯代烷的制备方法 思政元素:结合尾气吸收转置运用的作用,进行环保教育,结合反应过程中硫酸浓 度大学与加热火力大小控制,引导学生进行凡事有度,过犹不及教育,倡导采取科学方 法。 思政预期效果:引导学生养成环保意识,注意养成环保意识,废酸废碱和有毒反应 物不要随意丢弃,应置于制定容器,统一无害化处理,做事应采取科学方法,凡是有度, 过有不及处事方式。 二、实验原理 实验室中,芳卤一般通过芳烃在催化剂作用下直接卤化制备,卤代烷烃一般通过相 应的醇与氢卤酸之间的亲核取代反应制备(可逆反应)。溴化钠与浓硫酸反应,放出溴 化氢,溴化氢与正丁醇生成 1-溴丁烷。 主反应: NaBr+ H2SO4 HBr+ NaHSO 4 n--C4H9OH + HBr n--C4H9Br + H2O 副反应: CH3CH2CH2CH2OH H2SO4 CH3CH2CH=CH 2+ CH3CH=CHCH 3+ H2O 2CH3CH2CH2CH2OH H2SO4 CH3CH2CH2CH2OCH2CH2CH2CH3+ H2O 硫酸在反应中起催化剂和脱水剂作用 三、实验材料
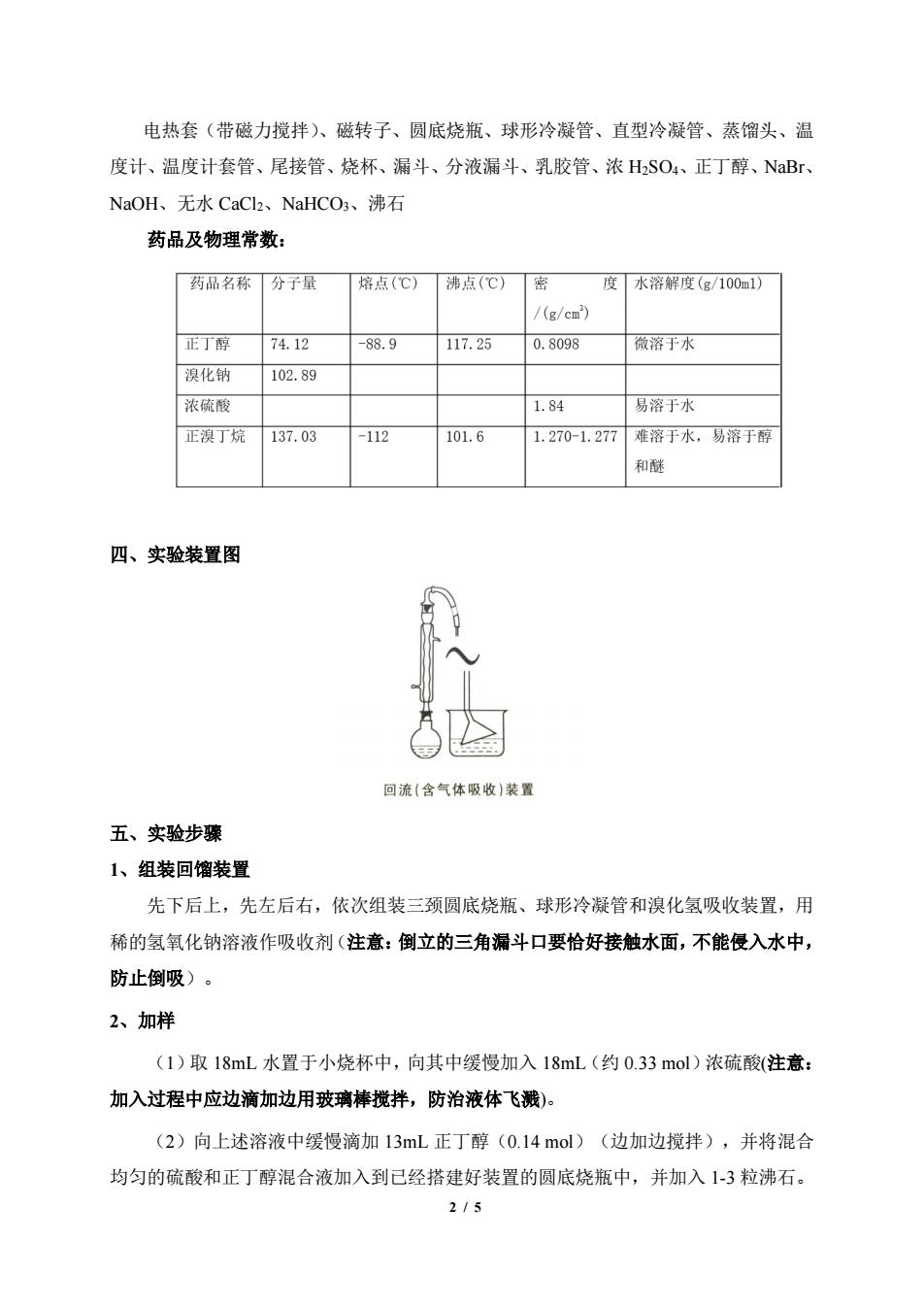
电热套(带磁力搅拌)、磁转子、圆底烧瓶、球形冷凝管、直型冷凝管、蒸馏头、温 度计、温度计套管、尾接管、烧杯、漏斗、分液漏斗、乳胶管、浓HSO4、正丁醇、NaBr、 NaOH、无水CaCl2、NaHCO、沸石 药品及物理常数: 药品名称分子量 熔点(℃)沸点(℃)密 度水溶解度(g/100如1) /(g/c) 正丁爵7412 88.9 117.25 0.8098 微溶于水 溴化钠 102.89 浓硫酸 1.84 易溶于水 正溴丁烷 137.03 112 101.6 1.270-1.277难溶于水,易溶于醇 和酵 四、实验装置图 回流(含气体吸收)装置 五、实验步骤 1、组装回馏装置 先下后上,先左后右,依次组装三颈圆底烧瓶、球形冷凝管和溴化氢吸收装置,用 稀的氢氧化钠溶液作吸收剂(注意:倒立的三角漏斗口要恰好接触水面,不能侵入水中, 防止倒吸)。 2、加样 (1)取18mL水置于小烧杯中,向其中缓慢加入18mL(约0.33mol)浓硫酸(注意: 加入过程中应边滴加边用玻璃棒搅拌,防治液体飞搬)。 (2)向上述溶液中缓慢滴加13mL正丁醇(0.14mol)(边加边搅拌),并将混合 均匀的硫酸和正丁醇混合液加入到已经搭建好装置的圆底烧瓶中,并加入1-3粒沸石。 215
2 / 5 电热套(带磁力搅拌)、磁转子、圆底烧瓶、球形冷凝管、直型冷凝管、蒸馏头、温 度计、温度计套管、尾接管、烧杯、漏斗、分液漏斗、乳胶管、浓 H2SO4、正丁醇、NaBr、 NaOH、无水 CaCl2、NaHCO3、沸石 药品及物理常数: 四、实验装置图 五、实验步骤 1、组装回馏装置 先下后上,先左后右,依次组装三颈圆底烧瓶、球形冷凝管和溴化氢吸收装置,用 稀的氢氧化钠溶液作吸收剂(注意:倒立的三角漏斗口要恰好接触水面,不能侵入水中, 防止倒吸)。 2、加样 (1)取 18mL 水置于小烧杯中,向其中缓慢加入 18mL(约 0.33 mol)浓硫酸(注意: 加入过程中应边滴加边用玻璃棒搅拌,防治液体飞溅)。 (2)向上述溶液中缓慢滴加 13mL 正丁醇(0.14 mol)(边加边搅拌),并将混合 均匀的硫酸和正丁醇混合液加入到已经搭建好装置的圆底烧瓶中,并加入 1-3 粒沸石

(3)称取17g研细的无水溴化钠(0.165mol),从三颈烧瓶侧口加入到硫酸和正 丁醇混合液中,立刻塞好烧瓶塞。 3、回流 打开冷凝水,小火加热至沸腾,使反应物保持沸腾,平稳回流45min。 4、蒸馏 关掉加热电源,使反应液冷却,卸下球形冷凝管,重新加入几粒沸石,改为蒸馏装 置(蒸馏头、温度计套管、温度计、尾接管、盛有20L蒸馏水的圆底烧瓶),加热蒸 馏出粗的1-溴丁烷直至反应瓶中油层消失而馏出液中无油滴蒸出(可用烧杯盛放清水接 一滴馏分,如果没有油膜或油滴现象,表示有机物已经蒸出)。 5、洗涤 (1)将馏出液转至分液漏斗中,加入等体积的水洗涤,除去水层(产物层在哪层?) (2)将粗产物转入分液漏斗中,并向其中加入加等体积的浓硫酸洗涤,静置,放 出浓硫酸层(产物层在哪层?) (3)将上述所得有机层粗产品用等体积的水洗涤,取有机层(产物层在哪层?) (4)加入等体积饱和NaHCO,溶液洗涤(产物层在哪层?) (5)加入等体积水洗涤(产物层在哪层?) 6、干燥、称重并计算产率 将上述5步洗涤得到的有机层样品转移至干燥的窄口瓶(如锥形瓶、碘量瓶等)中 加入适量无水CC2干燥(干燥完全后粗产品溶液变为澄清液体且氯化钙呈分散颗粒 状),干燥后转移至称过重的干净烧杯中称重,计算产率。 六、注意事项 1、溴化钠要先磨细,再称量,防止结块。 2、加料顺序不能改变,尤其要先加水,后加浓硫酸:每次加料,均要搅拌摇匀。 3、倒立的三角漏斗口要恰好接触水面,不能侵入水中,防止倒吸。 4、正溴丁烷是否蒸完,可以从以下几方面判断: (1)馏出液是都由浑浊变为澄清: (2)反应瓶上层油层是否消失: 315
3 / 5 (3)称取 17g 研细的无水溴化钠(0.165 mol),从三颈烧瓶侧口加入到硫酸和正 丁醇混合液中,立刻塞好烧瓶塞。 3、回流 打开冷凝水,小火加热至沸腾,使反应物保持沸腾,平稳回流 45 min。 4、蒸馏 关掉加热电源,使反应液冷却,卸下球形冷凝管,重新加入几粒沸石,改为蒸馏装 置(蒸馏头、温度计套管、温度计、尾接管、盛有 20 mL 蒸馏水的圆底烧瓶),加热蒸 馏出粗的 1-溴丁烷直至反应瓶中油层消失而馏出液中无油滴蒸出(可用烧杯盛放清水接 一滴馏分,如果没有油膜或油滴现象,表示有机物已经蒸出)。 5、洗涤 (1)将馏出液转至分液漏斗中,加入等体积的水洗涤,除去水层(产物层在哪层?) (2)将粗产物转入分液漏斗中,并向其中加入加等体积的浓硫酸洗涤,静置,放 出浓硫酸层(产物层在哪层?) (3)将上述所得有机层粗产品用等体积的水洗涤,取有机层(产物层在哪层?) (4)加入等体积饱和 NaHCO3 溶液洗涤(产物层在哪层?) (5)加入等体积水洗涤(产物层在哪层?) 6、干燥、称重并计算产率 将上述 5 步洗涤得到的有机层样品转移至干燥的窄口瓶(如锥形瓶、碘量瓶等)中, 加入适量无水 CaCl2 干燥(干燥完全后粗产品溶液变为澄清液体且氯化钙呈分散颗粒 状),干燥后转移至称过重的干净烧杯中称重,计算产率。 六、注意事项 1、溴化钠要先磨细,再称量,防止结块。 2、加料顺序不能改变,尤其要先加水,后加浓硫酸;每次加料,均要搅拌摇匀。 3、倒立的三角漏斗口要恰好接触水面,不能侵入水中,防止倒吸。 4、正溴丁烷是否蒸完,可以从以下几方面判断: (1)馏出液是都由浑浊变为澄清; (2)反应瓶上层油层是否消失;

(3)可用烧杯盛放清水接一滴馏分,如果没有油珠或油膜出现,表示有机物己经蒸出 (蒸馏不溶于水的有机化合物时,常用此法检验)。 5、反应完后要用浓硫酸除去未反应的醇和副反应生成的醚(与硫酸形成车羊盐),再用 水和饱和NaHCO,溶液除去浓硫酸,以防产物碳化。 6、如水洗产物后依旧呈红色,由于浓硫酸的氧化作用生成游离溴的缘故,可以加几毫 升饱和亚硫酸氢钠溶液洗涤除去。 七、思考题 1、加料时,能否先使溴化钠和浓硫酸混合,然后再加正丁醇和水?为什么? 答:不能,若先将溴化钠和浓硫酸混合,会立马产生溴化氢气体,会有部分溴化氢气体 来不及与正丁醇发生反应,使得产率降低,此外,如果没有正丁醇和水稀释,浓硫酸的 氧化性很强,会将溴化钠氧化成溴,发生的不是亲核反应,因此副产物增加。 2、本实验中硫酸的作用是什么?其用量和浓度过大或过小有什么不好? 答:反应物、催化剂。过大时,反应生成大量的B跑出,且易将溴离子氧化为溴单 质:过小时,反应不完全:过小时反应不能进行,或反应不充分。 3、反应后的粗产物中含有哪些杂质?各步骤洗涤的目的何在? 答:可能含有杂质为:n-C,H,OH,(-CHhO,HBr,n-CHBr,H,O,丁烯,二氧化 硫,溴单质 各步洗涤目的:①水洗除HBr、大部分-CH,OH,二氧化硫,溴单质等易溶于水的杂 质②浓硫酸洗去(血-C,Hg20,丁烯,余下的n-CH,OH③再用水洗除大部分H,SO,④用 NaHCO,洗除余下的HSO,⑤最后用水洗除NaHSO,与过量的NaHCO,等残留物。 4、分液漏斗洗涤产物是,在不清楚产物密度时,可采取什么渐变方法加以判别? 答:从分液漏斗中分别取一点上层液或放出一点下层液于一盛水试管中,看是否有分 层及油珠出现来判断,若上层有则在上层,反之相反。 5、为什么用饱和碳酸氢钠溶液洗涤前要用水洗涤一次? 答:先用水洗,可以除去一部分硫酸,防止用碳酸氢钠洗时,碳酸氢钠与硫酸反应生成 大量二氧化碳气体,使分液漏斗中压力过大,导致活塞蹦出,再用饱和碳酸氢钠溶液洗可进 一步除去硫酸,洗涤振摇过程要注意放气。 6、用分液漏斗洗涤产物时,为什么摇动后要及时放气?应该如何操作? 415
4 / 5 (3)可用烧杯盛放清水接一滴馏分,如果没有油珠或油膜出现,表示有机物已经蒸出 (蒸馏不溶于水的有机化合物时,常用此法检验)。 5、反应完后要用浓硫酸除去未反应的醇和副反应生成的醚(与硫酸形成钅羊盐),再用 水和饱和 NaHCO3溶液除去浓硫酸,以防产物碳化。 6、如水洗产物后依旧呈红色,由于浓硫酸的氧化作用生成游离溴的缘故,可以加几毫 升饱和亚硫酸氢钠溶液洗涤除去。 七、思考题 1、加料时,能否先使溴化钠和浓硫酸混合,然后再加正丁醇和水?为什么? 答:不能,若先将溴化钠和浓硫酸混合,会立马产生溴化氢气体,会有部分溴化氢气体 来不及与正丁醇发生反应,使得产率降低,此外,如果没有正丁醇和水稀释,浓硫酸的 氧化性很强,会将溴化钠氧化成溴,发生的不是亲核反应,因此副产物增加。 2、本实验中硫酸的作用是什么?其用量和浓度过大或过小有什么不好? 3、反应后的粗产物中含有哪些杂质?各步骤洗涤的目的何在? 4、分液漏斗洗涤产物是,在不清楚产物密度时,可采取什么渐变方法加以判别? 5、为什么用饱和碳酸氢钠溶液洗涤前要用水洗涤一次? 6、用分液漏斗洗涤产物时,为什么摇动后要及时放气?应该如何操作?

答:在此过程中,摇动后会产生气体,使得漏斗内的压力大大超过外界大气压,如果 不经常放气,塞子就可能被顶开而出现漏液。 操作如下:将漏斗下口倾斜向上,朝向无人处,无明火处,打开活塞,及时放气。 5/5
5 / 5