
期南人久科发学院渊獍亚程院 2-甲基-2-己醇的制备
2-甲基-2-己醇的制备

南人久科技学院材环獍亚程院 一.实验目的 l、学习通过格氏(Grignard)试剂制备醇的原理; 2、训练无水操作及磁力搅拌操作等实验技术
一. 实验目的 • 1、学习通过格氏(Grignard)试剂制备醇的原理; • 2、训练无水操作及磁力搅拌操作等实验技术

期南人久科发学院材獍亚髋 二.实验原理 知错能改,并坚持努 ·格氏试剂,又称格林尼亚(Grignard)试剂,是指烃基卤化镁 力付出,必定有所回 (RMgX)一类有机金属化合物。此类化合物为法国化学家格林尼亚6 报,努力成为对国家 于1900年发现,他也因此获得1912年诺贝尔化学奖。 ● 社会有用之人 ·格氏试剂的制备:卤代烃在无水乙醚或四氢呋喃(THF)中和金属镁 作用生成烷基卤化镁。 RX Et2O/THF + Mg RMgX 卤代烃反应活性:RI>RBr>RC RMgX H2O RH Mg(OH)X 反应条件:无水、无氧、无CO。 RMgX 02 ROMgX 0 RMgX C02 R OMgX 反应条件:控制卤代烷滴加速度 RMgX RX R—R MgX2 乙藏醚的作用.形成络合物,溶剂化作用;醚蒸气(隔绝空气)
二. 实验原理 • 格氏试剂,又称格林尼亚(Grignard)试剂,是指烃基卤化镁 (RMgX)一类有机金属化合物。此类化合物为法国化学家格林尼亚 于1900年发现,他也因此获得1912年诺贝尔化学奖。 • 格氏试剂的制备:卤代烃在无水乙醚或四氢呋喃(THF)中和金属镁 作用生成烷基卤化镁。 反应条件:无水、无氧、无CO2 卤代烃反应活性:RI > RBr > RCl 乙醚的作用:形成络合物;溶剂化作用;醚蒸气(隔绝空气) 反应条件:控制卤代烷滴加速度 知错能改,并坚持努 力付出,必定有所回 报,努力成为对国家, 社会有用之人
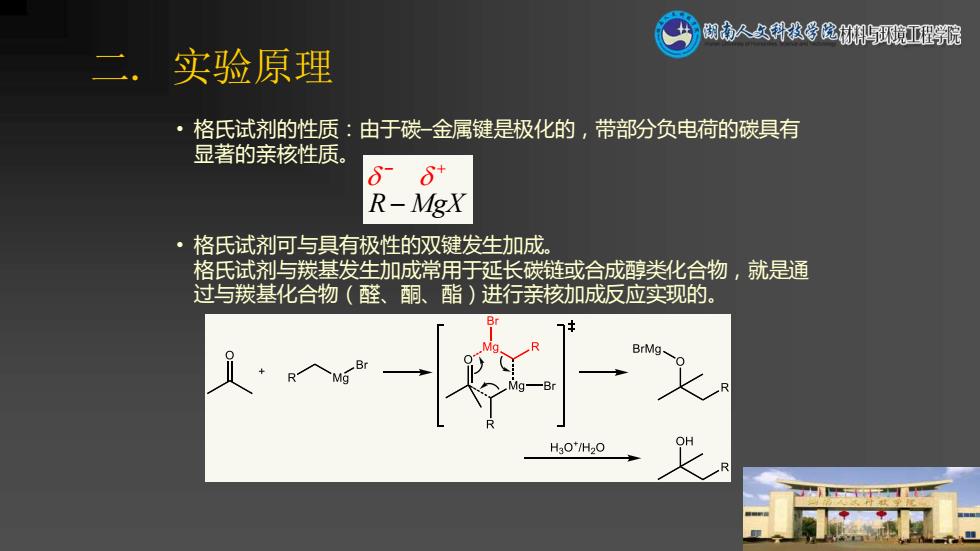
閉人久科投学院林环獍亚程髋 二. 实验原理 格氏试剂的性质:由于碳金属键是极化的,带部分负电荷的碳具有 显著的亲核性质。 8 R-MgX 格氏试剂可与具有极性的双键发生加成。 格氏试剂与羰基发生加成常用于延长碳链或合成醇类化合物,就是通 过与羰基化合物(醛、酮、酯)进行亲核劾加成反应实现的。 BrMg HaO/H2O
二. 实验原理 • 格氏试剂的性质:由于碳–金属键是极化的,带部分负电荷的碳具有 显著的亲核性质。 • 格氏试剂可与具有极性的双键发生加成。 格氏试剂与羰基发生加成常用于延长碳链或合成醇类化合物,就是通 过与羰基化合物(醛、酮、酯)进行亲核加成反应实现的。 R MgX − + −
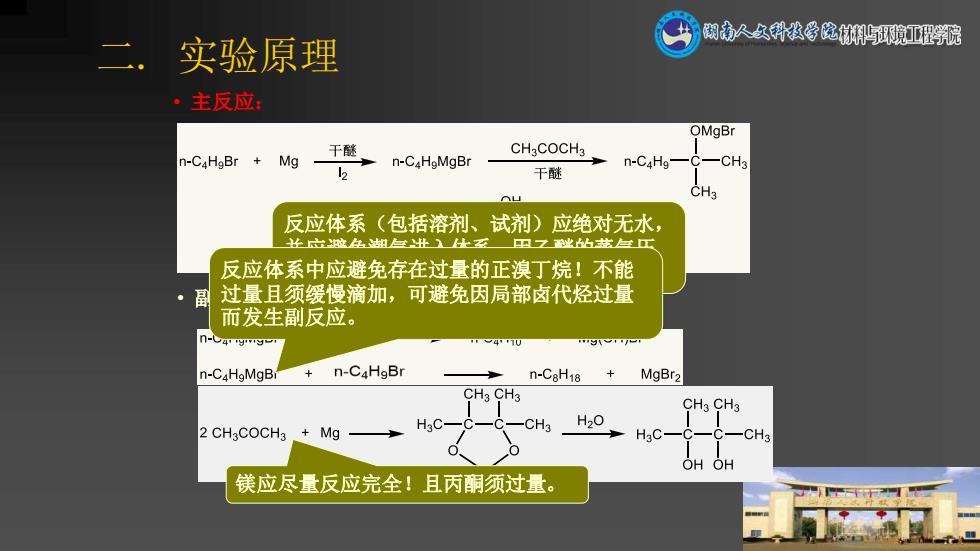
二.实验原理 闲南人女科发学院渊环獍亚理院 ·主反应: OMgBr CHaCOCH3 n-C4HgBr Mg 干醚 n-C4HgMgBr n-C4Hg- CH3 2 干醚 CH3 反应体系(包括溶剂、试剂)应绝对无水, 止出位生组出上乏里☑业h步兰工 反应体系中应避免存在过量的正溴丁烷!不能 过量且须缓慢滴加,可避免因局部卤代烃过量 而发生副反应。 n-a n-CaHaMgB n-C4HgBr n-CaH18 MgBr2 CH3 CH3 CH3 CH3 H20 2 CH3COCH3 Mg CH3 HgC-C -C一CH3 OH OH 镁应尽量反应完全!且丙酮须过量
二. 实验原理 • 主反应: • 副反应: 反应体系(包括溶剂、试剂)应绝对无水, 并应避免潮气进入体系。因乙醚的蒸气压 较大,水汽不易进入。 镁应尽量反应完全!且丙酮须过量。 反应体系中应避免存在过量的正溴丁烷!不能 过量且须缓慢滴加,可避免因局部卤代烃过量 而发生副反应
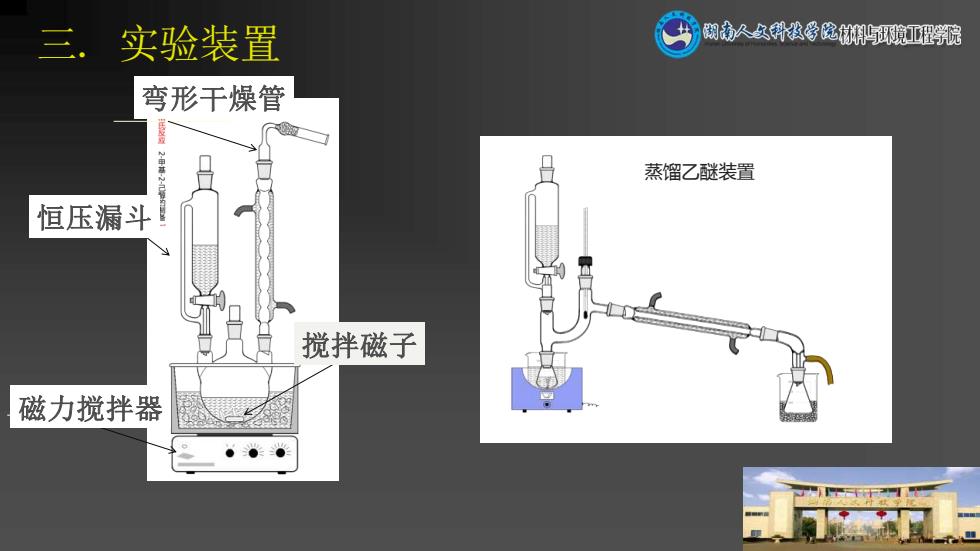
三.实验装置 闲南人久科技学院材环獍亚程院 弯形干燥管 ■ 蒸馏乙醚装置 恒压漏斗」 搅拌磁子 磁力搅拌器
三. 实验装置 磁力搅拌器 搅拌磁子 恒压漏斗 弯形干燥管 蒸馏乙醚装置
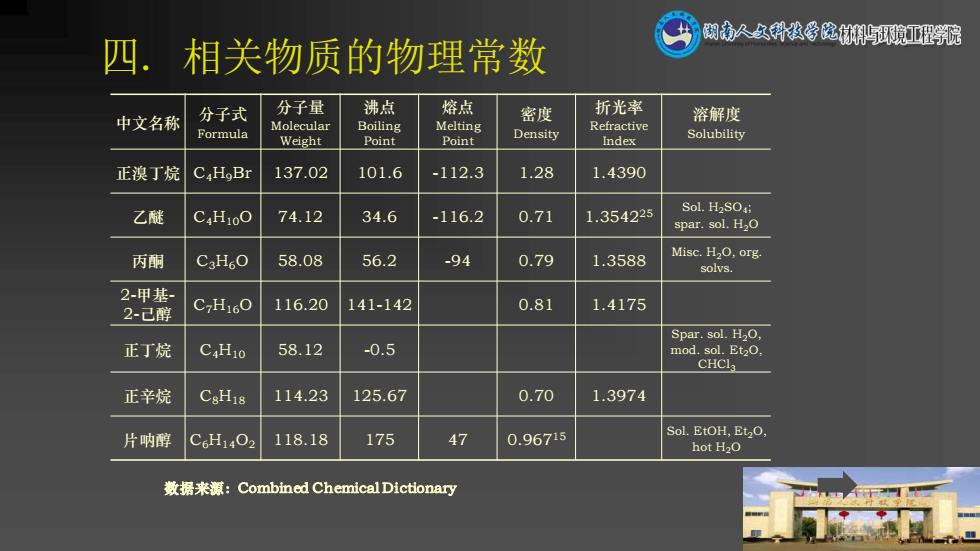
糊南人久科教学院环獍亚程乳院 四.相关物质的物理常数 分子式 分子量 沸点 熔点 中文名称 密度 折光率 溶解度 Molecular Formula Boiling Melting Refractive Weight Point Point Density Index Solubility 正溴丁烷 C.HoBr 137.02 101.6 -112.3 1.28 1.4390 乙醚 C4H10O 74.12 34.6 -116.2 0.71 1.354225 Sol.H2SO; spar.sol.H2O 丙酮 CgH。O 58.08 56.2 -94 0.79 1.3588 Misc.H2O,org. solvs. 2-甲基 2-己醇 CH160 116.20 141-142 0.81 1.4175 Spar.sol.HO, 正丁烷 CHio 58.12 -0.5 mod.sol.Et20. CHCI3 正辛烷 CsHis 114.23 125.67 0.70 1.3974 片呐醇 C6H1402 118.18 175 47 0.96715 Sol.EtOH,Et2O, hot H2O 数据来源:Combined Chemical Dictionary
四. 相关物质的物理常数 中文名称 分子式 Formula 分子量 Molecular Weight 沸点 Boiling Point 熔点 Melting Point 密度 Density 折光率 Refractive Index 溶解度 Solubility 正溴丁烷 C4H9Br 137.02 101.6 -112.3 1.28 1.4390 乙醚 C4H10O 74.12 34.6 -116.2 0.71 1.354225 Sol. H2SO4; spar. sol. H2O 丙酮 C3H6O 58.08 56.2 -94 0.79 1.3588 Misc. H2O, org. solvs. 2-甲基- 2-己醇 C7H16O 116.20 141-142 0.81 1.4175 正丁烷 C4H10 58.12 -0.5 Spar. sol. H2O, mod. sol. Et2O, CHCl3 正辛烷 C8H18 114.23 125.67 0.70 1.3974 片呐醇 C6H14O2 118.18 175 47 0.96715 Sol. EtOH, Et2O, hot H2O 数据来源:Combined Chemical Dictionary

閉人久科投学院鸭环獍亚程髋 五.实验步骤 >正丁基溴化镁的制备 1、安装仪器装置:150mL三颈烧瓶 2、加料: ·三口烧瓶:1.50模缘.15m无水乙醚.一小特 。 3度费斗:6.,4m匹T院15ml无冰妃盘。 ·从恒压漏斗滴加入5混合液到三口烧瓶中,数 分钟后反应开始,溶液微沸,碘颜色消失; ·反应缓和时,自冷凝管上端加入5mL水2: 启动磁力搅拌,并加入其金的正前鼎合 物。控制滴加速度维持反应液呈微沸状态。 ·滴加完毕后,再水浴回流20分钟,使镁屑几乎作 用完全
五. 实验步骤 ➢正丁基溴化镁的制备 1、安装仪器装置:150mL三颈烧瓶 2、加料: 3、反应: • 三口烧瓶:1.5g镁条、15mL无水乙醚、一小粒 碘。 • 恒压漏斗:6.4mL正溴丁烷、15mL无水乙醚。 • 从恒压漏斗滴加入5mL混合液到三口烧瓶中,数 分钟后反应开始,溶液微沸,碘颜色消失; • 反应缓和时,自冷凝管上端加入25mL无水乙醚; 启动磁力搅拌,并滴加入其余的正溴丁烷醚混合 物。控制滴加速度维持反应液呈微沸状态。 • 滴加完毕后,再水浴回流20分钟,使镁屑几乎作 用完全

期南人久科发学院材獍亚学髋 五.实验步骤 >2-甲基-2-己醇的制备 在冰水浴冷却及磁力搅拌下,从恒压漏斗滴加入 10ml丙丽和15ml无水乙耐的混合液;控制滴 加速度,勿使反应过于剧烈;滴加完后,继续搅 拌15分钟。 ·将反应瓶在冰水浴冷却和搅拌下,从恒压液斗分 批幼加入60mL10%酸溶液,分解产物(开始滴 入宜慢,以后可逐渐加快); ·待分解完全后,将反应瓶中的溶液倒入分液漏斗 中,分出水层和醚层。 ·水层每次用25L乙萃取两次,合并全部醚层, 用30mL5%咸削溶液洗涤一次。 ·醚层用适量的无水盟牌干燥并静置数分钟
五. 实验步骤 ➢2–甲基–2–己醇的制备 • 在冰水浴冷却及磁力搅拌下,从恒压漏斗滴加入 10mL丙酮和15mL无水乙醚的混合液;控制滴 加速度,勿使反应过于剧烈;滴加完后,继续搅 拌15分钟。 • 将反应瓶在冰水浴冷却和搅拌下,从恒压液斗分 批加入60mL10%硫酸溶液,分解产物(开始滴 入宜慢,以后可逐渐加快); • 待分解完全后,将反应瓶中的溶液倒入分液漏斗 中,分出水层和醚层。 • 水层每次用25mL乙醚萃取两次,合并全部醚层, 用30mL5%碳酸钠溶液洗涤一次。 • 醚层用适量的无水碳酸钾干燥并静置数分钟

糊南人久科技学院材环獍亚程院 五.实验步骤 >2-甲基-2-己醇的制备(续) ·将干燥后的粗产物醚溶液滤入筒形(滴液)漏斗 或恒压漏斗中,安装低沸点易燃液体连续蒸馏装 置,用温水浴蒸去乙醚; ·乙醚全部蒸出后改成常用蒸馏装置,在电加热套 中空气浴加热蒸出最终产品,收集137~141℃ 馏分。量取馏分体积,取少量液体测定其折光率
五. 实验步骤 ➢2–甲基–2–己醇的制备(续) • 将干燥后的粗产物醚溶液滤入筒形(滴液)漏斗 或恒压漏斗中,安装低沸点易燃液体连续蒸馏装 置,用温水浴蒸去乙醚; • 乙醚全部蒸出后改成常用蒸馏装置,在电加热套 中空气浴加热蒸出最终产品,收集137~141℃ 馏分。量取馏分体积,取少量液体测定其折光率