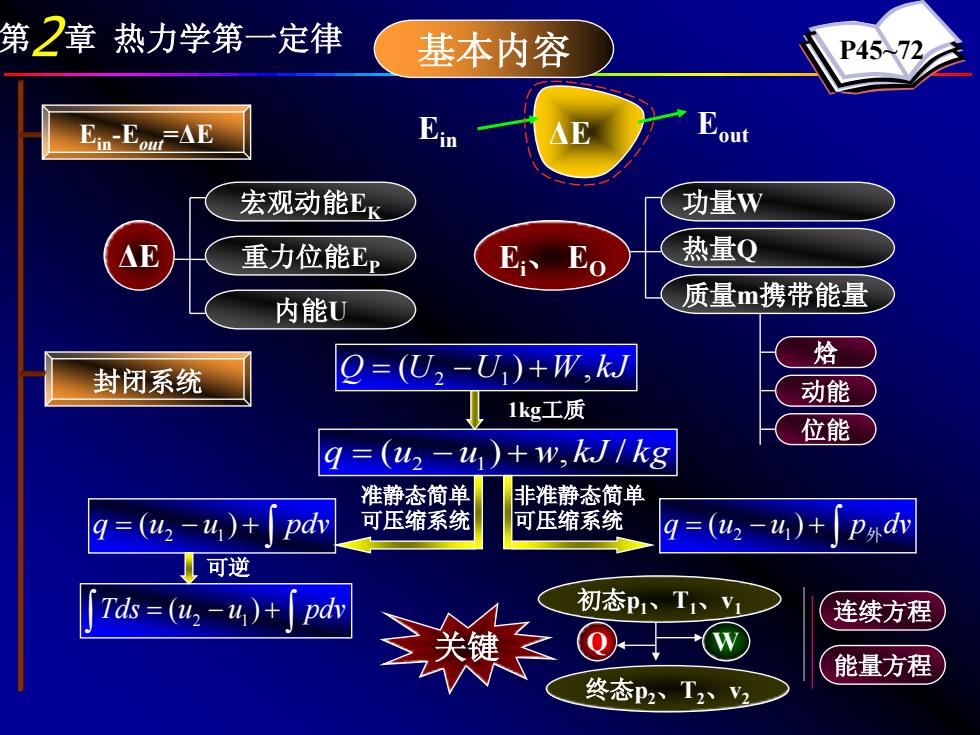
第2章热力学第一定律 基本内容 P45-72 Ein-Eo△E Ein 宏观动能EK 功量W △E 重力位能E E、 Eo 热量Q 内能U 质量m携带能量 焓 封闭系统 2=(U2-U)+W,kJ 动能 1kg工质 位能 q=(42-4)+w,kJ1kg 准静态简单 非准静态简单 9=(42-4)+p 可压缩系统 可压缩系统 9=(u2-4)+ P外d 可逆 「Td=(42-4)+Jpdh 初态P1、TV1 连续方程 能量方程 终态p2T2V2
第2章 热力学第一定律 基本内容 P45~72 Ein ΔE Eout ΔE 宏观动能EK 重力位能EP 内能U 功量W 热量Q 质量m携带能量 Ei 、 EO 封闭系统 q = (u2 − u1) + w, kJ / kg 可逆 ∫ q = (u − u ) + pdv 2 1 ∫ q = (u − u ) + p外dv 2 1 ∫ ∫ Tds = (u − u ) + pdv 2 1 Q (U U ) W, kJ = 2 − 1 + 准静态简单 可压缩系统 非准静态简单 可压缩系统 1kg工质 关键 初态p1、T1、v1 终态p2、T2、v2 Q W 连续方程 能量方程 Ein-Eout=ΔE 焓 动能 位能
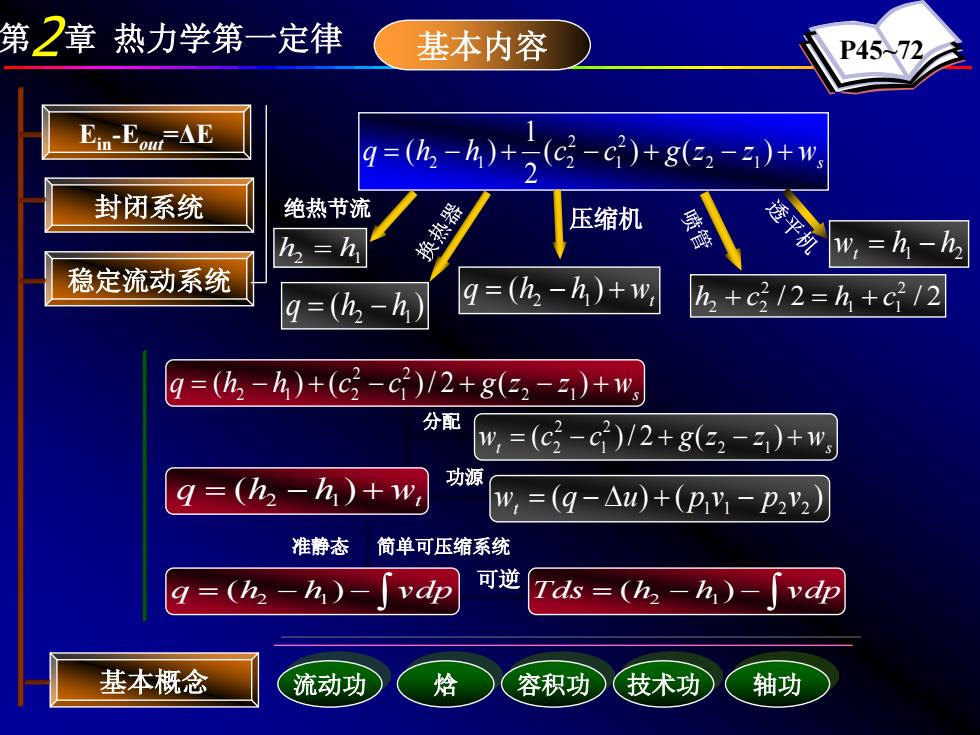
第2章热力学第一定律 基本内容 P4572 E1n-Eo△E 9=(h-h)+(c-C)+g32-)+w 封闭系统 绝热节流 换热器 压缩机 透 h,=h w,=h-h 稳定流动系统 g=(h-h q=(h2-h)+w h2+c/2=h+c2/2 9=(h-h)+(c-c)/2+g32-)+w, 分配 w,=(c2-c)/2+g(32-)+", q=(h2-h)+w, 功源 w,=(q-△u)+(PY-p2V2) 准静态 简单可压缩系统 q=(h2-h) vdp 可逆 Tds=(h2-h)-「vdp 基本概念 流动功 焓 容积功 技术功 轴功
第2章 热力学第一定律 基本内容 P45~72 ws q = h − h + (c − c ) + g(z − z ) + 2 1 ( ) 2 1 2 1 2 2 1 2 封闭系统 稳定流动系统 可逆 wt q = (h2 − h1) + 压缩机 ( ) 2 1 q = h − h 绝热节流 h2 = h1 / 2 / 2 2 1 1 2 2 2 h + c = h + c 1 2 w h h t = − 分配 功源 准静态 简单可压缩系统 基本概念 Ein-Eout=ΔE 流动功 焓 容积功 技术功 轴功 ws q = (h − h ) + (c − c )/ 2 + g(z2 − z1) + 2 1 2 2 1 2 t ws w = (c − c )/ 2 + g(z2 − z1) + 2 1 2 2 q = h − h + wt ( ) 2 1 ( ) ( ) 1 1 2 2 w q u p v p v t = − ∆ + − ∫ q = (h2 − h1) − vdp ∫ Tds = (h2 − h1) − vdp
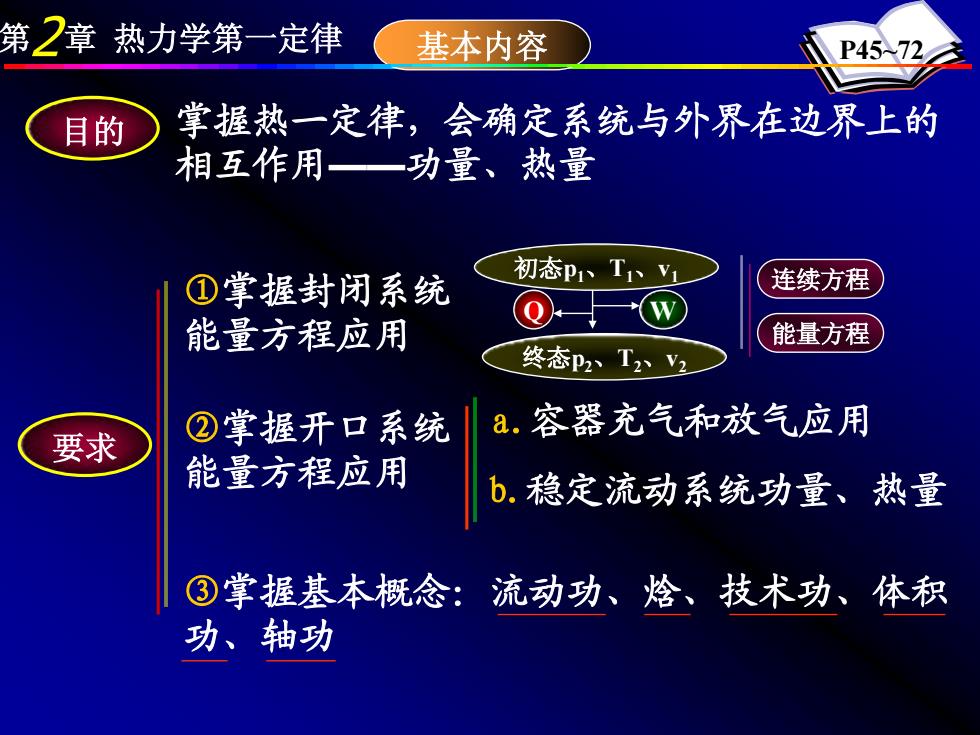
第2章热力学第一定律 基本内容 P45入72 目的 掌握热一定律,会确定系统与外界在边界上的 相互作用—功量、热量 ①掌握封闭系统 初态P1、T1V1 连续方程 能量方程应用 能量方程 终态p2、T2V2 a.容器充气和放气应用 要求 ②掌握开口系统 能量方程应用 b.稳定流动系统功量、热量 ③掌握基本概念: 流动功、焓、技术功、体积 功、轴功
第2章 热力学第一定律 基本内容 P45~72 掌握热一定律,会确定系统与外界在边界上的 相互作用——功量、热量 要求 ①掌握封闭系统 能量方程应用 ②掌握开口系统 能量方程应用 目的 初态p1、T1、v1 终态p2、T2、v2 Q W 连续方程 能量方程 a.容器充气和放气应用 b.稳定流动系统功量、热量 ③掌握基本概念:流动功、焓、技术功、体积 功、轴功

第2章热力学第一定律 P4572 2-1热力学第一定律的实质 一热一定律实质 能量守恒定律同生物进化论、细胞的发现被恩 格斯誉为19世纪的三个最伟大的科学发现。 二热能 热能:组成物质的分子、原子等微观粒子由于杂乱 无章热运动而具有的能量。 热运动:分子移动、转动、振动一内动能 热能 分子运动在分子力场中具有的位能一内位能
第2章 热力学第一定律 P45~72 2-1热力学第一定律的实质 一.热一定律实质 能量守恒定律同生物进化论、细胞的发现被恩 格斯誉为19世纪的三个最伟大的科学发现。 二.热能 分子运动在分子力场中具有的位能——内位能 热能 热能:组成物质的分子、原子等微观粒子由于杂乱 无章热运动而具有的能量。 热运动:分子移动、转动、振动——内动能

第2章热力学第一定律 P4572 2-2热力学第一定律表达式 一.热一定律表达式 进入系统的能量-离开系统的能量=系统存储能量的变化 进入系统能量 离开系统能量 Eout En-EM=E2-E1=△E 系统存储能的增量 或E,n=△E+Eou 二存储能、 内存储能:与系统所处的热力状态有关 外存储能:与系统整体宏观运动状态有关 内存储能(内能):U,kJ;u=Um,kJ/kg 内动能1热能 内位能 一般不涉及化学反应、核 内能 反应,化学能、原子核能 化学能、原子能 不变,内能又称内热能
第2章 热力学第一定律 P45~72 2-2热力学第一定律表达式 一.热一定律表达式 进入系统的能量-离开系统的能量=系统存储能量的变化 Ein − Eout = E2 − E1 = ∆E 或 Ein = ∆E + Eout 二.存储能 内存储能:与系统所处的热力状态有关 外存储能:与系统整体宏观运动状态有关 内动能 内位能 热能 化学能、原子能 内能 一般不涉及化学反应、核 反应,化学能、原子核能 不变,内能又称内热能。 内存储能(内能):U,kJ;u=U/m,kJ/kg Ein 进入系统能量 Eout 离开系统能量 ΔE 系统存储能的增量

第2章热力学第一定律 P4572 2-2热力学第一定律表达式 二存储能 内存储能(内能):U,kJ;=Um,kJ/kg u=(T,V)状态参数 ∮du=0△u=42-4 宏观动能 外存储能 E=>mc 重力位能E,=mg 总存储能卫 E=U+E+E,1,e=u+c12+gz E2-E,=(U2-U)+(E2-E1)+(Ep2-Ep1)
第2章 热力学第一定律 P45~72 2-2热力学第一定律表达式 二.存储能 内存储能(内能):U,kJ;u=U/m,kJ/kg 外存储能 宏观动能 2 2 1 E mc k = 重力位能 E mgz p = 总存储能E E =U + Ek + Ep e = u + c / 2 + gz 2 ( ) ( ) ( ) E2 − E1 = U2 −U1 + Ek 2 − Ek1 + Ep2 − Ep1 u = u(T,v) 状态参数 = 0 ∫ du ∆u = u2 − u1 1kg

第2章热力学第一定律 P4572 2-2热力学第一定律表达式 三流入、流出系统能量 质量具有存储能e=u+c2/2+g 相互 质量传递 质量流动传输能? 作用 能量传递功量、热量
第2章 热力学第一定律 P45~72 2-2热力学第一定律表达式 三.流入、流出系统能量 相互 作用 质量传递 能量传递 功量、热量 质量具有存储能 质量流动传输能 ? e = u + c / 2 + gz 2

第2章热力学第一定律 P4572 23封闭系统能量方程式 封闭系统能量方程式 进入系统的能量-离开系统的能量=系统存储能量的变化 条件:封闭系统 △(-mc2)≈0 △(mgz)≈0 质量具有存储能 相互 质量传递 质量流动传输能 作用 能量传递 功量、热量 E2-E=(U2-U)+(ExzE)+(Ep2=Ep) 方程: 微元 Q=(U2-U)+Wk39=(42-4)+w过程d=d+dw
第2章 热力学第一定律 P45~72 2-3封闭系统能量方程式 一.封闭系统能量方程式 进入系统的能量-离开系统的能量=系统存储能量的变化 相互 作用 质量传递 能量传递 功量、热量 质量具有存储能 质量流动传输能 ( ) ( ) ( ) E2 − E1 = U2 −U1 + Ek 2 − Ek1 + Ep2 − Ep1 条件:封闭系统 ) 0 2 1 ( 2 ∆ mc ≈ ∆(mgz) ≈ 0 方程: Q W ΔU Q = (U2 −U1) +W 1kg q = (u2 − u1) + w δq = du +δw 微元 过程
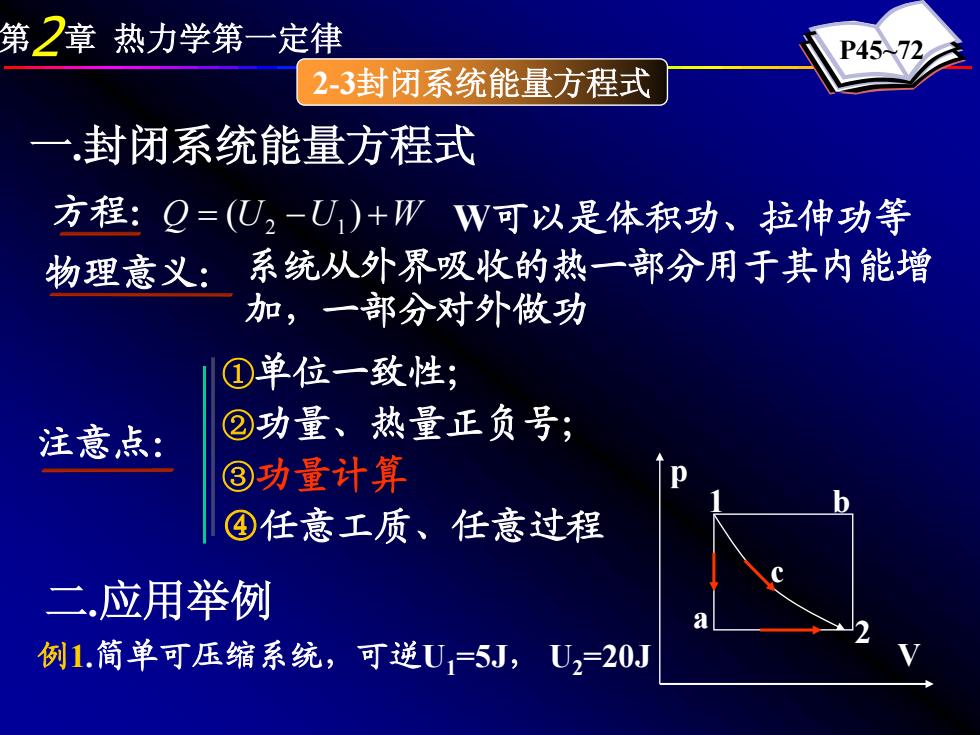
第2章热力学第一定律 P4572 23封闭系统能量方程式 一封闭系统能量方程式 方程:Q=(U2-U)+WW可以是体积功、拉伸功等 物理意义: 系统从外界吸收的热一部分用于其内能增 加,一部分对外做功 ①单位一致性 注意点: ②功量、热量正负号; ③功量计算 ④任意工质、任意过程 二应用举例 例1.简单可压缩系统,可逆U1=5J,U2=20J
第2章 热力学第一定律 P45~72 2-3封闭系统能量方程式 一.封闭系统能量方程式 方程:Q = (U2 −U1) +W W可以是体积功、拉伸功等 物理意义: 系统从外界吸收的热一部分用于其内能增 加,一部分对外做功 注意点: ①单位一致性; ②功量、热量正负号; ③功量计算 ④任意工质、任意过程 二.应用举例 例1.简单可压缩系统,可逆U1=5J, U2=20J p V 1 2 b a c

第2章热力学第一定律 P45-72 23封闭系统能量方程式 二应用举例 p U1=5J (1)1-c-2,Q=45J,W=30J (2)U=-20J,1-a,W=0J, Q=-25J U2=20J (3)a-2,Q=60J W=20J 注意:①过程的方向,U2-U1;②Q、W正负号 例2.一定量气体在气缸内体积由0.9m3可逆膨胀到1.4m3,过程中, 气体压力保持定值,且p=0.2MPa,若膨胀过程中气体内能增加 了12000J,求:①此过程中气体吸入或放出热量,②若活塞质 量为20kg,且初始时活塞静止,求终态时活塞速度。已知环境压 力po=0.1MPa
第2章 热力学第一定律 P45~72 2-3封闭系统能量方程式 (1)1-c-2,Q=45J,W= p V 1 2 b a c U1=5J U2=20J 30J (2)Ua =-20J,1-a, W= 0J,Q=-25J (3)a-2, Q=60J W=20J 注意: ①过程的方向,U2-U1; ② Q、W正负号 二.应用举例 例2.一定量气体在气缸内体积由0.9m3可逆膨胀到1.4m3,过程中, 气体压力保持定值,且p=0.2MPa,若膨胀过程中气体内能增加 了12000J,求: ①此过程中气体吸入或放出热量; ②若活塞质 量为20kg,且初始时活塞静止,求终态时活塞速度。已知环境压 力p0=0.1MPa