
第6章 热力学基础 )§6.1 热力学第一定律 §6.2 理想气体等值过程和绝热过程 §6.3 循环过程 §6.4 热力学第二定律 )§6.5 熵熵增加原理 §6.6 热力学第二定律的统计意义 玻尔兹曼熵
------------------------------------------------------------------------------- 第6章 热力学基础 §6.1 热力学第一定律 §6.2 理想气体等值过程和绝热过程 §6.3 循环过程 §6.4 热力学第二定律 §6.5 熵 熵增加原理 §6.6 热力学第二定律的统计意义 玻尔兹曼熵

以观察和实验为依据,从能量的观 点来说明热、功等基本概念,以及他们 之间相互转换的关系和条件。 K DH
------------------------------------------------------------------------------- 以观察和实验为依据,从能量的观 点来说明热、功等基本概念,以及他们 之间相互转换的关系和条件

§6.1热力学第一定律 一、内能功和热量 实际气体内能:所有分子热运动的动能和分子 势能的总和。 内能是状态量:E=E(T,V) 理想气体内能: E= RT 2 是状态参量T的单值函数。 系统内能改变的两种方式 1.做功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量
------------------------------------------------------------------------------- §6.1 热力学第一定律 一、内能 功和热量 实际气体内能:所有分子热运动的动能和分子 势能的总和。 内能是状态量: E = E(T,V ) 理想气体内能: RT i M M E mol 2 = 是状态参量T的单值函数。 系统内能改变的两种方式 1.做功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量

2.热量传递可以改变系统的内能 热量是过程量 使系统的状态改变,传热和作功是等效的 作功是系统热能与外界其它形式能量转换的量度。 热量是系统与外界热能转换的量度
------------------------------------------------------------------------------- 作功是系统热能与外界其它形式能量转换的量度。 2. 热量传递可以改变系统的内能 热量是过程量 热量是系统与外界热能转换的量度。 使系统的状态改变,传热和作功是等效的
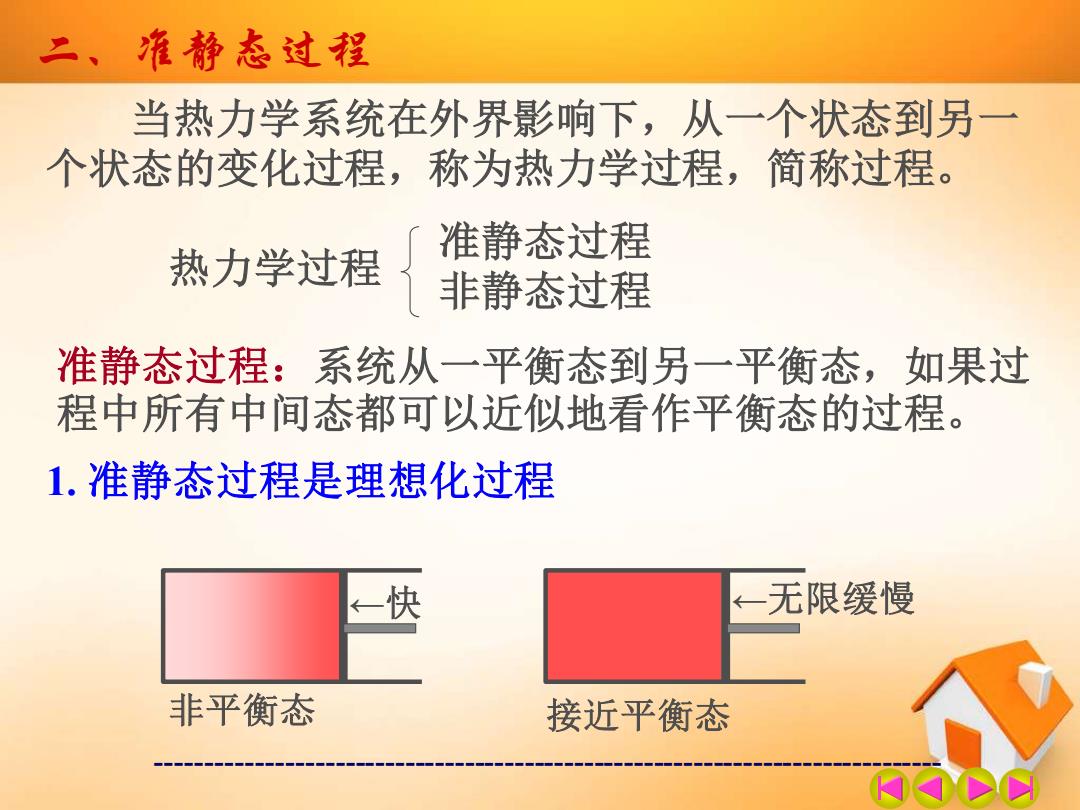
二、准静态过程 当热力学系统在外界影响下,从一个状态到另一 个状态的变化过程,称为热力学过程,简称过程。 准静态过程 热力学过程 非静态过程 准静态过程:系统从一平衡态到另一平衡态,如果过 程中所有中间态都可以近似地看作平衡态的过程。 1.准静态过程是理想化过程 快 ←一无限缓慢 非平衡态 接近平衡态
------------------------------------------------------------------------------- 二、准静态过程 当热力学系统在外界影响下,从一个状态到另一 个状态的变化过程,称为热力学过程,简称过程。 热力学过程 准静态过程 非静态过程 准静态过程:系统从一平衡态到另一平衡态,如果过 程中所有中间态都可以近似地看作平衡态的过程。 1. 准静态过程是理想化过程 非平衡态 ←快 ←无限缓慢 接近平衡态
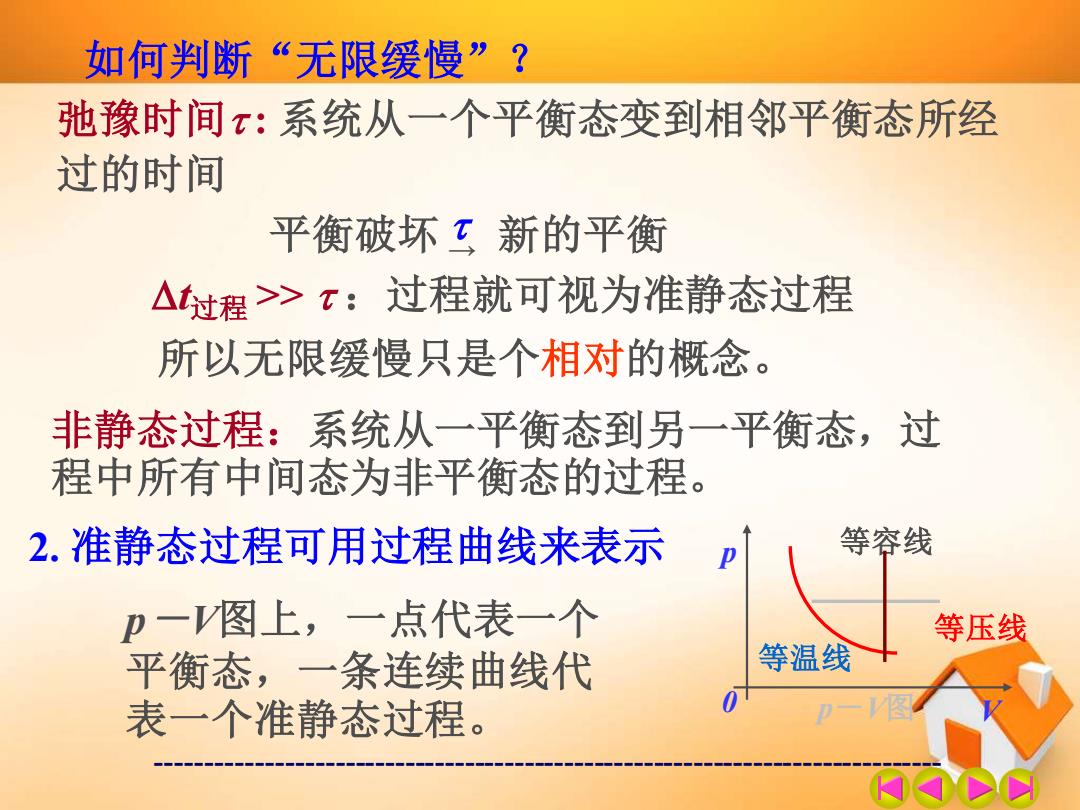
如何判断“无限缓慢”? 弛豫时间:系统从一个平衡态变到相邻平衡态所经 过的时间 平衡破坏?新的平衡 △过程>T:过程就可视为准静态过程 所以无限缓慢只是个相对的概念。 非静态过程:系统从一平衡态到另一平衡态,过 程中所有中间态为非平衡态的过程。 2.准静态过程可用过程曲线来表示 等容线 卫一图上,一点代表一个 等压线 平衡态,一条连续曲线代 等温线 表一个准静态过程 一图
------------------------------------------------------------------------------- 如何判断“无限缓慢”? 弛豫时间 : 系统从一个平衡态变到相邻平衡态所经 过的时间 平衡破坏 → 新的平衡 t过程 >> :过程就可视为准静态过程 所以无限缓慢只是个相对的概念。 非静态过程:系统从一平衡态到另一平衡态,过 程中所有中间态为非平衡态的过程。 2. 准静态过程可用过程曲线来表示 等温线 等压线 等容线 p-V图 p 0 V p-V图上,一点代表一个 平衡态,一条连续曲线代 表一个准静态过程
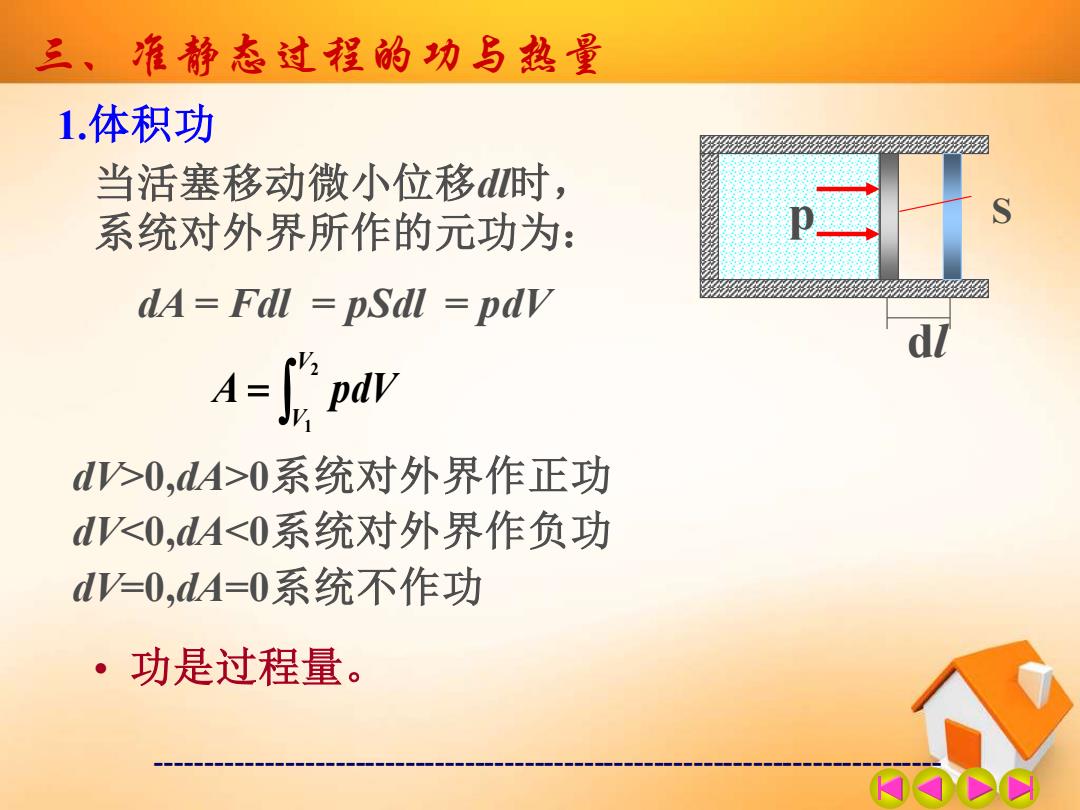
三、准静态过程的功与热量 1.体积功 当活塞移动微小位移d时, 系统对外界所作的元功为: dA=Fdl pSdl pdv Apdv d>0,dA>0系统对外界作正功 d<0,dA<0系统对外界作负功 d=0,dA=0系统不作功 ·功是过程量
------------------------------------------------------------------------------- 三、准静态过程的功与热量 1.体积功 p S dl 当活塞移动微小位移dl时, 系统对外界所作的元功为: dA = Fdl = pSdl = pdV = 2 1 V V A pdV dV>0,dA>0系统对外界作正功 dV<0,dA<0系统对外界作负功 dV=0,dA=0系统不作功 • 功是过程量

。作功改变系统热力学状态的微观实质: 分子规则 碰撞 分子无规则 运动的能量 运动的能量 ·功是系统与外界交换的能量的量度 2.准静态过程中热量的计算 热容量(C:系统在某一无限小过程中吸收热量Q 与温度变化T的比值称为系统在该过程的热容量. C= do dT 单位是JK1 热容量与比热的关系为C=Mc比
------------------------------------------------------------------------------- • 作功改变系统热力学状态的微观实质: 分子规则 运动的能量 碰撞 分子无规则 运动的能量 • 功是系统与外界交换的能量的量度 2.准静态过程中热量的计算 热容量(C) :系统在某一无限小过程中吸收热量dQ 与温度变化dT的比值称为系统在该过程的热容量. dT dQ C = 单位是J·K-1 热容量与比热的关系为 C=Mc 比
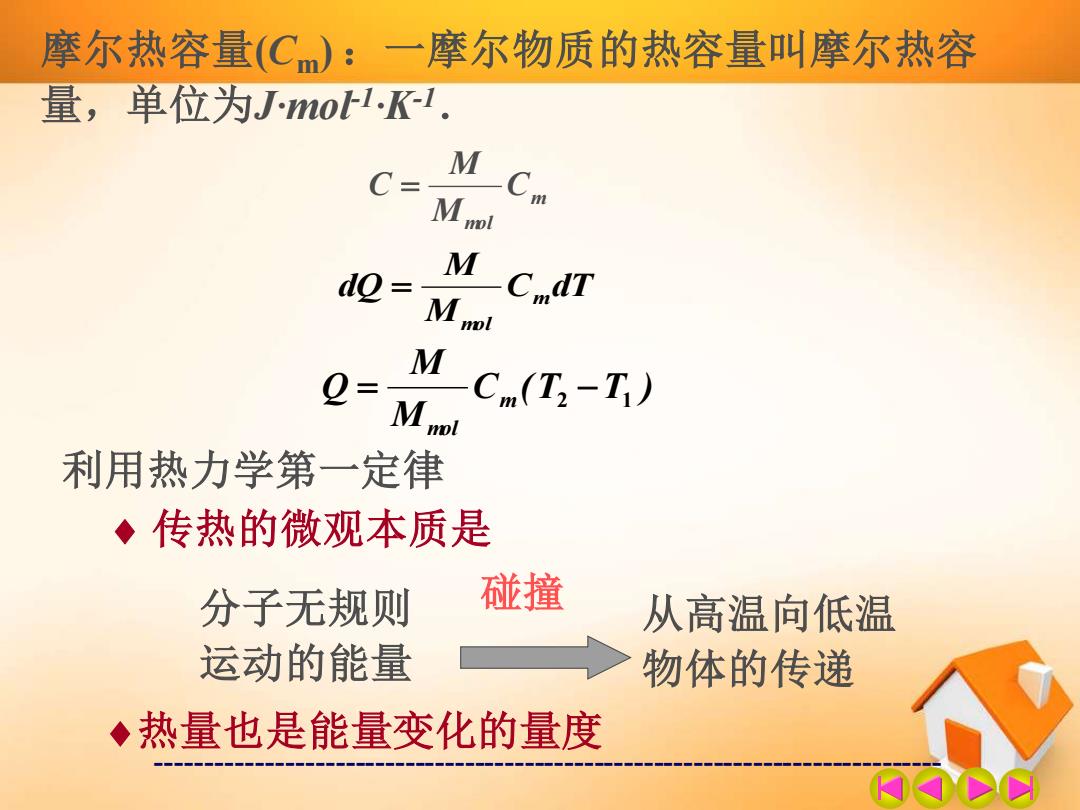
摩尔热容量(C):一摩尔物质的热容量叫摩尔热容 量,单位为Jmo1Kl. M C= Cm M Mnml 0= M Cm(T2-T) Mnol 利用热力学第一定律 ◆传热的微观本质是 分子无规则 碰撞 从高温向低温 运动的能量 物体的传递 ◆热量也是能量变化的量度
------------------------------------------------------------------------------- 摩尔热容量(Cm) :一摩尔物质的热容量叫摩尔热容 量,单位为J·mol-1·K-1. m mol C M M C = C (T T ) M M Q m mol = 2 − 1 C dT M M dQ m mol = 利用热力学第一定律 传热的微观本质是 分子无规则 运动的能量 碰撞 从高温向低温 物体的传递 热量也是能量变化的量度

四、热力学第一定律 对于任一过程,系统与外界可能同时有功和热 量的交换,且系统能量改变仅为内能时,根据能量守 恒有。 4E=+(A) 或 O=4E+A 规定: 系统吸热,Q>0, 放热,Q0,外界对系统做功,AO,内能减少E<0。 如果系统经历一微小变化过程,则 do dE dA 对准静态过程,可以分别表示为: dQ.=.dE.±pd☑
------------------------------------------------------------------------------- 四、热力学第一定律 对于任一过程 ,系统与外界可能同时有功和热 量的交换,且系统能量改变仅为内能时,根据能量守 恒有。 ΔE = Q + (-A) 或 Q = ΔE + A 规定: 系统吸热,Q>0,放热,Q0,外界对系统做功,A0,内能减少E<0。 如果系统经历一微小变化过程,则 dQ = dE + dA 对准静态过程,可以分别表示为: dQ = dE + pdV