
第十九章氨基酸蛋白质核酸 一学习目的和要求 1.掌握氨基酸的分类、常见氨基酸的结构和名称。 2.掌握氨基酸的合成方法及化学性质。 3,掌握蛋白质的性质。 4.理解多肽的一般结构。 5.了解蛋白质的一级结构、二级结构、三级结构和四级结构。 6.了解蛋白质的性质。 7.了解氨基酸、蛋白质在生命活动中的重要意义, 二.本章节重点、难点: 氨基酸、蛋白质的化学性质二十种常见氨基酸的名称和分类:蛋白质的四级结构 引言: 蛋白质和核酸都是天然高分子化合物,是生命物质的基础。我们知道,生命活动的基 本特征就是蛋白质的不断自我更新。蛋白质是一切活细胞的组织物质,也是酶、抗体和许 多激素中的主要物质。所有蛋白质都是α-由氨基酸构成的,因此,α-由氨基酸是建筑蛋白 质的砖石。要讨论蛋白质的结构和性质,首先要研究α-由氨基酸的化学 19.1氨基酸 19.11结构、分类、命名和构型 组成蛋白质的氨基酸(天然产氨基酸)都是α-氨基酸,即在α-碳原子上有一个氨基, 可用下式表示: R-C-COOH NH2 天然产的各种不同的ā-由氨基酸只R不同而已.氨基酸目前已知的已超过100种以上, 但在生物体内作为合成蛋白质的原料只有二十种(见P46表19-1)。 1.分类: 按烃基类型可分为脂肪族氨基酸,芳香族氨基酸,含杂环氨基酸

按分子中氨基和羧基的数目分为中性氨基酸,酸性氨基酸,碱性氨基酸。 2.命名:多按其来源或性质而命名。国际上有通用的符号(见P66表20-1)。 3.构型:用DL体系表示一在费歇尔投影式中氨基位于横键右边的为D型,位于 左边的为L型。例如 COOH COOH H-C-NH2 NH2一C-H R R D-氨基酸 L-氨基酸 天然氨基酸(出甘氨酸外)其他所有α,碳原子都是手性的,都有旋光性,而且发现主 要是L型的(也有D型的,但很少)。 19.12氨基酸的性质 1,氨基酸的酸-碱性一一两性与等电点 氨基酸分子中的氨基是碱性的,而线基是酸性的,因而氨基酸既能与酸反应,也能与 碱反应,是一个两性化合物。 R-CH-COOHH R-CH-COOH OH -R-CH-COO NHa NH2 NH2 (1)两性 氨基酸在一般情况下不是以游离的羧基或氨基存在的,而是两性电离,在固态或水溶 液中形成内盐。 R-CH-COOH±R-CH-COO NH> +NH3 (2)等电点 在氨基酸水溶液中加入酸或碱,至使羧基和氨基的离子化程度相等(即氨基酸分子所 带电荷呈中性一一处于等电状态)时溶液的pH值称为氨基酸的等电点。常以p表示

R-CH-COOH NH2 H© R-CH-COO三 =R-CH-COO NH2 NH OHO 溶液pH>等电点 等电点(p 溶液pH等电点 强调: a,等电点为电中性而不是中性(即pH=7),在溶液中加入电极时其电荷迁移为零, 中性氨基酸 pl=4.8-63 酸性氨基酸 pl=2.7-3.2 碱性氨基酸 pl=7.610.8 b.等电点时,偶极离子在水中的溶解度最小,易结品析出。 2.氨基酸氨基的反应 (1)氨基的酰基化氨基酸分子中的氨基能酰基化成酰胺。 乙酰氯、醋酸酐、苯甲酰氯邻苯二甲酸酐等都可用作酰化剂。在蛋白质的合成过程中 为了保护氨基则用苄氧甲酰氯作为酰化剂。 at-o8a+mtoo一Oo6o-8m&tco 选用苄氧甲酰氯这一特殊试剂,是因为这样的酰基易引入,对以后应用的种种试剂较 稳定,同时还能用多种方法把它脱下来。 (2)氨基的烃基化氨基酸与RX作用则烃基化成N烃基氨基酸: NO, R NO2 R NO-F+NH2 CH-COOH-NO-NH-CH-COOH 氟代二硝基苯在多肽结构分析中用作测定N端的试剂。 (3)与亚硝酸反应 R-CH-COOH+HNO2 R-CH-COOH N2t+H2o NH2 OH
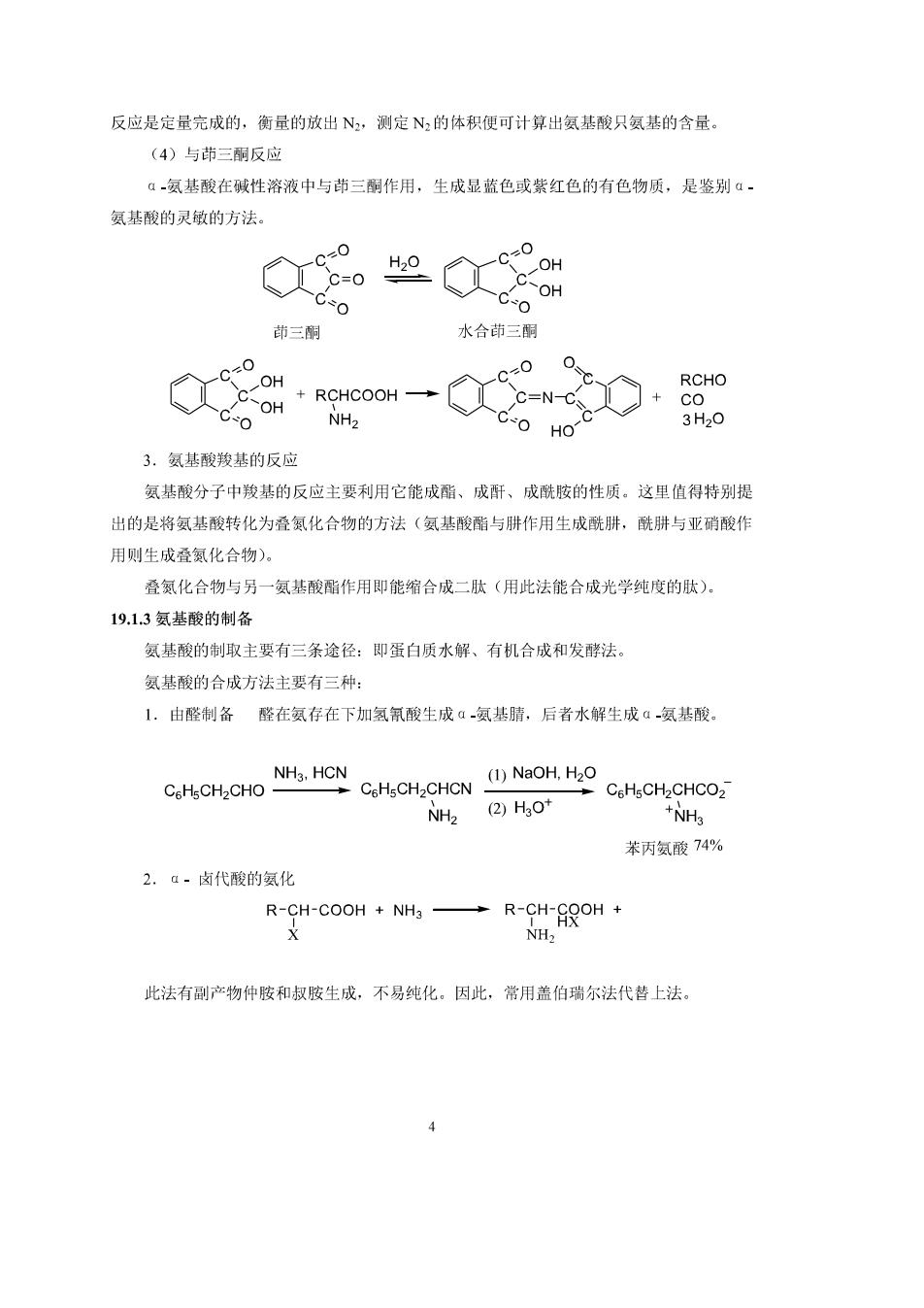
反应是定量完成的,衡量的放出N,测定N的体积便可计算出氨基酸只氨基的含量。 (4)与茚三酮反应 á一氨基酸在碱性溶液中与茚三酮作用,生成显蓝色或紫红色的有色物质,是鉴别α 氨基酸的灵敏的方法 c=0 OH OH 茚三削 水合茚三酮 00 OH RCHO COHROHCOOH-二c0h0% NH2 3H20 3.氨基酸羧基的反应 氨基酸分子中羧基的反应主要利用它能成酯、成酐、成酰胺的性质。这里值得特别提 出的是将氨基酸转化为叠氮化合物的方法(氨基酸酯与肼作用生成酰肼,酰肼与亚硝酸作 用则生成叠氮化合物). 叠氮化合物与另一氨基酸酯作用即能缩合成二肽(用此法能合成光学纯度的肽) 19.13氨基酸的制备 氨基酸的制取主要有三条途径:即蛋白质水解、有机合成和发酵法。 氨基酸的合成方法主要有三种: L.由醛制各醛在氨存在下加氢氯酸生成a氨基睛,后者水解生成氨基酸。 CCHCHO N.HCN CoHsCHaCHCN (1)NaoH,H2o CeHsCH2CHCO2 NH2 (②H0+ +NH3 苯丙氨酸74% 2.a-卤代酸的氨化 R-9rco1+一R-股o1+ 此法有副产物仲胺和叔胺生成,不易纯化。因此,常用盖伯瑞尔法代替上法。 4
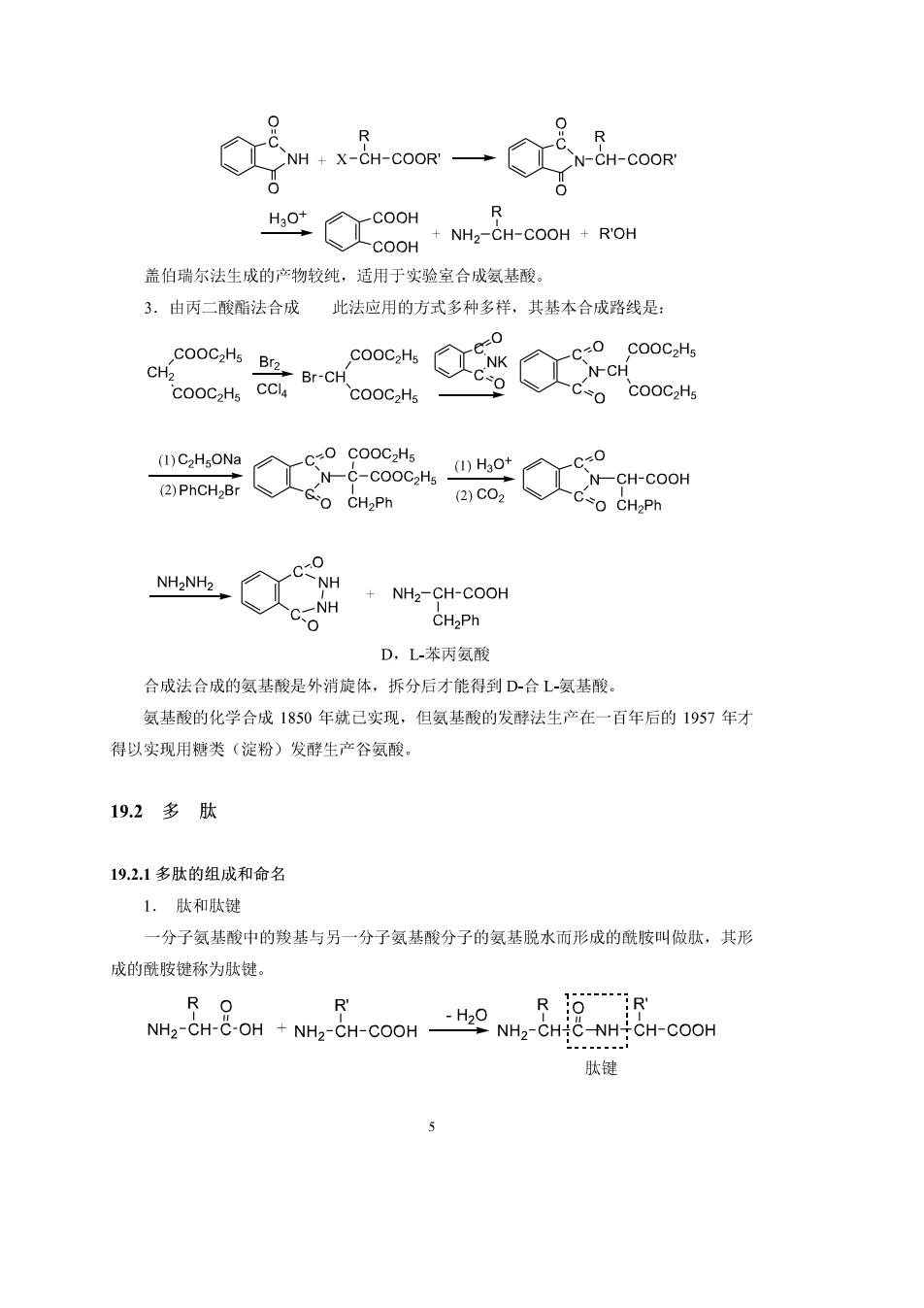
R NH+x-H-cooR一 Q R CN-CH-COOR COOOM 盖伯瑞尔法生成的产物较纯,适用于实验室合成氨基酸。 3.由丙二酸酯法合成 此法应用的方式多种多样,其基本合成路线是 COOCzHs Br2 0 COOC2H Br-CH cooc N-CH COOC2Hs CO COOC2Hs N-COOCH (1)Ho 0 (2)PhCH,Br NCH-COOH GO CH2Ph (2)C02 CO CH2Ph NH2NH2 c-o NH2-CH-COOH CH2Ph D,L苯丙氨酸 合成法合成的氨基酸是外消旋体,拆分后才能得到D-合L氨基酸。 氨基酸的化学合成1850年就己实现,但氨基酸的发酵法生产在一百年后的1957年才 得以实现用糖类(淀粉)发酵生产谷氨酸 19.2多肽 19.2.1多肽的组成和命名 1.肽和肽键 一分子氨基酸中的羧基与另一分子氨基酸分子的氨基脱水而形成的酰胺叫做肽,共形 成的酰胺键称为肽键。 NH2CH-COH-NH2-CH-COOH NH-CHIC-NHTCH-COOH 肽键

由n个α-氨基酸缩合而成的肽称为n肽,由多个4-氨基酸缩合而成的肽称为多肽。 一般把含100个以上氨基酸的多肽(有时是含50个以上)称为蛋白质。 无论肽脸有多长,在链的两端一端有游离的氨基(-NH,),称为N端:链的另一端有游 离的羧基(-COOH),称为C端。 R OL R01 R" NH2:CH-C-NH-CH-C- NH-CHCOOH N端 C端 2.肽的命名 根据组成肽的氨基酸的顺序称为某氨酰某氨酰…某氨酸(简写为某、某、某)。 CH2OH CH2CsHs NH2-CH-C-NH-CH-C-NH-CH-COOH 丙氨酰丝氨酰苯丙氨酸(丙丝~苯丙) 很多多肽都采用俗名,如催产素、胰岛素等。 19.22多肽结构的测定 由氨基酸组成的多肽数目惊人,情况十分复杂。假定100个氨基酸聚合成线形分子, 可能具有2010中多肽, 多肽结构的测定主要是做如下工作: ①了解某一多肽是由哪些氨基酸组成的。 ②各种氨基酸的相对比例, ③确定各氨基酸的挂列顺序。 多肽结构测定工作步骤如下: 1.测定分子量 2.氨基酸的定量分析 多秋号复装酸尽注是各种氢酸一各种氨猴的含民 HCI 现代方法是将水解后的氨基酸混和液用氨基酸分析仪进行分离和测定。· 3.端基分析(测定N端和C端) (1)测定N端(有两种方法) a2,4=硝基氟苯法一—桑格尔(Sanger-英国人)法 2,4=硝基氟苯与氨基酸的N端氨基反应后,再水解,分离除N二硝基苯基氨基酸
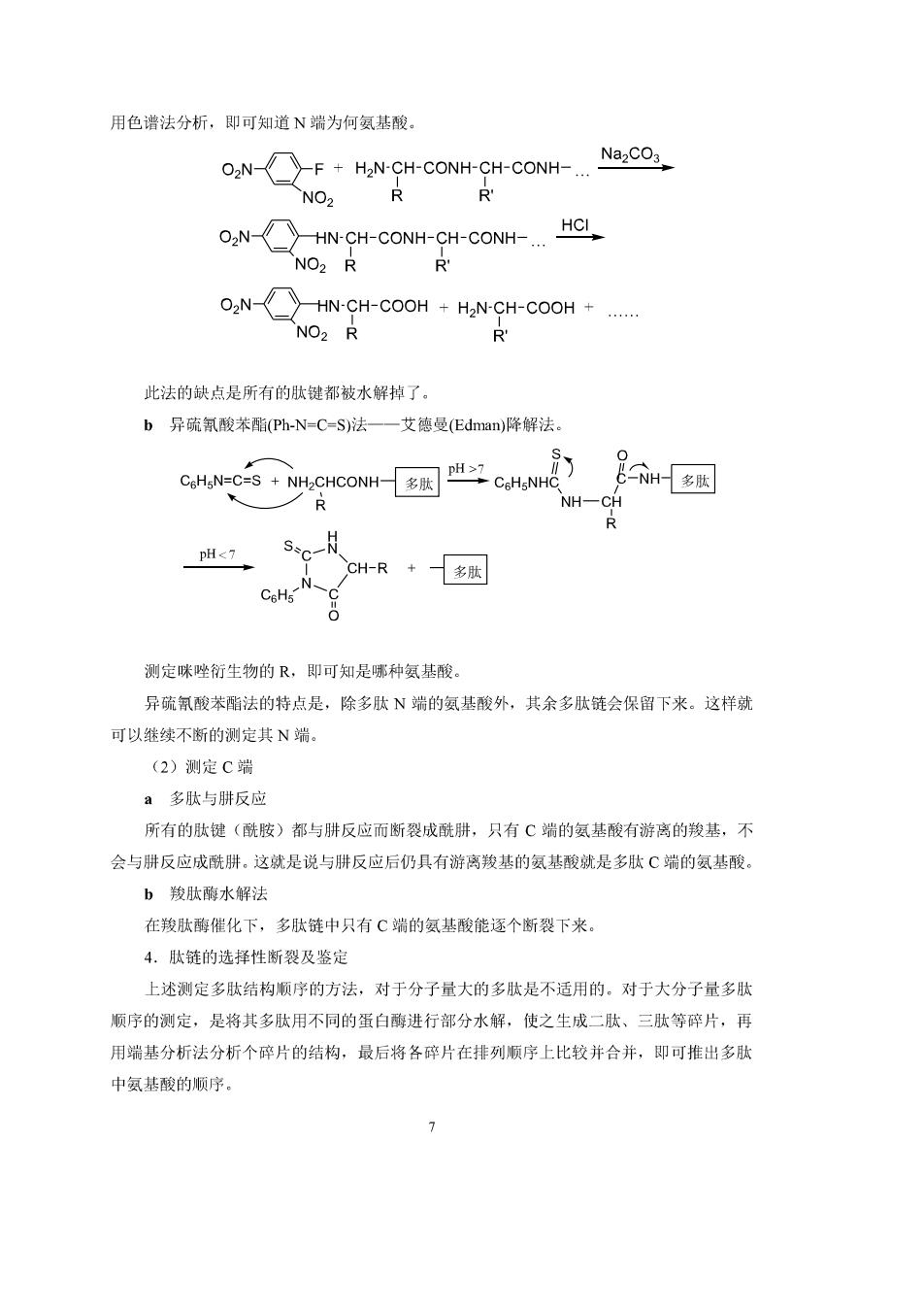
用色谱法分析,即可知道N端为何氨基酸。 ON-F+HaN-CH-CONH-CH-CONH-NazCO3 NO2 R NHN-CH-CONH-CH-CONH-.HCL NO2 R R NHN-CH-COOH+HaN-CH-COOH NO>R R 此法的缺点是所有的肽键都被水解掉了。 b异疏氰酸苯酯(Ph-N=C=S)法一一艾德曼(Edman)降解法. C-CHCOC 多肉 NH-CH R S* -N CH-R+多肤 测定咪唑衍生物的R,即可知是哪种氨基酸。 异疏氯酸苯酯法的特点是,除多肽N端的氨基酸外,其余多肽链会保留下来。这样就 可以继续不断的测定其N端 (2)测定C端 a多肽与肼反应 所有的肽键(酰胺)都与肼反应而断裂成酰肼,只有C端的氨基酸有游离的羧基,不 会与肼反应成酰肼。这就是说与肼反应后仍具有游离羧基的氨基酸就是多肽C端的氨基酸 b羧肽酶水解法 在羧肽酶催化下,多肽链中只有C端的氨基酸能逐个断裂下来。 4.肽链的选择性断裂及鉴定 上述测定多肽结构顺序的方法,对于分子量大的多肽是不适用的。对于大分子量多肽 顺序的测定,是将其多肽用不同的蛋白酶进行部分水解,使之生成二肽、三肽等碎片,再 用端基分析法分析个碎片的结构,最后将各碎片在排列顺序上比较并合并,即可推出多肽 中氨基酸的顺序 7

部分水解法常用的蛋白酶有: 胰蛋白酶一只水解羰基属于赖氨酸、精氨酸的肽锭。 糜蛋白酶一水解羧基属于苯丙氨酸、酪氨酸、色氨酸的肽键。 溴化氯 一只能断裂羰基属于蛋氨酸的肽键。 例1:催产素的(一个八肽)结构分析。P2-@。 例2:某八肽 完全水解后,经分析氨基酸的组成为:丙、亮、赖、苯丙、脯、丝、酪、缬。 端基分析:N-端丙… …亮C端。 胰蛋白酶催化水解:分离得到酪氨酸,一种三肽和一种四肽。 用Edan降解分别测定三肽、四肽的顺序,结果为:丙-脯米丙:赖-丝橛-亮。 由上述信息得知,八肽的顺序为: 丙前一苯两了酪趋一丝领二突 三肽糜蛋白酶四肽 19.23多肽的合成 要使各种氨基酸按一定的顺序连接起来形成多肽是一向十分复杂的化学工程,需要解 决许多难题,最主要的是要解决四大问题 L.保护NH或-COOH 氨基酸是多官能团化合物,在按要求形成肽键时,必须将两个官能团中的一个保护起 来,留下一个去进行指定的反应,才能达到合成的目的。 对保护基的要求是:易引入,之后又易除去。 我们把保护NH称为代帽子,保护羧基称为穿靴子, 2.活化反应基团(活化-NH2或-C00H) 通常是保护NH及-OH、-SH等,活化-C0OH(具体方法-略) 3.生物活性 合成多肽必须保证氨基酸的排列顺序与天然多肽相同,并与天然多肽不论在物理、化 学性质和生物活力各方面都一样,才具有意义。 陕岛素是一种激素,可用于治疗糖尿病,但只能用和人体结构相近的胰岛素,如猪胰 岛素,其它的则不起疗效.我国1965年6月发表合成成功牛胰岛素的文章,生物活性1.2~70% 19.3蛋白质 8

19.31蛋白质的分类 分子量在1000以上,构型复杂的多肽称为蛋白质。 1.根据蛋白质的形状分为: (1)纤维蛋白质 如丝蛋白、角蛋白等: (2)球状蛋白质 如蛋清蛋白、酪蛋白、血红蛋白、Y-球代表蛋白(感骨抗体)等。 2.根据组成分: (1)单纯蛋白质 一其水解最终产物是氨基酸。 (2)结合蛋白质一á氨基酸+非蛋白质(辅基) 辅基为糖时称为糖蛋白:辅基为核酸时称为核蛋白:辅基为血红素时称为血红素蛋白 3.蛋白质的功能分: (1)活性蛋白按生理作用不同又可分为:酶、激素、抗体、收缩蛋白、运输蛋白 等。 (2)非活性蛋白担任生物的保护或支持作用的蛋白,但本身不具有生物活性的物质。 例如:贮存蛋白(清蛋白、酪蛋白等),结构蛋白(角蛋白、弹性蛋白胶原等)等等。 19.3,2蛋白质的结构 各种蛋白质的特定结构,决定了各种蛋白质的特定生理功能。蛋白质种类繁多,结构 极其复杂。通过长期研究确定,蛋白质的结构可分为一级结构、二级结构、三级结构和四 级结构。 1.蛋白质的一级结构 由各氨基酸按一定的排列顺序结合而形成的多肽链(50个以上氨基酸)称为蛋白质的 级结构。 对某一蛋白质,若结构顺序发生改变,则可引起疾病或死亡。例如,血红蛋白是由两 条ā-肽链(各为141肽)和两条B-肽链(各为146肽)四条肽链(共574肽)组成的。 在B链,N6为谷氨酸,若换为缬氨酸,则造成红血球附聚,即由球状变成簸刀状,若 得了这种病(镰刀形贫血症)不到十年就会死亡。 2.蛋白质的二级结构 多肽链中互相靠近的氨基酸通过氢键的作用而形成的多肽在空间挂列(构象)称为蛋 白质的二级结构。 蛋白质的二级结构主要有三种形式:
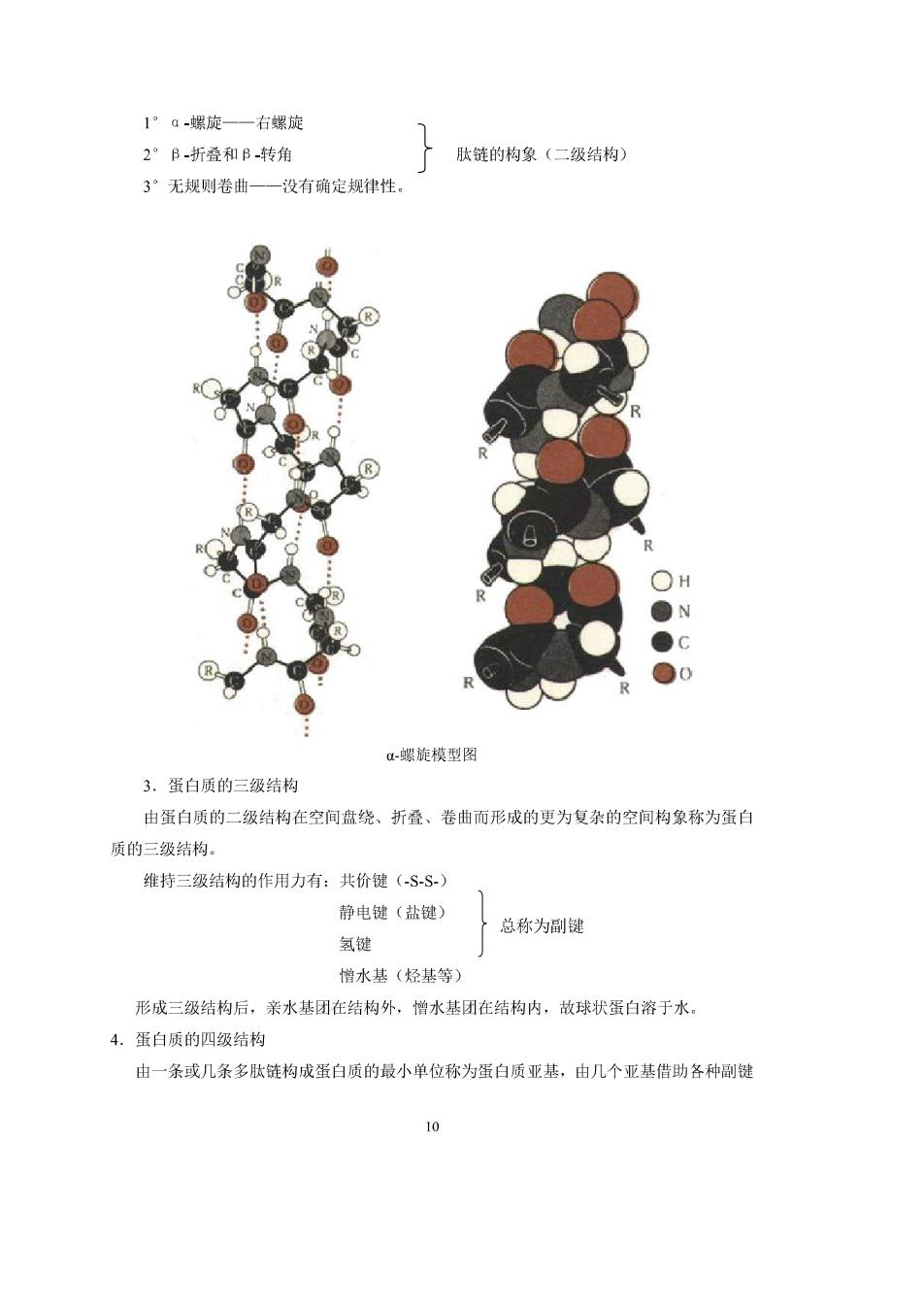
1°a-螺旋一一右螺旋 2”B-折叠和B-转角 广肽链的构象(二级结构) 3”无规则卷曲一一没有确定规律性。 。蝶旋模型图 3.蛋白质的三级结构 由蛋白质的二级结构在空间盘绕、折叠、卷曲而形成的更为复杂的空间构象称为蛋白 质的三级结构。 维持三级结构的作用力有:共价键(SS) 静电键(盐键) 总称为副健 氢键 憎水基(烃基等) 形成三级结构后,亲水基团在结构外,憎水基团在结构内,故球状蛋白溶于水。 4.蛋白质的四级结构 由一条或几条多肽链构成蛋白质的最小单位称为蛋白质亚基,由几个亚基借助各种副键 10