
第六章单环芳烃 一,学习目的和要求: 1.掌握苯分子的结构,杂化轨道理论和分子轨道理论的定性解释 2.掌握单环芳烃的同分异构和命名法 3,掌握单环芳烃的化学反应,包括亲电取代反应,加成反应及芳烃侧链反应。 4.学握苯环取代定位规则、给电子基团、吸电子基团及其理论解释和应用。 5。理解亲电取代反应的可逆性和不可逆性 6.理解共振论的要点,会写共振式,区别Lewis式与共振式。 7.了解单环芳烃的来源、制法及物理性质。 二。本章节重点、难点: 苯分子的结构,共振论,苯的化学性质及应用,亲电取代反应历程,定位规则 引言: 芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物, 芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。 现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含 有苯环结构。 芳香烃具有其特征性质一一芳香性(易取代,难加成,难氧化). 芳烃按其结构可分类如下: 单O了e8e0r-a 紫乙 异内苯 苯乙婚 ”苯系芳烃 「联苯○⊙O-OO 联苯 对三联苯 多环芳烃了 C多代那烃c
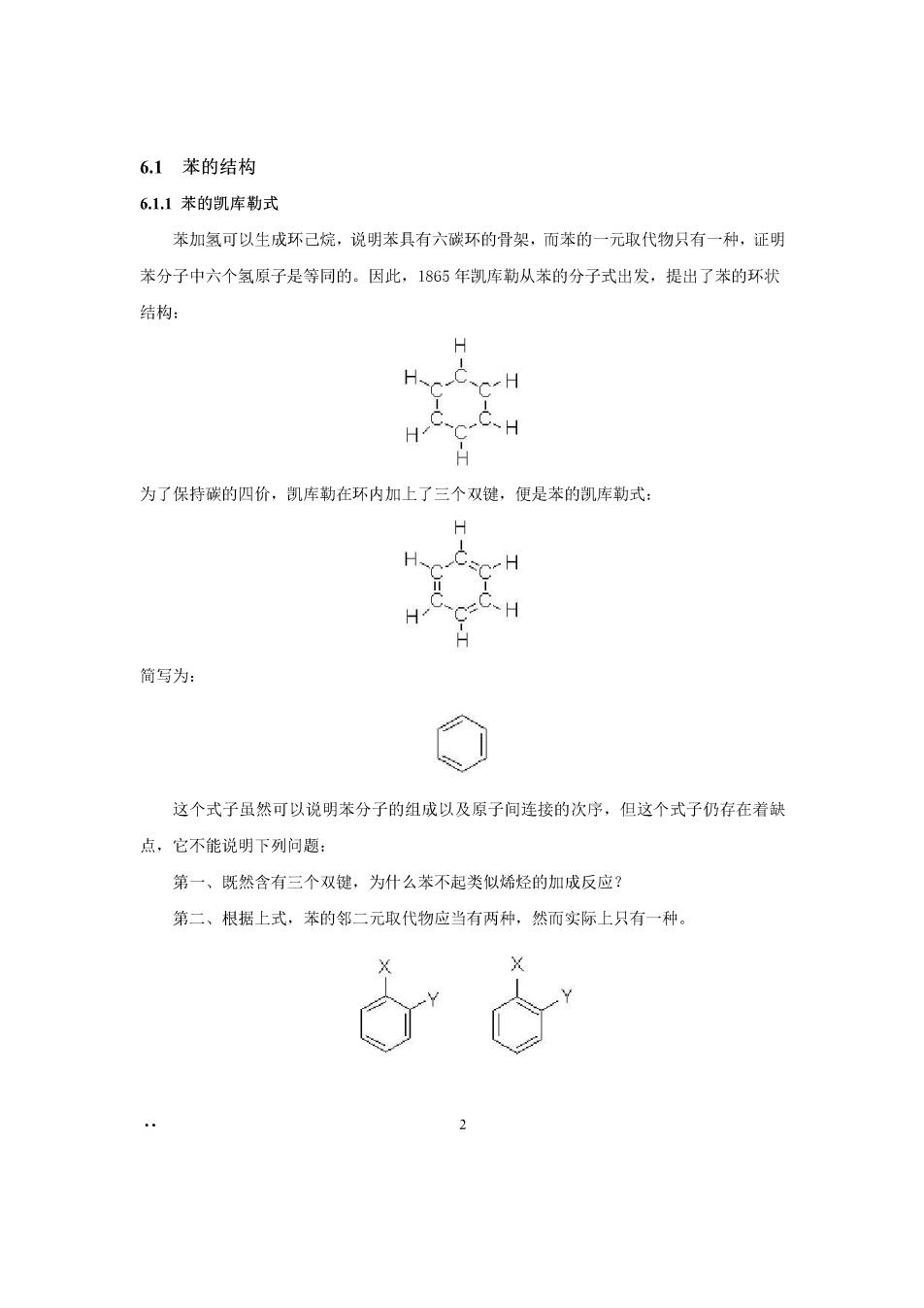
6.1苯的结构 6.1.1苯的凯库勒式 苯加氢可以生成环己烷,说明苯具有六碳环的骨架,而苯的一元取代物只有一种,证明 苯分子中六个氢原子是等同的。因此,1865年凯库勒从苯的分子式出发,提出了苯的环状 结构: H、 HC 为了保持碳的四价,凯库勒在环内加上了三个双键,便是苯的凯库勒式: H HCsC-H 简写为: 这个式子虽然可以说明苯分子的组成以及原子间连接的次序,但这个式子仍存在着缺 点,它不能说明下列问题: 第一、既然含有三个双键,为什么苯不起类似烯烃的加成反应 第二、根据上式,苯的邻二元取代物应当有两种,然而实际上只有一种
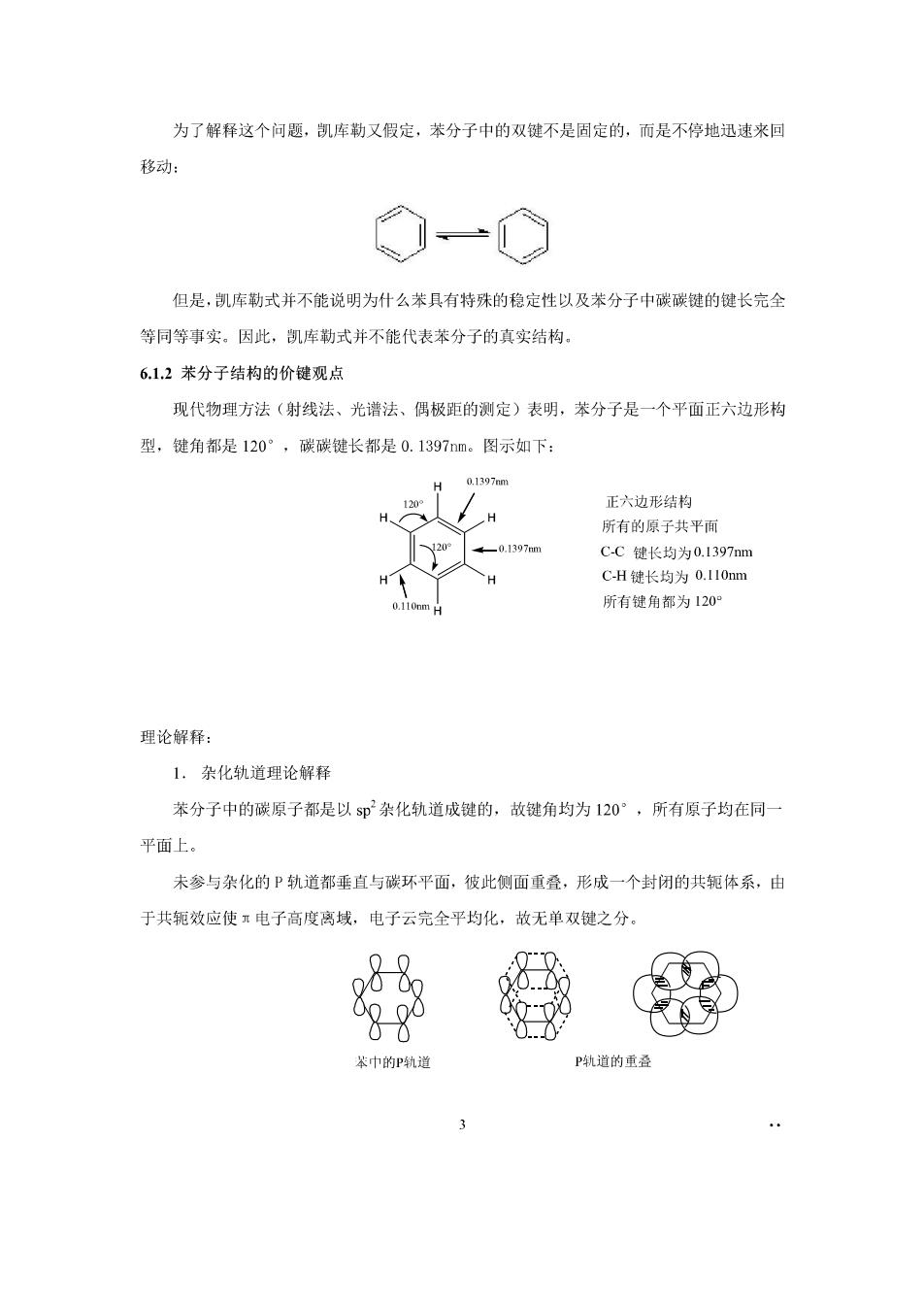
为了解释这个问题,凯库勒又假定,苯分子中的双健不是固定的,而是不停地迅速来回 移动: ◇-© 但是,凯库勒式并不能说明为什么苯具有特殊的稳定性以及苯分子中碳碳键的键长完全 等同等事实。因此,凯库勒式并不能代表苯分子的真实结构, 6.1.2苯分子结构的价键观点 现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是一个平面正六边形构 型,键角都是120°,碳碳键长都是0.1397m。图示如下: 1397mm 正六边形结构 所有的原子共平面 CC健长均为0.1397mm CH键长均为0.II0nm 所有键角都为120加 理论解释 1.杂化轨道理论解释 苯分子中的碳原子都是以5即杂化轨道成键的,故键角均为120°,所有原子均在同一 平面上。 未参与杂化的P轨道都垂直与碳环平面,彼此侧面重叠,形成一个封闭的共辄体系,由 于共轭效应使π电子高度离域,电子云完全平均化,故无单双键之分 r-0 Q0( 0000 萃巾的P乳道 P道的重
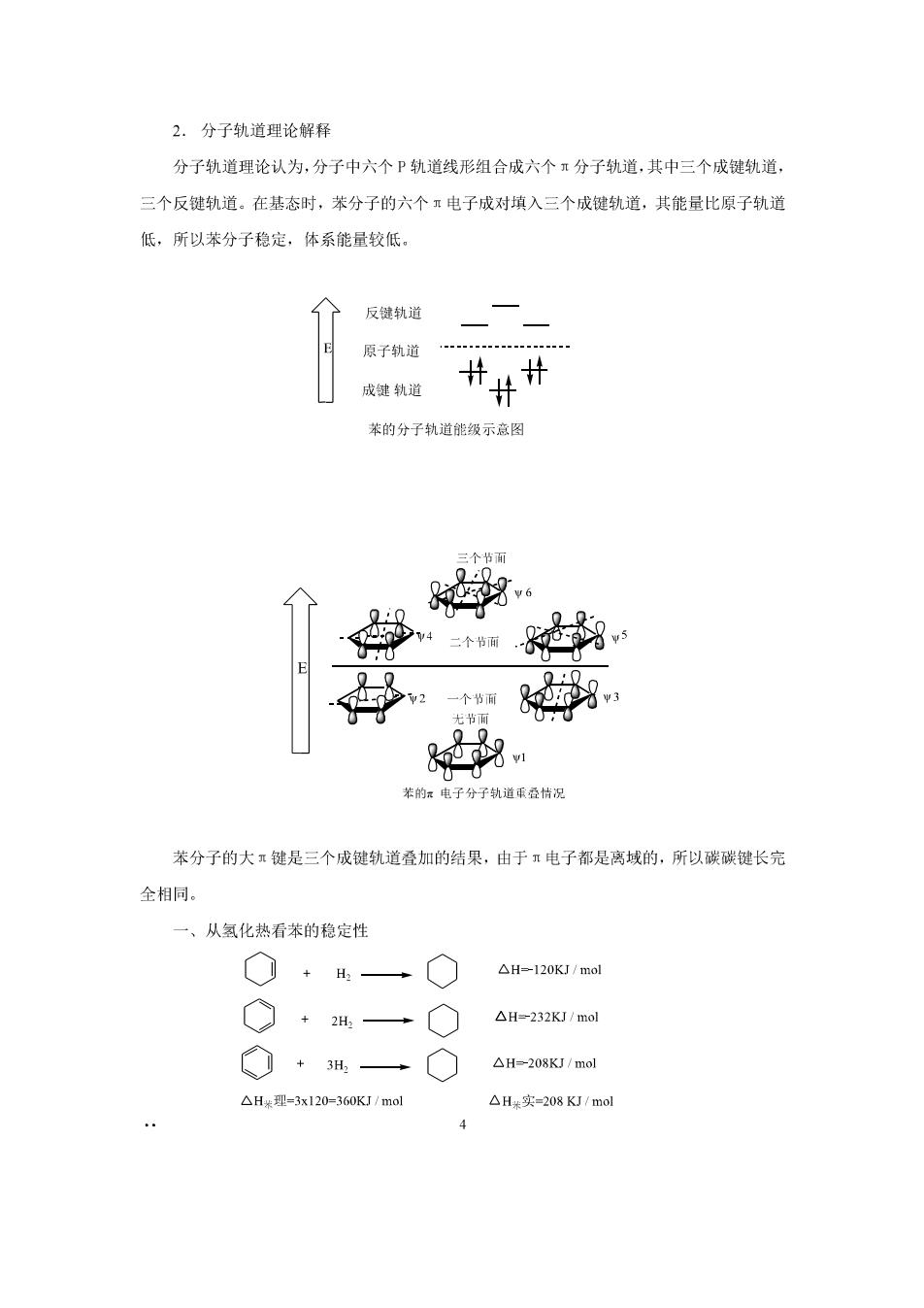
2.分子轨道理论解释 分子轨道理论认为,分子中六个P轨道线形组合成六个π分子轨道,其中三个成键轨道, 三个反键轨道。在基态时,苯分子的六个:电子成对填入三个成键轨道,其能量比原子轨道 低,所以苯分子稳定,体系能量较低 反键轨道 原子轨道 成键轨道 苯的分子轨道能级示意图 和 装的x电子分子轨道叠情况 苯分子的大键是三个成键轨道叠加的结果,由于算电子都是离域的,所以碳碳键长完 全相同。 一、从氢化热看苯的稳定性 △H-120KJ/mol ◇+一 △H-232KJ/ml ◇+一◇ △H-208KJ/mol △H米理=3x120=360KJ/mol △H*实=-208KJ/mol
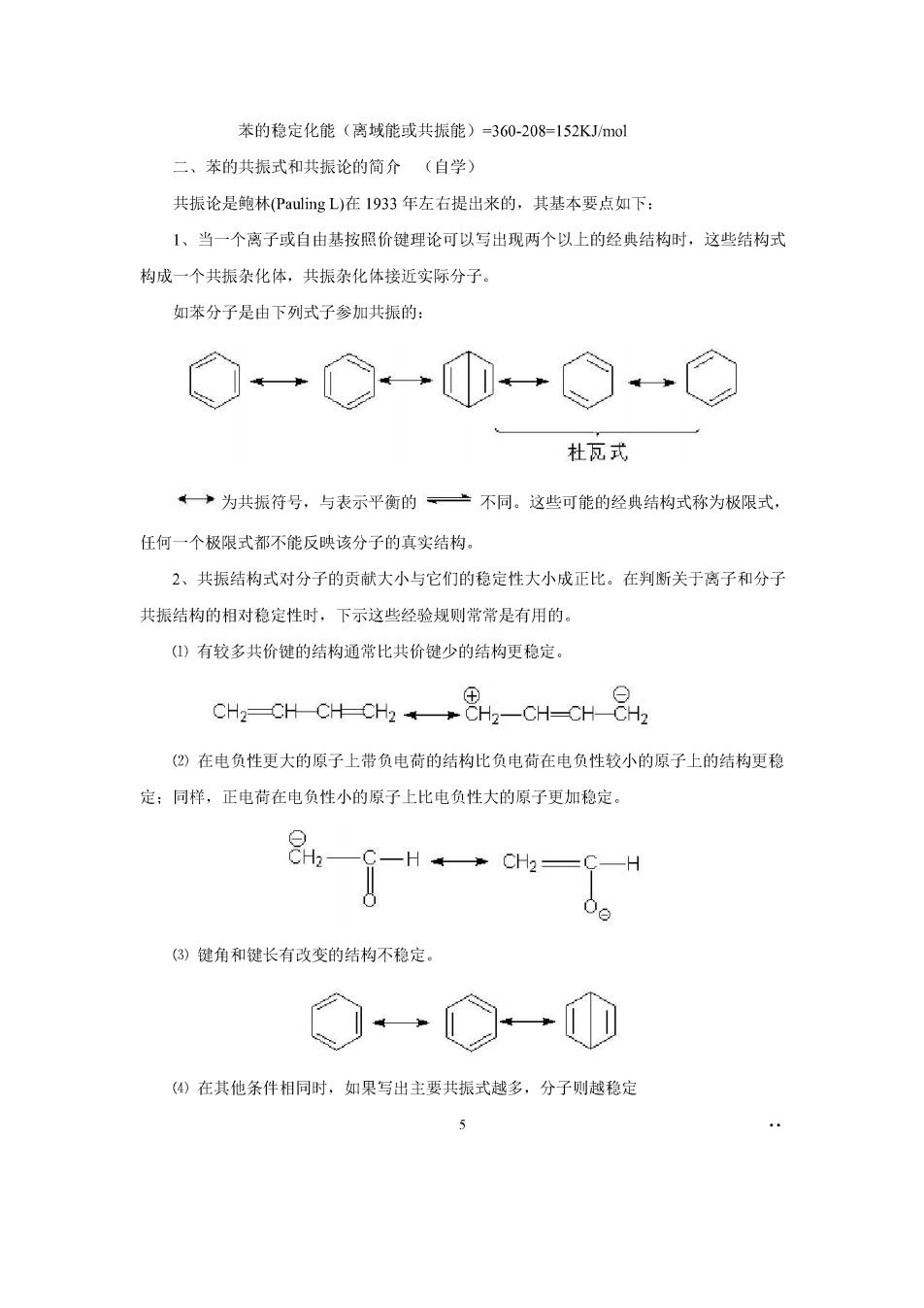
苯的稳定化能(离域能或共振能)=360-208=152 KJ/mol 二、苯的共振式和共振论的简介(自学) 共振论是鲍林Pauling L)在1933年左右提出来的,其基本要点如下: 1、当一个离子或自由基按照价键理论可以写出现两个以上的经典结构时,这些结构式 构成一个共振杂化体,共振杂化体接近实际分子。 如苯分子是由下列式子参加共振的: Q心→①◇C 杜瓦式 ←一→为共振符号,与表示平衡的一一不同。这些可能的经典结构式称为极限式。 任何一个极限式都不能反映该分子的真实结构。 2、共振结构式对分子的贡献大小与它们的稳定性大小成正比。在判断关于离子和分子 共振结构的相对稳定性时,下示这些经验规则常常是有用的 ()有较多共价键的结构通常比共价键少的结构更稳定。 CH2-CHC+-Ch2¥→82-CH-OH82 (②)在电负性更大的原子上带负电荷的结构比负电荷在电负性较小的原子上的结构更稳 定:同样,正电荷在电负性小的原子上比电负性大的原子更加稳定。 -H→Hh=H (3)键角和键长有改变的结构不稳定。 (④)在其他条件相同时,如果写出主要共振式越多,分子则越稳定 5

3、书写极限式应注意的规则 ()必须遵守价键理论,氢原子的外层电子数不能超过2个。第二周期元素最外层电子 数不能超过8个,碳为4价 (②)原子核的相对位置不能改变,只允许电子排布上有所差别。 c,=01-8-8-C1-042 但不能写成环状结构: 这样改变了碳架,不符合要求。 Ch一C一CH大CHh-C-CH(核位置移动T) OH 3)在所有极限式中,未共用电子数必须相等。 Ct=CH-dh。→ch-c=cH火6-dH-d2 一个未共用电子 一个未共用电 不存金共养三个未共用电子 6.2单环芳烃的异构和命名 6.2.1异构现象 ◇a 2.二烃基苯有三种位置异构
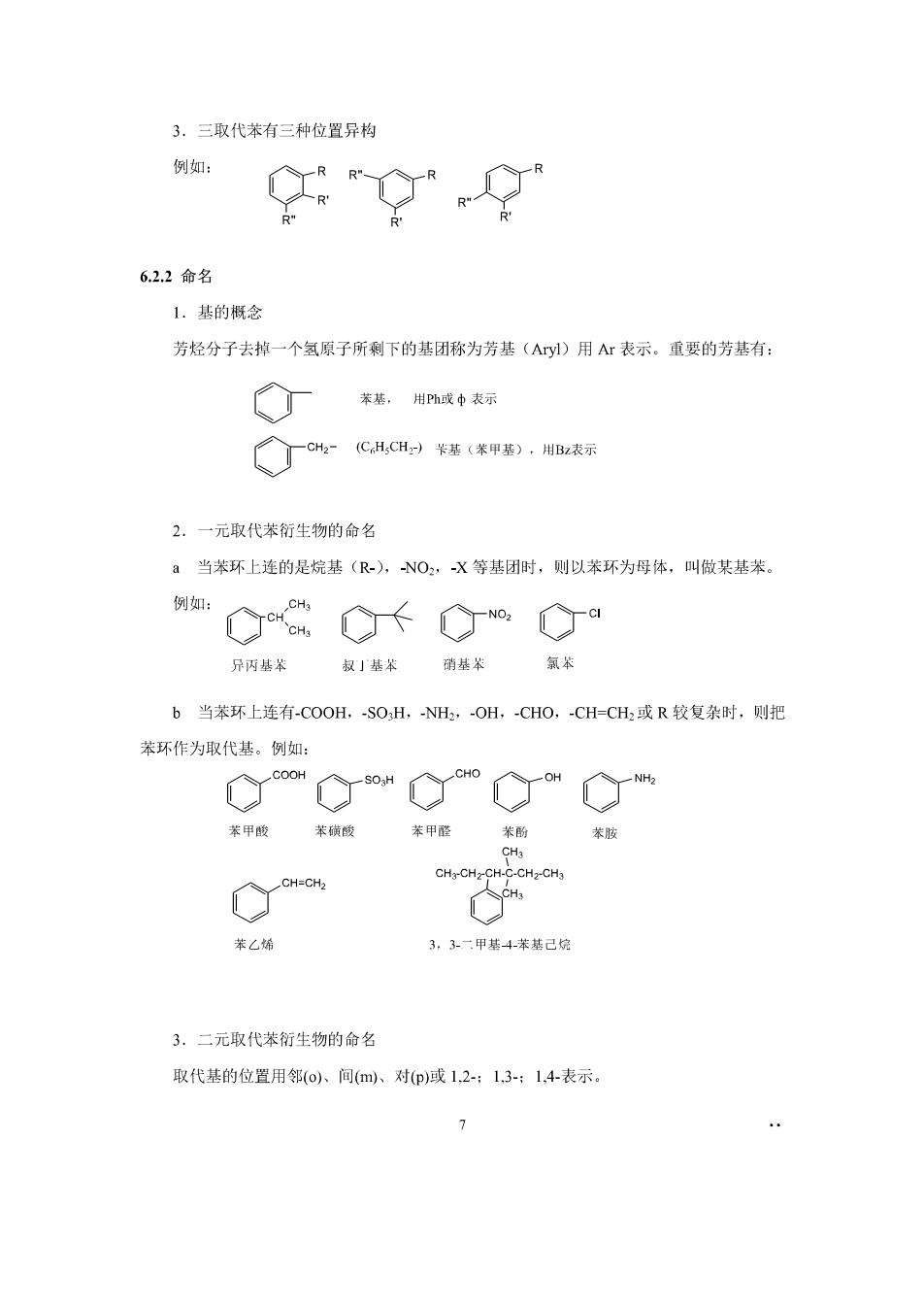
3.三取代苯有三种位置异构 例如: 6.22命名 1.基的概念 芳烃分子去掉一个氢原子所剩下的基团称为芳基(Ay)用Ar表示。重要的芳基有: 苯基,用Ph或中表示 2.一元取代苯衍生物的命名 a当苯环上连的是烷基(R-),NO,X等基闭时,则以苯环为母体,叫做某基苯。 例如: C0 C· 丙基苯叔」基苯硝基 氛苯 b当苯环上连有-COOH,-SOH,NH2,-OH,-CHO,-CHCH2或R较复杂时,则把 苯环作为取代基。例如: 苯甲酸苯横酸 苯甲苯酚 oia CH-CH-CH-C-CHz-CH 苯乙烯 3,3二甲基4苯基己烷 3.二元取代苯衍生物的命名 取代基的位置用邻(o小、间(m、对p)减1,2-:1,3-:14表示。 7

例如: 二甲装 对一甲 12 苯)42.甲装) 邻甲基册 m一甲苯) 一甲苯) 4.多取代苯衍生物的命名 a取代基的位置用邻(o以、间(m、对(p)或23,4,…表示 b母体选择原则(按以下排列次序,排在后面的为母体,排在前面的作为取代基。) 选择母体的顺序如下: NO2、X、-OR(烷氧基)、R(烷基)、NH,-OH、-COR、-CHO、-CN、-CONH (酰胺),-COX(酰卤)、-COOR(酯)、-SO,H、-COOH、-NR等 例如: 5 对氧来对气差浆候政风简基米甲酸装龄整2贺领营 6.3单环芳烃的来源 1.煤的干馏 2.石油的芳构化 6.4单环芳烃的物理性质 一般为无色有芳香味的液体,不溶于水,相对密度在0.86-0.93,是良好的溶剂,有一 定的毒性 6.5单环芳烃的化学性质 芳烃的化学性质主要是芳香性,即易进行取代反应,而难进行加成和氧化反应。 6.5.1亲电取代反应 1.硝化反应 o,no 55-60℃ 角基木(986)波装命离体在用能与
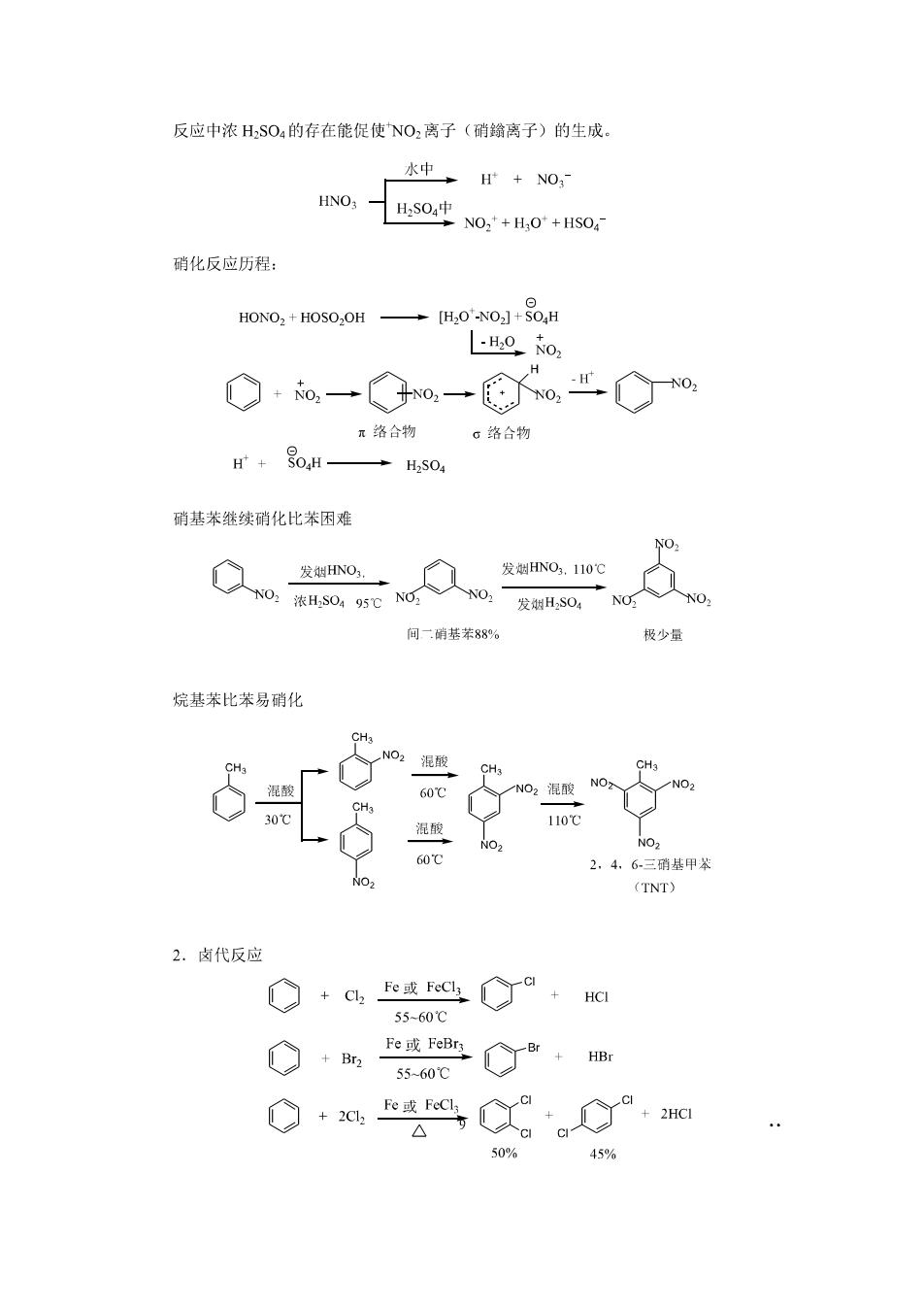
反应中浓HSO4的存在能促使NO,离子(硝离子)的生成 水中+NO, 0,5sSo中N0s+H0+Hs0 硝化反应历程: HONO2+HOSO,OH →H,00+品,H -H0o, ◇·o一◇o一⑥Xo世o r络合物。络合物 H+S0,H→HS04 硝基苯继续硝化比苯困难 发HNO so: 发幽O.110℃ 发H,SO,C NO 间二硝基苯88% 极少量 烷基苯比苯易硝化 24,6三硝基甲 (TNT) 2.卤代反应 G+ae或egCa,Ha 55-60℃ O+他m 55-60℃ △ 50% 45%

反应历程: 040⊙r0m 元路合物 0络合物 烷基苯的卤代 6.04 本氧年是 反应条件不同,产物也不同。因两者反应历程不同,光照卤代为自由基历程,而前者为 离子型取代反应。 侧链较长的芳烃光照卤代主要发生在:碳原子上。 oo类C名+g 91% g0% Coo取C8c 1009。 cot8e本丁6ro"8e 3.磺化反应 +浓s0,Cs0r0 02g