
第十四章B-二羰基化合物 学习目的及基本要求: L.掌握雷的水解和克莱森(Claisen)酯缩合历程 2.拳握乙酰乙酸乙酯和丙二酸二酯在合成上的应用 3.理解互变异构. 4.理解合成路线设计的基本知识。 5.了解麦克尔加成的溜义和应用。 重点:酯的水解和克莱森(C1 aisen)酯缩合历程,乙酰乙酸乙酯和丙二酸二酯在合成上的 应用。 难点:互变异构,碳负离子和a,B-不饱和羰基化合物的共轭加成一麦克尔反应。 教学方法采用多媒体课件、模型和板书相结合的课讲授方法。 §14.1B-二羰基化合物的酸性和烯醇负离子的稳定性 分子中含有两个赖基官能团的化合物,统称为二羧基化合物;其中两个鬏基为一个亚甲基相 间隔的化合物,叫做B-二羰基化合物 14.1.1B-二羰基化合物的酸性 由于B一二羰基化合物中的亚甲基同时受到两个羰基的影响,使这个碳上的▣氢原子显得特 别活跃,具有较强的酸性。该类化合物的pk,在9~13之间,远比醇和水的酸性强。因而。 B-二羰基化合物具有自己独特的反应。其他含活泼亚甲基化合物的互变异构体中烯醇式的 含量见Pm表1十1. 14.1.2烯醇负离子的稳定性 乙酰乙酸乙酯:又叫B丁酮酸乙酯,简称三乙,是啊式和烯醇式互变异构的一个最著名的 例子。 (1)性质:在室温下为无色液体,无色有水果香味的液体:沸点180.4C:微溶于水 易溶于乙醚、乙醇等有机溶剂。以酮式和烯醇式两种结构以动态平衡而同时存在的互变异构 体。 1.互变异构现多
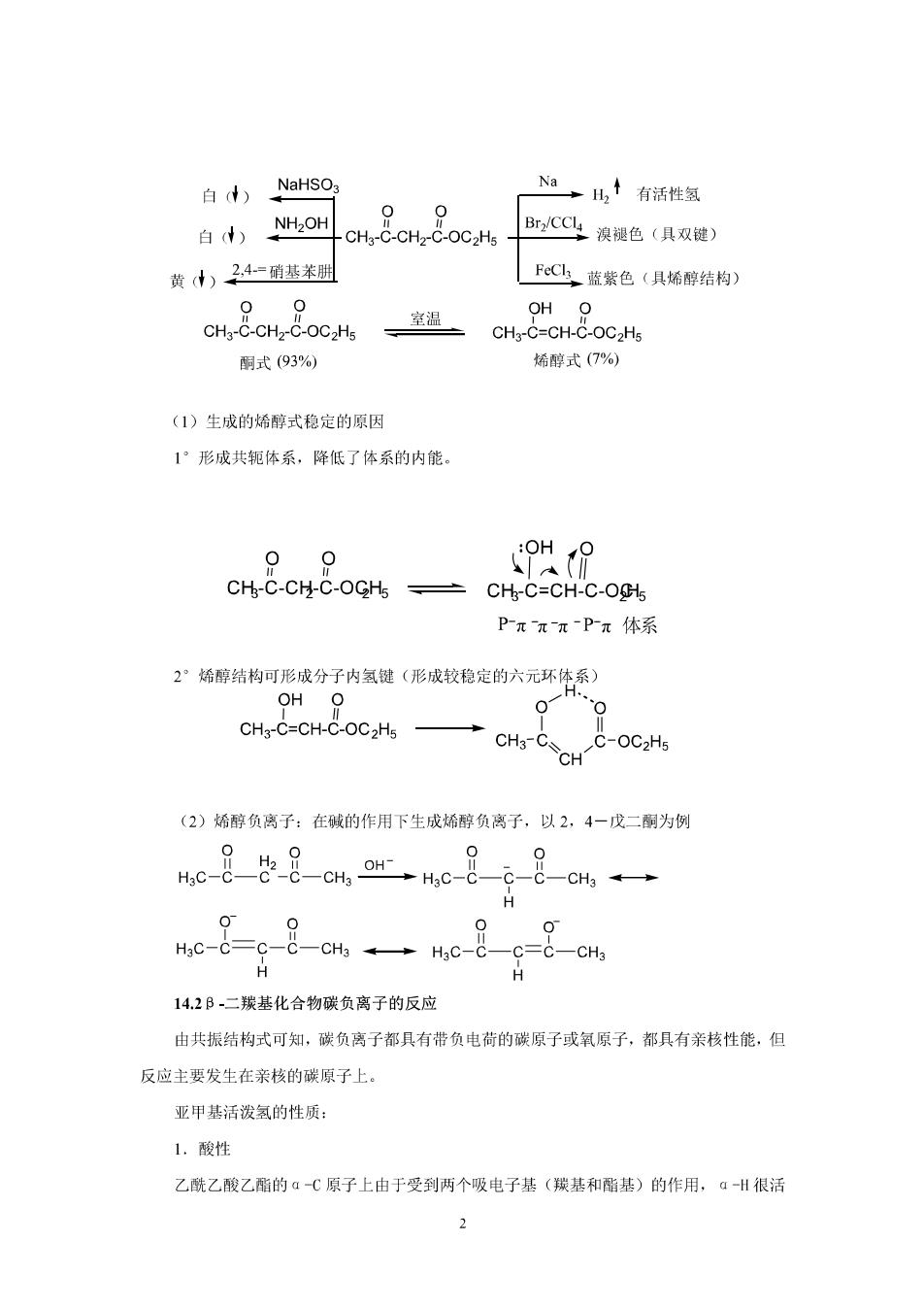
白)NaHSO 00 有活性氢 白W)NHOH -CH-C-CHz-C-OC2Hs Br,CC溴褪色(具双健) 黄小24硝基苯册 FcC蓝紫色(具烯醇结构) cHn8o8oe 室温 OH O CHg-C=CH-C-OC2Hs 酮式(93%) 烯醇式(7%) (1)生成的烯醇式稳定的原因 1°形成共轭体系,降低了体系的内能。 00 CH-C-CH-C-OGH5 CH-C=CH-C-O Pπ元πPπ体系 2°烯醇结构可形成分子内氢键(形成较稳定的六元环体系) OH O 0 CHgC=CH-COC2H5→ CH3-CSCH .C-OC2Hs (2)烯醇负离子:在碳的作用下生成烯醇负离子,以2,4一戊二酮为例 nc 88 cn Onc88c 00 H -C-CH3 H 142B.二我基化合物碳负离子的反应 由共振结构式可知,碳负离子都具有带负电荷的碳原子或氧原子,都具有亲核性能,但 反应主要发生在亲核的碳原子上。 亚甲基活泼氧的性质: 1.酸性 乙酰乙酸乙的aC原子上由于受到两个吸电子基(羰基和留基)的作用,ā-H很活

泼,具有一定的酸性,易与金属钠、乙醇钠作用形成钠盐。 ct-8ct8-oec%hoe4&at8ocnldk-n 2.钠盐的烷基化和酰基化 乙酰乙酸乙酯的钠盐与卤代烃、酰卤反应,生成烃基和酰基取代的乙酰乙酸乙。 (a)烷基化: [CH-CH-Cx CHC-CHC-OCH R c8g8oe%ocu,8g8 R R COCaHs Nat RX-CH2-6-6-6-OC2Hs 注:①R最好用1°,2”产量低,不能用3”和乙烯式卤代烃。 ②二次引入时,第二次引入的R'要比R活泼. ③RX也可是卤代酸酯和卤代酮 %86H8ocNc88doc" 00 COR 3.酮式分解和酸式分解 ()酮式分解乙酰乙酸乙酯及其取代衍生物与稀碱作用,水解生成B-羰基酸,受 热后脱羧生成甲基酮。故称为酮式分解。 例如 CHH CHCHCMOHCO 0 CH-CHC-OC OH CH C-CHR CaHOH+COz COR ()酸式分解乙酰乙酸乙酯及其取代衍生物在浓碱作用下,主要发生乙酰基的断 3
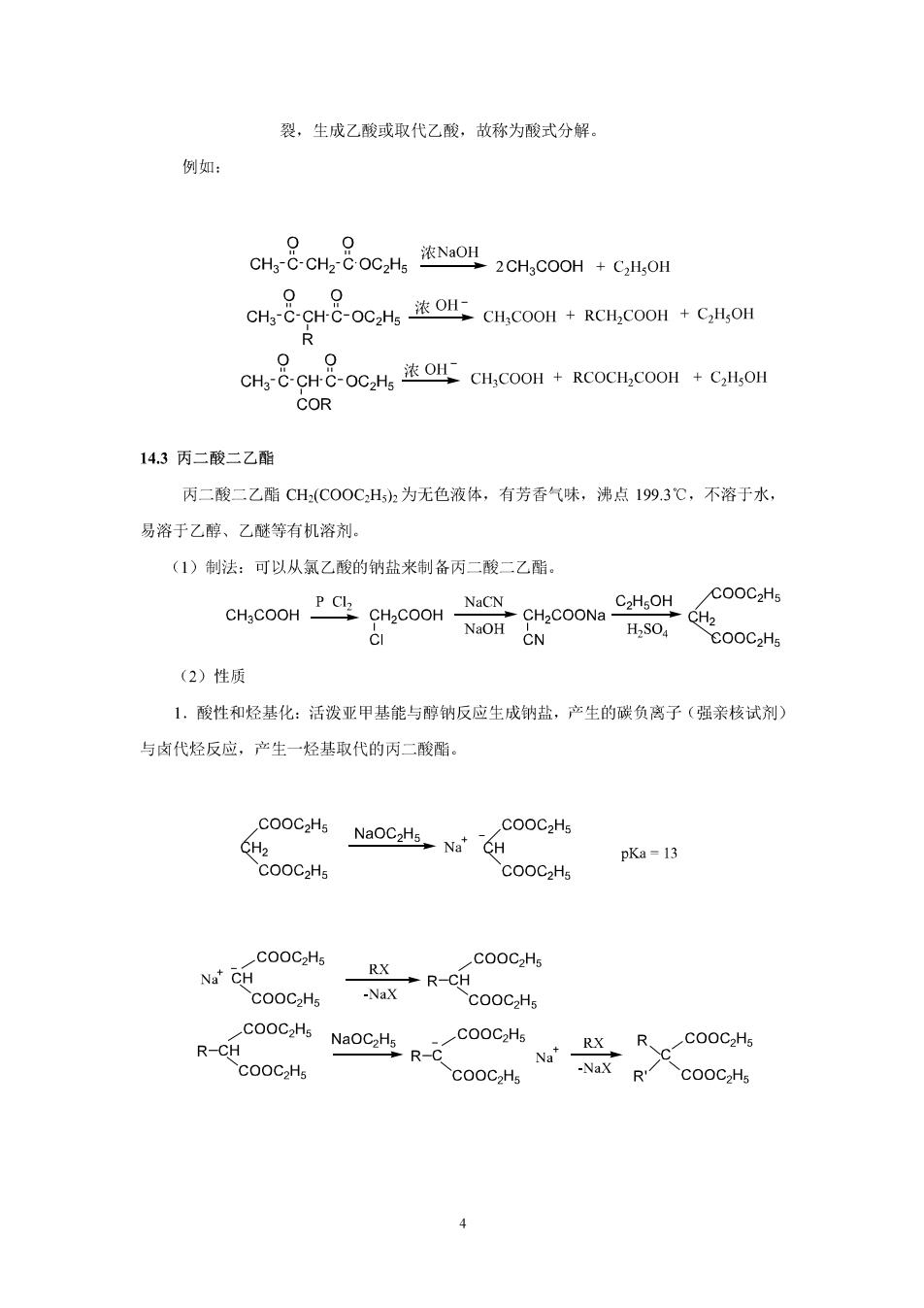
裂,生成乙酸或取代乙酸,故称为酸式分解 例如: CH.COOHCOLOW 0 0 CHHC CH.COOH+RCOCH.COOM+CH.OH COR 14.3丙二酸二乙酯 丙二酸二乙酯CH:(C0OCHh为无色液体,有芳香气味,沸点199.3℃,不溶于水, 易溶于乙醇、乙醚等有机溶剂。 (1)制法:可以从氯乙酸的钠盐来制备丙二酸二乙酯。 NaCN N.OH CN H2SO4 (2)性质 1.酸性和烃基化:活泼亚甲基能与醇钠反应生成钠盐,产生的碳负离子(强亲核试剂) 与卤代烃反应,产生一烃基取代的丙二酸霜 cooC,Hs NaOC步,NG pKa-13 COoC2Hs Na'CH RX COOC2Hs COoC2Hs R-ccoc COOC2Hs COOC2Hs RCOOC2Hs

NaOC (CH2)n CH(COOC2Hs)2 CH2l2 C(COOC2H5)2 -(CH2)n CH2 X(CHa)nX NaOCH n-37 CH(COOC2Hs)2 COOC2Hs CH2(COOC2Hs)2 (1)NaOC,Hs (2)Br(CH2)4Br COoC2Hs 2.水解脱羧 丙二酸二乙酯及其取代衍生物水解生成丙二酸,丙二酸不稳定,易脱羧成为羧酸。 例如: COOC2Hs COONa R-CH NaOH R-CH ()H* 0oNa(2)△-C →R-CH2COH COOC2Hs H.O R-CHCOOH H,0 (2)△-c02R .. NaOH (1)H* COOC2Hs H2O 2a-c0 ·○cooH (3)丙二酸二乙酯在有机合成的应用 丙二酸二乙酯的上述性质在有机合成上用途很广,用于合成各种类型的羧酸(一取代乙 酸,二取代乙酸,环烷基甲酸,二元羧酸等)。 例如,用丙二酸酯合成法合成下列化合物,其结构分析如下: 引入人,9 CH3-CH2 c001原有 引入一儿o限有 引入CH2CH2COOH:y原有 CHCH2 CH-COOH原有 入一CH.COOH 具有活泼亚甲基的化合物容易在碱性条件下形成稳定的碳负离子,所以它们还可以和

羰基发生一系列亲核加成,例如,柯诺瓦诺格(Knoevenagel)反应,迈克尔(Michael)反 应。见P6 14.4.酯缩合反应 ①克菜森(Claisen)缩合反应-乙酰乙酸乙酯的合成 P 0 9 CHCOCHsHCH2-OCHs NCHCCH2SOCHs+C2.OH 1.3一二排基什合物 这类反应称为Claisen缩合反应 历程: 0 P (1)CHsOHCH2COC2Hs -CH6O+CHzCoC5 pKa -24 pKa ~159 (2)CH3—C—OC2H5+-CH2C0C2H5、一CH3C一OC2H5 CH2COOC2H5 9 0 (3)CH- -ch-ct8-c月c5+e0 CH2COOC2Hs pKa-11 00 4) cHgC==CH-COC2+C2HsO

乙酸乙酯的酸性是很弱的(Pka一21),而乙醇钠又是一个比较弱的碱(乙醇Pka一15.9) 因此,可以想到乙酸乙酯形成的负离子在平衡体系中是很少的。这也就是说,用乙氧负离子 把乙酸乙酯变为CH.CO0CL是很困难的。但是在实际上为什么这个反应会进行的如此完全 呢?其原因就是最后产物乙酰乙酸乙酯是一个比较强的酸(Pk一11),形成很稳定的负离子 可以使平衡朝产物方向移动。体系中乙酸乙酯负离子浓度虽然很低,但一形成后,就不断的反 应,结果使反应完成。 当酯的á一碳上只有一个氢时,由于增加了经基的诱导效应,酸性减弱了,进行酯缩合反应 时,需要使用比醇钠更强的碱(如phCa,Na),夺取酯的a氢,形成较稳定的a负碳离子,才 能迫使反应朝右方进行。 ②交叉Claisen缩合 如两个酯只有一个酯有a一山,相互缩合就能得到一个单纯产物。 t.n.n 0 2.Ht 引入东甲卧苹 0 0 2H+ -CH-COCzH6 c0-6+w6oc 1C2Heo 2,H 碳酸乙酯 CeHs C2Hs0-C-CHCOOCHs+CzHsOH 引入酯基 7
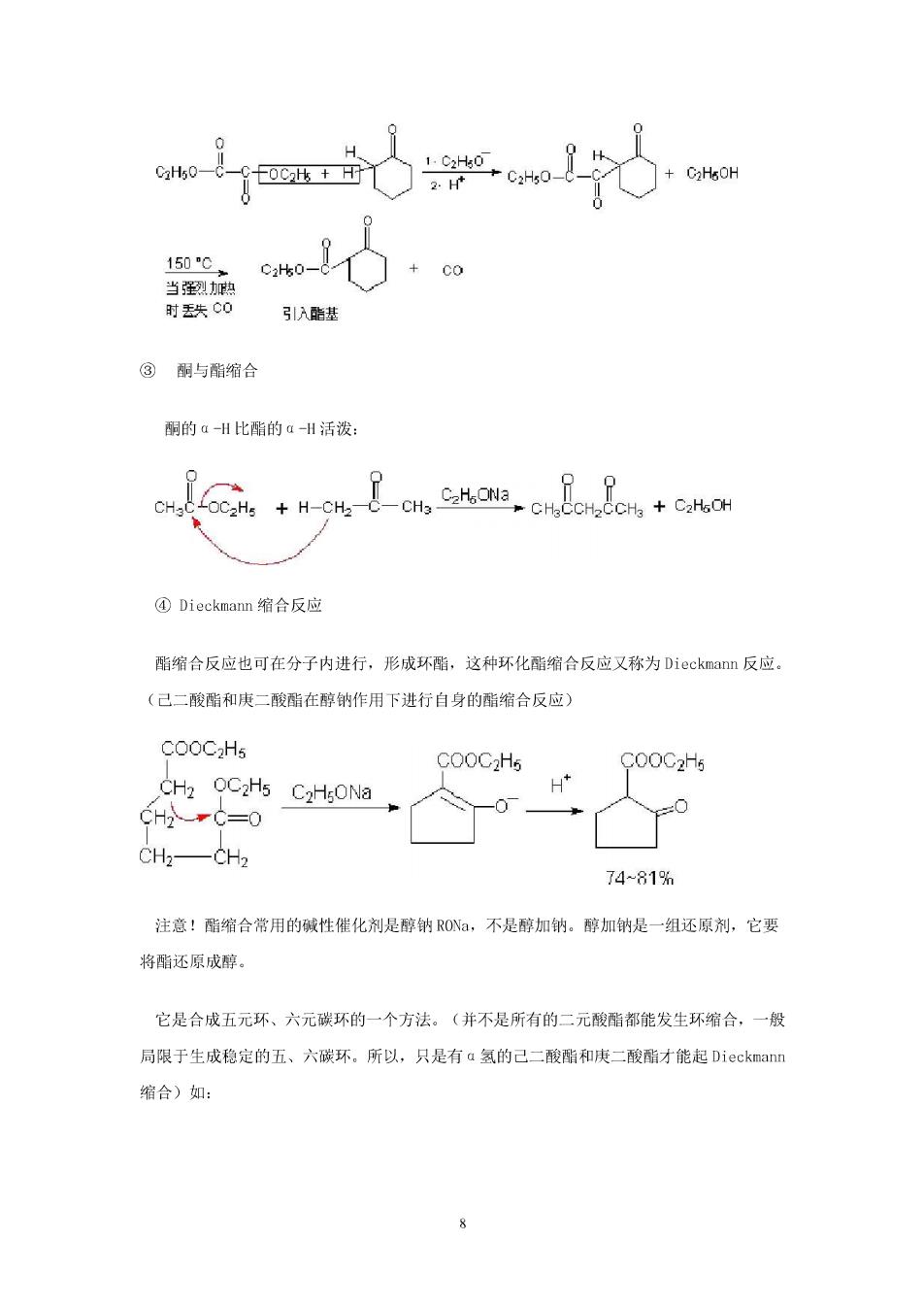
150 CHo-C 当烈加典 时丢失C0 引入酯基 ③酮与酯缩合 酮的aH比酯的aH活泼: ④Dieckmann缩合反应 酯缩合反应也可在分子内进行,形成环酯,这种环化酯缩合反应又称为Dieckmann反应。 (己二酸酯和庚二酸酯在醇钠作用下进行自身的酯缩合反应) COOC2Hs COOC2Hs COOC2H5 CH2 OC2Hs C2H:ONa H" CH-C=0 -0 CH—CH2 74~81% 注意!酯缩合常用的碱性催化剂是醇钠ON,不是醇加钠。醇加钠是一组还原剂,它要 将酯还原成醇 它是合成五元环、六元碳环的一个方法。(并不是所有的二元酸酯都能发生环缩合,一般 局限于生成稳定的五、六碳环.所以,只是有a氢的己二酸酯和庚二酸酯才能起Dieckmann 缩合)如:
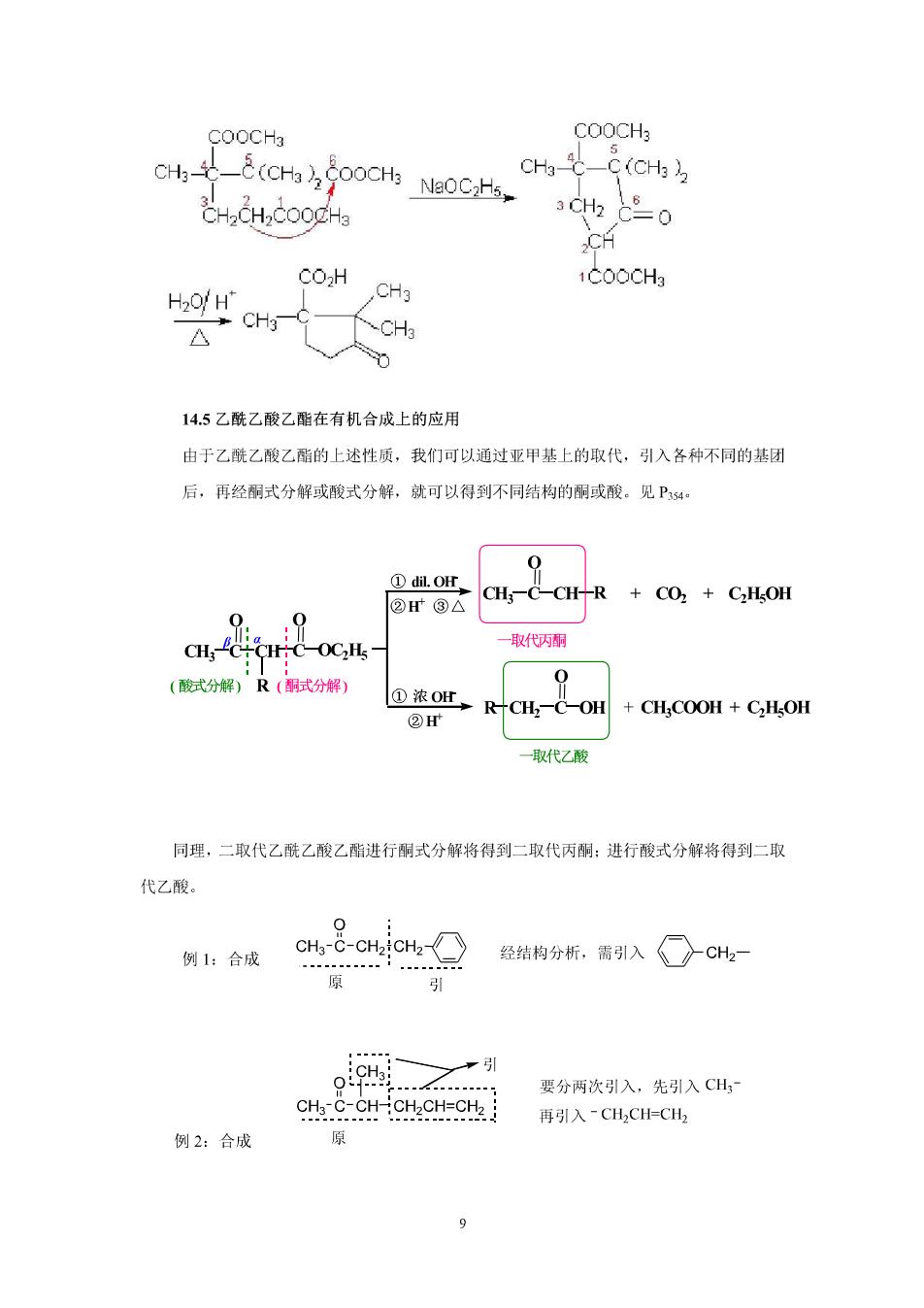
COOCH3 H.CH. CH COH H2O/H" CHg 1COOCH3 CH3 C △ CH3 14.5乙酰乙酸乙酯在有机合成上的应用 由于乙酰乙酸乙酯的上述性质,我们可以通过亚甲基上的取代,引入各种不同的基团 后,再经酮式分解或酸式分解,就可以得到不同结构的酮或酸。见P4: ①d.or ②③△ C-C-C叶R+C02+C,L0H 0 H:C-OCHs 一取代丙酮 (酸式分解)R(酮式分解) 0 ②HF RTCH一C-OH 一取代乙酸 同理,二取代乙酰乙酸乙酯进行酮式分解将得到二取代丙酮:进行酸式分解将得到二取 代乙酸。 0 例1:合成 CH-c-CH2CH2-》 经结构分析,需引入○CH2- 平月引 要分两次引入,先引入CH cH.C.CH CH CH-CH 再引入~CH,CHCH2 例2:合成

例3:合成 原 、原 说明:乙酰乙酸乙酯合成法主要用其酮式分解制取酮,酸式分解制酸很少,制酸一般用 丙二酸二乙酯合成法, §14.6不饱和羰基化合物 不饱和羧基化合物是指分子中即含有羰基,又含有不饱和烃基的化合物,根据不饱 和键和装基的相对位置可分为三类。 (1)烯酮(RCH=C=O) (2)a,B-不饱和酮(RCHCH-CHO) (3)孤立不饱和醛酮(RCH-CH(CH)CHO)n≥】 孤立不饱和醛酮兼有烯和羰基的性质,:,B-不饱和醛酮、烯酮有其特性及用途,下面 我们主要讨论这两类化合物。 14.6.1乙烯酮最简单且最重要的烯酮是乙烯酮 14.6.2a,B-不饱和醛酮 α,B-不饱和醛酮的结构特点是碳碳双链与羰基共轭,故α,B-不饱和醛酮兼有烯烃、 醛、酮和共轭二烯烃的性质,若与亲电试剂加成,则应加到碳碳双键上,若与亲核试剂加成 则应加到羰基上,但其特性反应是共轭加成。 1.共轭加成(1,2-加成或1,上-加成) 名装莲孩上有都分E电有有 由于羰基的极化和共钯x键的离域,不仅 部分正电荷,因此与亲核试剂加成时就有两 种可能 -0=-g-0出--6o -C=C-C=0+Nu- Nu Nu 山,4加成_ Nu 不稳定(互变】