
教学目的与要求 (1)了解土壤的组成 (2)掌握土壤的粒级分组和质地分组。 教学重点、难点 壤的 组和质地分组。 教学方法 讨论:土壤不同的质地分组有什么异同? 课堂练习、作业: 叙述我国士壤的粒级分组和质地分组分别是什么? 本次课教学内容小特 在我们周围 土壤的组成着手,再谈到士壤的粒级分组和质地分组 然后又对照不同的分类方法,其目的是为了以后的学习有 既的口 教学内容(讲稿) 筒介:土壤圈的位置:两大功能:农业生产的基础,净化剂。 全球范围的士壤环境问题:1、酸化,碱化,污染;2、沙漠化(石漠化);3、植被破坏;4、水土流失。 土壤由固体 液体和气体组成 孔体相( 、土壤有机质 相(空 气20 30%;矿物质45%;水20~30%;有机体5% 土壤矿物质是岩石经过物理和化学风化的产物,主要元素O、Si,A1、 Fe、C、Ca、K、Na、Mg、Ti.N、S.P等. (1)原生矿物 盖需8提68老得sg品体结有衣立主接种快有: 角闪石(Mg.Fe7(Si4O112(OH2橄榄石(Mg,Fe)2SiO4等. 特点:大多不稳定,易风化。 氧化类:石英SiO2金红石Ti02赤铁矿Fe203 特点:相当稳定,不易风化 硫化物类:黄铁矿白铁矿FeS, 特点:极易风化,是土壤中硫元素主要来源。 磷酸盐类:氟磷石Ca5(PO43F氯磷灰石Ca(PO43C ,是土壤中氟 素的主要来源 如:榄石的风化历程 风化:2Xe,R陶sO)+与0m+5H,0→93H,9+g,0+H,Om 水解2返,F网SO)+4H,0-→2Mgaw)+40Hg1+,5S50.+H,50an 酸性水解:(e.F@)SO+H→e2”倒)+2)+HSO (2)次生矿物 由原生矿物经化学风化后而转化形成新矿物,化学组成和晶体结构都有许改变。 简单盐类:方解石CaC03白云石(Ca,Mg)(C032石膏CaS04:2H20泻盐:MgS04,7H20岩盐NaC 芒硝Na2S04.10H2O
第四章 土壤环境化学 第一节 土壤的组成与性质 教学目的与要求: (1) 了解土壤的组成; (2) 掌握土壤的粒级分组和质地分组。 教学重点、难点: 土壤的粒级分组和质地分组。 教学方法及师生互动设计: 教学方法:讲授法; 师生互动设计:提问:土壤的组成有哪些? 讨论:土壤不同的质地分组有什么异同? 课堂练习、作业: 叙述我国土壤的粒级分组和质地分组分别是什么? 本次课教学内容小结: 土壤环境尽管就在我们周围,但是我们要很好的了解它是比较复杂的,这缘于土壤本身的复杂性。我们这节课从 土壤的组成着手,再谈到土壤的粒级分组和质地分组,然后又对照不同的分类方法,其目的是为了以后的学习有个大 概的认识。 教 学 内 容 (讲稿) 简介:土壤圈的位置;两大功能:农业生产的基础,净化剂。 全球范围的土壤环境问题:1、酸化,碱化,污染;2、沙漠化(石漠化);3、植被破坏;4、水土流失。 一、土壤的组成 1、土壤由固体、液体和气体组成: 土壤固体相(土壤矿物质、土壤有机质) 孔隙液相 (水分-溶液) 气相(空气)空气20~30%; 矿物质45%;水20~30%;有机体5% 2、土壤矿物质 土壤矿物质是岩石经过物理和化学风化的产物,主要元素 O、Si,Al、 Fe、C、Ca、K、Na、Mg、Ti、N、S、P等。 (1) 原生矿物 各种岩石受到程度不同的物理风化而来,未经化学风化的产物,化学组成和晶体结构没有改变。主要种类有: 硅酸盐类:长石 KAlSi3O8 云母K(Si3Al)Al2O10 (OH)2 辉石(Mg,Fe)SiO3 角闪石(Mg,Fe)7 (Si4O11 )2 (OH)2 橄榄石 (Mg,Fe)2SiO4等。 特点:大多不稳定,易风化。 氧化类:石英 SiO2 金红石 TiO2 赤铁矿 Fe2O3 特点:相当稳定,不易风化。 硫化物类:黄铁矿、白铁矿 FeS2 特点:极易风化,是土壤中硫元素主要来源。 磷酸盐类:氟磷石 Ca5 (PO4 )3F 氯磷灰石 Ca(PO4 )3Cl 特点:易风化,是土壤中氟元素的主要来源。 例如:橄榄石的风化历程: (2) 次生矿物 由原生矿物经化学风化后而转化形成新矿物,化学组成和晶体结构都有许改变。 简单盐类:方解石 CaCO3 白云石 (Ca,Mg)(CO3 )2 石膏 CaSO4 .2H2O 泻盐:MgSO4 .7H2O 岩盐 NaCl 芒硝 Na2SO4 .10H2O

三氧化物类:针铁矿Fe203.H20褐铁矿2Fe2033H20冰钻石Al203.3H20 次生硅酸盐类: 伊利石Al066(OH)Si4O10 空威m不军度致。影张性纹小,富合钾20),员有技商的阳离子代接量。品格中的生铝原 蒙脱石Al2(OH)2Si4O10 特点:粒径小于1μm,阳离子代换量极高,晶格中的硅、铝原子易发生同品取代:但它吸收的水分植物难以利用,不 利于植物的生长 高岭石Al2(OH4SiO5 特点:粒径较大,为0.1·5.0μm,膨胀性小,阳离子代换量也低,极少发生同晶取代。透水性好但保肥能力低。 (3)土壤有机质 体质量的10%以下 有机化合物,如树脂、脂舫;含N的有机化合物,如蛋白质:灰分物质,植物体燃烧后的残余物质。 动植物残体在微生物作用下转变成难以分解的高分子有机化合物。 3、土培水分 土壤中含水量约2.4×1023m3,不及水圈,含水总量的0.02% 毛细水潜水矿物结合水等形式存在 土壤水分的意义:土壤水分既是植物营养物的来源,也是污染物向其他圈层迁移的媒介 装水分仔在的红式 土壤颗粒表面有很强的粘附力 壤颗粒吸附的水分称吸着数层水分子,几平不移动,结构 的水分子借内聚力(水分子间的氢键)被保持在水膜 受水 4.土壤本气 以O2、NH3H2CH4NO2CO等. 特性:不连续性,存在于士粒间隙之间 湿度更高: 02少,C02多,有机质腐烂分解: 大气 土境 0221%(w/W0 15% 0.03% 有还原性气体N .庆细和污物等存 物质的 分组
三氧化物类:针铁矿Fe2O3 .H2O 褐铁矿 2Fe2O3 .3H2O 冰钻石 Al2O3 .3H2O 次生硅酸盐类: 伊利石 Al0.66 (OH)Si4O10 特点:粒径小于2μm,风化程度较低,膨胀性较小,富含钾(K2O),具有较高的阳离子代换量,晶格中的硅、铝原 子可发生同晶取代,但不显著。 蒙脱石 Al2 (OH)2Si4O10 特点:粒径小于1μm,阳离子代换量极高,晶格中的硅、铝原子易发生同晶取代;但它吸收的水分植物难以利用,不 利于植物的生长。 高岭石 Al2 (OH)4SiO5 特点:粒径较大,为0.1-5.0μm,膨胀性小,阳离子代换量也低,极少发生同晶取代。透水性好但保肥能力低。 (3) 土壤有机质 一般占固体质量的10%以下。 ① 非腐殖质 不含N的有机化合物,如树脂、脂肪;含N的有机化合物,如蛋白质;灰分物质,植物体燃烧后的残余物质。 ② 腐殖质 动植物残体在微生物作用下转变成难以分解的高分子有机化合物。 3、土壤水分 土壤中含水量约2.4×1023m3,不及水圈,含水总量的0.02% 毛细水 潜水 矿物结合水等形式存在 土壤水分的意义:土壤水分既是植物营养物的来源,也是污染物向其他圈层迁移的媒介 土壤水分存在的形式:土壤颗粒表面有很强的粘附力,土壤颗粒吸附的水分称吸着数层水分子,几乎不移动,结构与 冰相似,不被植物吸收,对植物无效。超过颗粒吸引力范围以外的水分子借内聚力(水分子间的氢键)被保持在水膜 中,外层的膜状水称内聚水或毛细管水,是植物生长的主要水源。 4、土壤空气 以O2、NH3 H2 CH4 NO2 CO等。 特性:不连续性,存在于土粒间隙之间; 湿度更高; O2少 ,CO2多,有机质腐烂分解; 大气 土壤 O2 21% (v/v) 15% CO2 0.03% 几% 有还原性气体(H2S、NH3、H2、CH4)、厌氧 细菌和污染物等存在。 二、土壤的粒级分组与质地分组 1、土壤矿物质的粒级划分
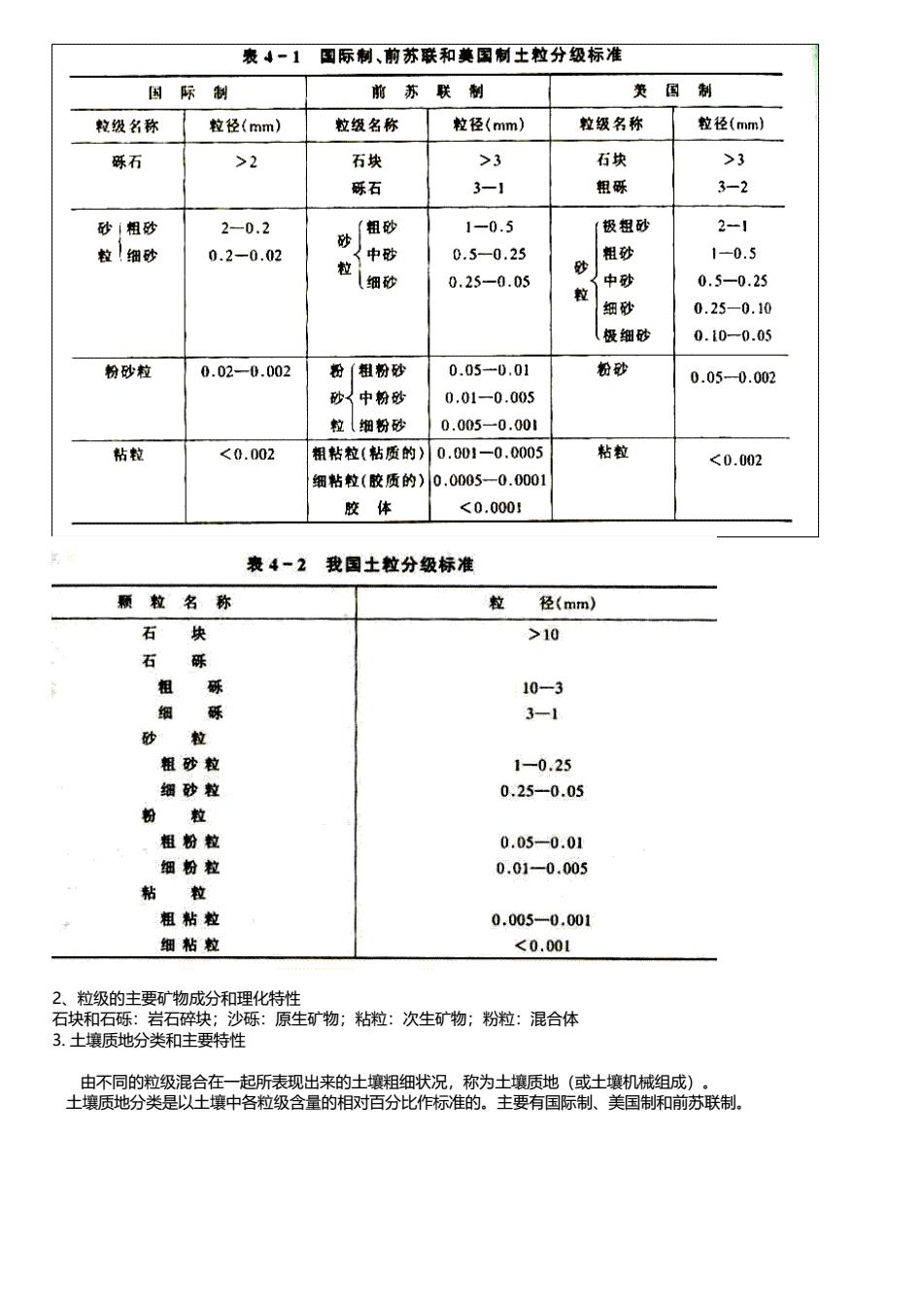
表↓一1图际制、前苏联和莫国制土粒分级标准 国际制 前苏联制 美国制 粒级名称粒径(mm) 粒级名称 粒径(mm) 粒级名称 粒径(mm) 砾石 >2 万块 >3 石块 >3 砾石 3-1 粗 3-2 砂粗砂 2-0.2 粗砂 1-0.5 极粗砂 2-1 粒细砂 砂 0.2-0.02 中砂 1-0.5 细的 0.5-0.25 砂 0.25-0.05 中砂 0.5-0.25 细砂 0.25-0.10 (极细砂 0.10-0.05 粉砂粒 0.02-0.002 粉粗粉砂 0.05-0.01 粉砂 0.05-0.002 砂中粉砂 0.01-0.003 粒(细粉砂 0.005-0.001 粘粒 10 酥 10-3 细 酥 3-1 粗砂粒 1-0.25 细砂粒 0.25-0.05 粗粉粒 0.05-0.01 细粉粒 0.01-0.005 粗粘粒 0.005-0.001 细粘粒 <0.00l 粒级的主要矿物成分和理化特性 和白 石1 沙砾:原生矿物:粘粒:次生矿物:粉粒:混合体 由不同的数级混合在一起所表现出来的十镶粗细状况称为十牌质地成十牌机城组成) 土壤质地分类是以土壤中各粒级含量的相对百分比作标准的。主要有国际制、美国制和前苏联制.】
2、粒级的主要矿物成分和理化特性 石块和石砾:岩石碎块;沙砾:原生矿物;粘粒:次生矿物;粉粒:混合体 3. 土壤质地分类和主要特性 由不同的粒级混合在一起所表现出来的土壤粗细状况,称为土壤质地(或土壤机械组成)。 土壤质地分类是以土壤中各粒级含量的相对百分比作标准的。主要有国际制、美国制和前苏联制
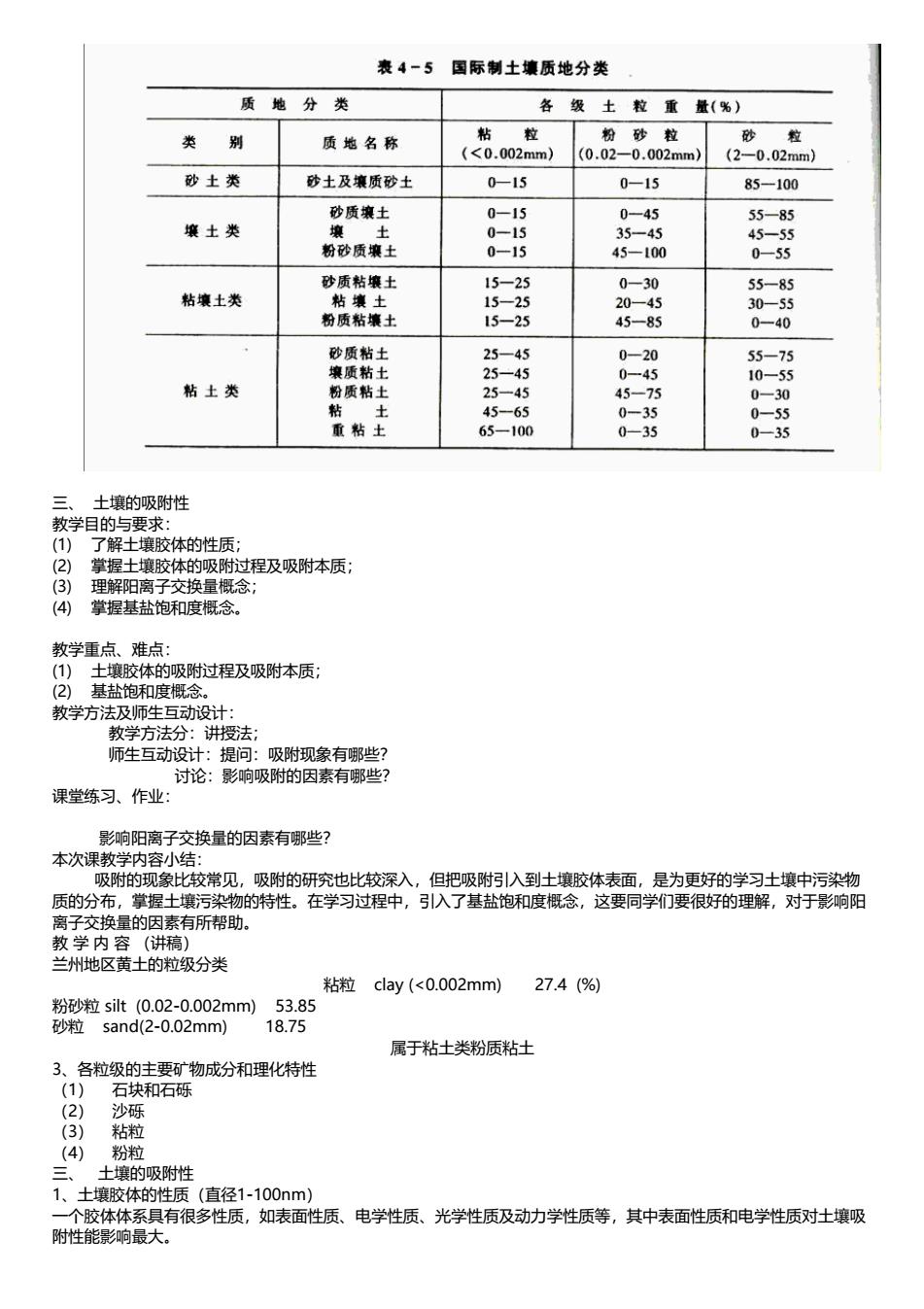
表4-5国际制土壤质地分类 质地分 各级士粒重量(%) 类别 质地名称 粘 粒 粉砂粒 (<0.002mm) (0.02-0.002mm) (2-0.02mm) 砂土类 砂土及壤质砂士 0-15 0-15 85-100 砂质镶土 0-15 0-45 55-85 壤土类 35-45 45-55 45一100 0-55 砂质粘壤士 粘壤土类 粘壤士 粉质粘壤土 15-25 45-85 25-45 55-75 粘土类 粉质粘士 25-45 45-65 0-35 65一100 0-35 035 土蠊的吸附性 教学目的与要求: (1)了解土壤胶体的性质; (②)掌握士壤胶体的吸附过程及吸附本质; 掌握基盐饱和度概念。 教学重点、难 体的吸附过程及吸附本质 教学方法及师生互动设计: 教学方法分:讲授法: 师生互动设计:提问:吸附现象有哪些 讨论:影响吸附的因素有哪些 课堂练习、作业 影响阳离子交换量的因素有哪些? 本次 内小生 吸附的现象比校常见,吸附的研究也比校深入,但把吸附引入到土壤胶体表面,是为更好的学习土壤中污染物 质的分布,掌握土壤污染物的特性。在学习过程中,引入了基盐饱和度概念,这要同学们要很好的理解,对于影响阳 离子交换量的因素有所帮助。 教学内容(讲稿) 兰州地区黄土的粒级分类 粘粒cay(<0.002mm)27.4(%) m 属于粘士类粉质粘士 3、各粒级的主要矿物成分和理化特性 1) 石块和石砾 沙砾 (3) 粘粒 (4) 粉和 吸附性 直径1-100nm) 有很多性质 如表面性质、 电学性质、光学性质及动力学性质等,其中表面性质和电学性质对士壤吸
三、 土壤的吸附性 教学目的与要求: (1) 了解土壤胶体的性质; (2) 掌握土壤胶体的吸附过程及吸附本质; (3) 理解阳离子交换量概念; (4) 掌握基盐饱和度概念。 教学重点、难点: (1) 土壤胶体的吸附过程及吸附本质; (2) 基盐饱和度概念。 教学方法及师生互动设计: 教学方法分:讲授法; 师生互动设计:提问:吸附现象有哪些? 讨论:影响吸附的因素有哪些? 课堂练习、作业: 影响阳离子交换量的因素有哪些? 本次课教学内容小结: 吸附的现象比较常见,吸附的研究也比较深入,但把吸附引入到土壤胶体表面,是为更好的学习土壤中污染物 质的分布,掌握土壤污染物的特性。在学习过程中,引入了基盐饱和度概念,这要同学们要很好的理解,对于影响阳 离子交换量的因素有所帮助。 教 学 内 容 (讲稿) 兰州地区黄土的粒级分类 粘粒 clay (<0.002mm) 27.4 (%) 粉砂粒 silt (0.02-0.002mm) 53.85 砂粒 sand(2-0.02mm) 18.75 属于粘土类粉质粘土 3、各粒级的主要矿物成分和理化特性 (1) 石块和石砾 (2) 沙砾 (3) 粘粒 (4) 粉粒 三、 土壤的吸附性 1、土壤胶体的性质(直径1-100nm) 一个胶体体系具有很多性质,如表面性质、电学性质、光学性质及动力学性质等,其中表面性质和电学性质对土壤吸 附性能影响最大

(1)士壤胶体具有极大的此表面积和表面能:蒙脱石比表面积最大(600-800m2/g)高岭石最小(7-30 m2有机胶体比表面积大700m2g) 体员 面 的 、受到内外部 两种不同的引力,因而具有多余的自由能即表面能,这是土壤 用的主要原因。比表面积®大,表面能大,胶体的吸附性愈大 般带负电荷,形成一个负离子层(决定电位离子层),其外部由于电性吸引而形成一个正离子层 (后离子层成扩层) 固体表面离子带相反电荷的离子(异电离子、补偿离子),由于离子的热运动,并不是全部整齐地排列在一个面上, 而是随着距界面的远近,有一定的浓度分布。倘若取溶胶中的胶粒的一部分为例,其电荷分布的情况就如图所示 双电层可分为两部分: 一部分为紧靠固体表面的不流动层,称为紧密层,其厚度约有几个水分子的大小,即由固体表 至然男部附监称的电散是过的异电离子逐减少而至零, 层是可 的子分位品费品S位为0,这个电位防为总电位 的。 由这两部分所 电 叫热力学电位 非活动性的离子层与液体间的电位差叫电动电位。扩散层厚度增大电动电位增加。 永久负电荷:同晶置换产生 可变电荷:随pH的变化而变化。 (3)土壤胶体的凝聚性和分散性 体微 液中含有 体的 聚性主要取决于其电动电位的大小和散层的厚度;此外,土壤溶液中的电解质和pH值也有影响。常 见阳离子凝聚力的强弱顺序 *蒙脱石>水化云母>高岭土>水合氧化铁、铝 土壤质地越细,阳离子交换量越高 胶体中SiO2/R203比值越大,阳离子交换量越高 >m 下降 交换量降低 含量, 寒吸附性质的重要指标 测定:用C2+作指示剂,8a2+作取剂,原子吸收分光光度法定, 可交换 致酸阳离子(AI3+、H+) 阳离子盐基阳离子(Ca2+、Mg2+、K+、Na+等) 盐基饱和士壤 子全部是盐基阳离子时,这种士壤称为盐基饱和士壤 4 带正电荷的胶体吸附的阴离子与土壤溶液中的阴离子交换。易被吸附的阴离子是PO43-、H2P04-、HPO42: 等,与带正电荷的土壤胶体中阳离子Ca2+、F®3+、AI3+等结合生成难溶性化合物而被强烈吸附. 吸附能力很弱的阴离子C、NO3、NO2-等,只有在极酸性的溶液中才被吸附。 吸附顺序: F.>C2O42->柠檬酸根>P043->HCO3->H2BO3->Ac->SCN->S042.>C->NO3
(1)土壤胶体具有极大的比表面积和表面能: 蒙脱石比表面积最大(600-800 m2/g)高岭石最小(7-30 m2/g),有机胶体比表面积也大(-700 m2/g) 胶体表面分子与内部分子所处的状态不同,受到内外部两种不同的引力,因而具有多余的自由能即表面能,这是土壤 胶体具有吸附作用的主要原因。比表面积愈大,表面能愈大,胶体的吸附性愈大。 (2)土壤胶体的电性 土壤胶体微粒一般带负电荷,形成一个负离子层(决定电位离子层),其外部由于电性吸引而形成一个正离子层 (反离子层或扩散层),即合称双电层。 固体表面离子带相反电荷的离子(异电离子、补偿离子),由于离子的热运动,并不是全部整齐地排列在一个面上, 而是随着距界面的远近,有一定的浓度分布。倘若取溶胶中的胶粒的一部分为例,其电荷分布的情况就如图所示。 双电层可分为两部分:一部分为紧靠固体表面的不流动层,称为紧密层,其厚度约有几个水分子的大小,即由固体表 面至虚线AB处;另一部分包括从AB到距表面为d处,称为分(扩)散层,在这层中过剩的异电离子逐渐减少而至零。 这一层是可以流动的。由这两部分所形成的双电层。称为分散双电层(简称双电层)。 固体表面MN吸附一定量的离子,其电位相对于CD处为φ,或者说CD与MN间的电位差为φ,这个电位称为总电位 差,也叫热力学电位。 非活动性的离子层与液体间的电位差叫电动电位。扩散层厚度增大电动电位增加。 永久负电荷:同晶置换产生 可变电荷:随pH的变化而变化。 (3)土壤胶体的凝聚性和分散性 由于土壤胶体微粒带负电荷,胶体粒子相互排斥,具有分散性,负电荷越多,负的电动电位越高,分散性越强; 另一方面土壤溶液中含有阳离子,可以中和负电荷使胶体凝聚,同时由于胶体比表面能很大,为减少表面能,胶体也 具有相互吸引、凝聚的趋势。 土壤胶体的凝聚性主要取决于其电动电位的大小和扩散层的厚度;此外,土壤溶液中的电解质和 pH 值也有影响。常 见阳离子凝聚力的强弱顺序: 2、土壤胶体的阳离子交换吸附(可逆过程) 土壤胶体微粒带负电荷,表面可吸附阳离子,可与土壤溶液中另一些阳离子发生交换。土壤胶体扩散层中的补偿离 子,可以和溶液中相同电荷的离子以离子价为依据作等价交换,称离子交换(或代换)作用,包括阳离子交换吸附和 阴离子交换吸附。 例如: 影响阳离子交换吸附的因素 阳离子 (电荷数,离子半径,水化程度) 土壤(胶体,颗粒, SiO2/R2O3、pH等) 不同土壤的阳离子交换量不同: v 不同种类的胶体的阳离子交换量顺序 有机胶体 >蒙脱石 > 水化云母 > 高岭土 > 水合氧化铁、铝 v 土壤质地越细,阳离子交换量越高; v 土壤胶体中SiO2/R2O3比值越大,阳离子交换量越高; v pH值下降,阳离子交换量降低。 3、阳离子交换量(cation exchange capacity CEC) CEC表示每千克土中阳离子的总含量,是表示土壤吸附性质的重要指标。 单位:厘摩尔/每千克土 (cmol/kg) 测定:用Ca2+作指示剂,Ba2+作萃取剂,原子吸收分光光度法测定。 可交换 致酸阳离子(Al3+、H+) 阳离子 盐基阳离子(Ca2+、Mg2+、K+、Na+等) 盐基饱和土壤: 土壤胶体吸附的阳离子全部是盐基阳离子时,这种土壤称为盐基饱和土壤。 4、 土壤胶体的阴离子交换吸附 带正电荷的胶体吸附的阴离子与土壤溶液中的阴离子交换。易被吸附的阴离子是PO43-、H2PO4-、HPO42- 等,与带正电荷的土壤胶体中阳离子Ca2+、Fe3+、Al3+等结合生成难溶性化合物而被强烈吸附。 吸附能力很弱的阴离子Cl-、NO3-、NO2-等,只有在极酸性的溶液中才被吸附。 吸附顺序: F- > C2O42- > 柠檬酸根 > PO43- > HCO3-> H2BO3- > Ac- > SCN- > SO42- > Cl- > NO3-

四 土壤酸碱性 学目的与要求: (1) 了解土壤酸度的分 潜性酸度概念及它们相互之间的关系 作用 教学重点:土壤的酸碱度;土壤的缓冲作用; 教学难点:活性酸度、潜性酸度概念及它们相互之间的关系, 教学方法及师生互动设计: 教学万法:讲授法 士壤酸度是如何形成的? 、课堂待子作花:活粗短度、福性酸相百之问的关系, 筒术酸性降水时十牌酸性的号影响 本次课教学内容小结: 通过土壤酸碱度的学习,让同学们了解到导致土壤酸碱性的原因。理解活性酸度、潜性酸度概念:以及土壤酸 碱性缓冲溶液的作用机理。 教学内容(讲稿) 土酸碱度分级5-556065~7075-8595 D 酸碱度分级:强酸 酸 中碱减器减 1、土壤酸度 根据士壤中H+存在的形式,土壤酸度可分为两类: (1)活性酸度activity acidity(有效酸度) 游离H*的来源! ①C02溶于水形成的H2C03 ②有机质分解生成的有机酸, ③物质军化生的无酸 ④施肥残留的无机酸 是由上商子造,H、A3+酸离子有过离子交换作用产生:商子才星示 酸性,因此称性酸 根据测定潜性酸度的提取液不同,可分为 A 代换性酸度(交换性酸度) 用过量的中性盐(KCL、NaCI等)淋洗土壤,溶液中金属离子与土壤中H+、Al3+离子交换:士壤胶体-H++KC一 土壤胶体-K++HC 由胶休A33KC 用是碱洗,溶液中金属离子可将士填胶体吸附的H+、A3+离子代换出来,同时生成弱酸,此时溪定该 弱酸的酸度称水解性酸度 NaAc H20- HAc+Na++OH-) 仕壤胶体-A3+H++4NaAc 仕壤胶体-4Na++AI(OH)3+4HAc 代换性酸度只是水解性酸度的一部分,因此水解性酸度高于代换性酸度。 活性酸度和潜性酸度二者的关系 活性酸度 潜性酸度是 仕于 衡体系的两种 酸度 二者可以相互转换 定条件下可处于暂时平衡。 之比在沙中达100,有机质丰富的站土中高达上万倍
四、 土壤酸碱性 教学目的与要求: (1) 了解土壤酸度的分级; (2) 理解活性酸度、潜性酸度概念及它们相互之间的关系; (3) 了解土壤的碱度; (4) 掌握土壤的缓冲作用。 教学重点、难点: 教学重点:土壤的酸碱度;土壤的缓冲作用; 教学难点:活性酸度、潜性酸度概念及它们相互之间的关系。 教学方法及师生互动设计: 教学方法:讲授法; 师生互动设计:提问:土壤酸度是如何形成的? 讨论:活性酸度、潜性酸度相互之间的关系。 课堂练习、作业: 简述酸性降水对土壤酸性的影响。 本次课教学内容小结: 通过土壤酸碱度的学习,让同学们了解到导致土壤酸碱性的原因。理解活性酸度、潜性酸度概念;以及土壤酸 碱性缓冲溶液的作用机理。 教 学 内 容 (讲稿) 土壤酸碱度分级 PH值: < 4.5 ~5.5 ~6.0 ~6.5 ~7.0 ~ 7.5 ~8.5~ 9.5< 酸碱度分级: 强酸 酸 弱酸 中 弱碱 碱 强碱 1、土壤酸度 根据土壤中H+存在的形式,土壤酸度可分为两类: v (1) 活性酸度 activity acidity(有效酸度) 土壤溶液中氢离子浓度的直接反映出来的酸度,通常用pH表示(通常描述土壤 性质时表示作土壤pH值 )。 游离H+的来源: ① CO2溶于水形成的H2CO3 ; ② 有机质分解生成的有机酸; ③ 矿物质氧化生成的无机酸; ④ 施肥残留的无机酸; v (2)潜性酸度 potential acidity 是由土壤胶体吸附的可代换性H+、Al3+离子造成的。H+、Al3+致酸离子只有通过离子交换作用产生H+离子才显示 酸性,因此称潜性酸度。 根据测定潜性酸度的提取液不同,可分为 A、 代换性酸度(交换性酸度) 用过量的中性盐(KCl、NaCl等) 淋洗土壤,溶液中金属离子与土壤中H+、Al3+离子交换:|土壤胶体|-H+ + KCl → |土壤胶体|-K+ + HCl |土壤胶体|-Al3++ 3KCl→|土壤胶体|-3K+ + AlCl3 AlCl3 + H2O → Al(HO)3 + 3HCl B、 水解性酸度 用强碱弱酸盐淋洗土壤,溶液中金属离子可将土壤胶体吸附的H+、Al3+离子代换出来,同时生成弱酸,此时测定该 弱酸的酸度称水解性酸度。 ( NaAc + H2O → HAc + Na+ + OH- ) |土壤胶体|-Al3+、H+ + 4NaAc → |土壤胶体|-4Na+ + Al(OH)3 + 4HAc 代换性酸度只是水解性酸度的一部分,因此水解性酸度高于代换性酸度。 C、 活性酸度和潜性酸度二者的关系 活性酸度与潜性酸度是存在于同一平衡体系的两种酸度,二者可以相互转换,一定条件下可处于暂时平衡。 活性酸度是土壤酸度的现实表现,土壤胶体是H+ Al3+的储存库,因此潜性酸度是活性酸度的储备。 一般情况下,潜性酸度远大于活性酸度。二者之比在沙土中达1000,有机质丰富的粘土中高达上万倍

2、土壤碱度 士壤溶液中的○州离子,主要来源于碱金属和碱土金属的碳酸盐类,即碳酸盐碱度和重碳酸盐碱度的总量称为总碱 可用滴定 p75-85 CaCO3.MaCO3难溶 22C03 10 NaHCO3,Ca(HCO3)2 pH 7.5-8.5 土壤胶体上吸附阳离子(Na+、K+、Mg2+)的饱和度增加,可引起交换性阳离子的水解作用: 土壤胶体剂-xNa++yH20一土壤胶体-(-y)Na+、yH++yNaOH 结果在土壤溶液中产生NaOH,使土壤呈碱性。如果土壤溶液中存在大量CO2,可生成NaHCO.3或Na2CO3,因此吸 撞的 指土壤具有缓和其H发生剧变化的能力,它可以保持士壤反应的相对稳定,为植物生长和土壤生 物创比纹稳定的件环 (1)土士壤溶液的缓冲作用(pH6.2.7.8) 土壤溶液中含有碳酸、硅酸、磷酸、腐殖酸和其它有机酸及其盐类,构成很好的缓冲体系。待别某些有机酸是两性 物质,如:蛋白质、氨基酸、胡敏酸等。 有机酸的缓冲作用: NH2 NH3CI R-C OOH HCI R-CH :COOH +NaOH R-CH +H20 COOH=COONa (2)土壤胶体的缓冲作用 土壤胶体中存在有代换性阳离子 士壤胶体州-M++HC一士壤胶体-H++MC(缓冲酸) 士壤胶体H++MC一土壤胶体-M++HC(缓冲碱) 士壤胶体的数量和盐基代换量越大 士的缓冲能力越强:代换量相当时,盐基饱和度越高,土壤对酸的缓冲能力越 的缓中能力增加。 用 此学 的 牛家药由o楼纯n时A3调水宽酸壤(P片5中AH2 出h入徒 基的铝离子容易聚合,聚合体愈大,中和的碱愈多,pH>5.5,A13+失去缓冲作用。反应如下: 2[A(H,0)]+20H-[A,(OH),(H,0+4H,9 以上原因导致AI3+的增加,A对土壤的危害:三价A1与土壤胶体结合能力强,易排挤其它阳离子使其进入土壤溶液而 遭受淋溶损失;研究表明,土壤对植物的酸害实际是铝害,过多的铝离子抑制植物生长。 (4酸性降水对土壤酸化的影响 寒带,以灰 亚热带,以氧 为 红壤,以高岭土为主,高岭土颗粒大,阳离子代换量低,对酸的缓冲能力小 日少 从地理位置上看红壤地区气温高,有机质易分解 土壤有机质低于 ,有机物对酸的缓冲能力也小 例如:北京褐土粘粒,阳离子交换量56,江西22,广东21,海南5. 五、土壤的氧化还原性 8=+0.0592.[氧化剂 「还原剂 E>77m Fe*.E<-100mv Fe"EK-200m FeS E=400-700mwN0,;E<400mwN0,:E<200wH
2、土壤碱度 土壤溶液中的OH-离子,主要来源于碱金属和碱土金属的碳酸盐类,即碳酸盐碱度和重碳酸盐碱度的总量称为总碱 度,可用滴定法测定。 不同碳酸盐和重碳酸盐对碱度的贡献不同: CaCO3、MgCO3 难溶,石灰性土壤 pH 7.5 - 8.5, Na2CO3 pH >10, NaHCO3、Ca(HCO3)2 pH 7.5 - 8.5 土壤胶体上吸附阳离子(Na+、K+、Mg2+ )的饱和度增加,可引起交换性阳离子的水解作用: 土壤胶体|-xNa+ + yH2O → 土壤胶体|-(x-y)Na+、yH+ + yNaOH 结果在土壤溶液中产生NaOH,使土壤呈碱性。如果土壤溶液中存在大量CO2,可生成NaHCO3或Na2CO3,因此吸 附Na+多的土壤大多呈碱性。 3、土壤的缓冲性能 土壤的缓冲性能是指土壤具有缓和其pH发生剧烈变化的能力,它可以保持土壤反应的相对稳定,为植物生长和土壤生 物创造比较稳定的生活环境。 (1) 土壤溶液的缓冲作用( pH 6.2 - 7.8) 土壤溶液中含有碳酸、硅酸、磷酸、腐殖酸和其它有机酸及其盐类,构成很好的缓冲体系。特别某些有机酸是两性 物质,如:蛋白质、氨基酸、胡敏酸等。 有机酸的缓冲作用: NH2 = NH3Cl R-CH + HCl = R-CH COOH = COOH NH2 = NH3Cl R-CH + NaOH = R-CH + H2O COOH = COONa (2) 土壤胶体的缓冲作用 土壤胶体中存在有代换性阳离子 土壤胶体|-M++ HCl → 土壤胶体|-H+ + MCl ( 缓冲酸) 土壤胶体|-H++ MCl → 土壤胶体|-M+ + HCl (缓冲碱) 土壤胶体的数量和盐基代换量越大,土壤的缓冲能力越强;代换量相当时,盐基饱和度越高,土壤对酸的缓冲能力越 大;反之,盐基饱和度减小,土壤对碱的缓冲能力增加。 (3) 铝离子对碱的缓冲作用 p215 有些学者认为酸性土壤中单独存在的Al3+也起缓冲作用,酸性土壤(pH 5.5,Al3+失去缓冲作用。反应如下: 以上原因导致Al3+的增加,Al对土壤的危害:三价Al与土壤胶体结合能力强,易排挤其它阳离子使其进入土壤溶液而 遭受淋溶损失;研究表明,土壤对植物的酸害实际是铝害,过多的铝离子抑制植物生长。 (4) 酸性降水对土壤酸化的影响 从土壤的类型上看 酸性土壤分布在多雨、温寒带,以灰土为主;热带、亚热带,以氧化土为主。 中国:东北兴安岭区(土壤同北美、北欧)长江以南川贵滇黄壤区、华中华南红壤区 从矿物质来看 红壤,以高岭土为主,高岭土颗粒大,阳离子代换量低,对酸的缓冲能力小,易酸化。 从地理位置上看红壤地区气温高,有机质易分解,土壤有机质低于北方,有机物对酸的缓冲能力也小。 例如:北京褐土粘粒,阳离子交换量56, 江西 22,广东21,海南5。 五、土壤的氧化还原性 1、土壤氧化还原电位 E ↗ 得电子能力越强,越易被还原,以氧花态型式存在; E ↘ 失电子能力越强,越易被氧化,以还原态型式存在。 例如:

2、土壤氧化还原平衡体系 铁体系RF锰体系M“台M2琉体系O台HS 氨体系M0分OM0分从0台N有机碳体系C0,分CH, 好氧 有机物 -C-0H c0,+H0 缺 +有机酸+醇+C0, 厌氧 CH 3、土接氧化还原平衡体系的影响因素 )土壤含水 皇地土填的E=+400-+700mv 水田土接的E=+300-+200m (2②)土壤的通气情况 土壤透气良好,土壤空气含氧量高,土壤电极电位较高,如表层土壤主要为氧化态;土壤透气不好,土壤空气 含氧量低,士壤电极电位较低,如深层士壤,士壤呈还原态。 ()微生物活动 微生物的活动: 分解等需要氧气,导致氧气浓度降低,电极电位下降 易分有机质的 ,导致电极电位下降 ()易氧化或易还原的无机物质含量 E氧化性越强土壤星氧花态 £、还原性越强土壤呈还原态 (⑥)植物根系的代谢作用 植物根系分泌出有机酸、造成根系周边生物活动,降低电极电位: ()PH 氧化剂+服+mH台还原剂十yH,0 E=E+0052,g[氧化初[以了 n [还原剂 =E”+0.0592 「氧化剂门 n 8还原剂 -0.059p pH7EpH增大一个单位,E值下降0.06V 4、土壤氧化还原反应的重要意义 (1)影响元素迁移转化过程 E对于易溶解的高价离子越易迁如:(U04)2(N04)2(Mo04)2(CO42) E FeS CuS PbO等沉淀不易汪移 (②)对土壤养分的影响 氨素和各种矿物质在土壤中处于氧花态才能被很好的吸收,要求电极电位较高,一般地,E=200~700mv 时,养分供应正常。 酸碱性 HS分S02台S03台H2S0
2、土壤氧化还原平衡体系 3、土壤氧化还原平衡体系的影响因素 ⑴ 土壤含水量 旱地土壤的E=+400~+700mv; 水田土壤的E=+300~+200mv ⑵ 土壤的通气情况 土壤透气良好,土壤空气含氧量高,土壤电极电位较高,如表层土壤主要为氧化态;土壤透气不好,土壤空气 含氧量低,土壤电极电位较低,如深层土壤,土壤呈还原态。 ⑶ 微生物活动 微生物的活动、分解等需要氧气,导致氧气浓度降低,电极电位下降 ⑷ 易分解有机质的含量 有机质分解大量的氧,导致电极电位下降。 ⑸ 易氧化或易还原的无机物质含量 E ↗ 氧化性越强 土壤呈氧花态 E ↘ 还原性越强 土壤呈还原态 ⑹ 植物根系的代谢作用 植物根系分泌出有机酸、造成根系周边生物活动,降低电极电位; ⑺ PH值 pH ↗ E ↘ pH增大一个单位,E值下降0.06V 4、土壤氧化还原反应的重要意义 ⑴ 影响元素迁移转化过程 E ↗ 对于易溶解的高价离子越易迁如:(UO4)2- (VO4 ) 2- (MoO4 ) 2- (CrO4 2- ) E ↘ FeS CuS PbO 等沉淀不易迁移 ⑵ 对土壤养分的影响 氮素和各种矿物质在土壤中处于氧花态才能被很好的吸收,要求电极电位较高,一般地, E=200~700mv 时,养分供应正常。 ⑶ 影响土壤酸碱性