
有机化学教案 第章 第五章脂环烃 学习目的和要求 1.掌握脂环经的定义和命名 2.掌握脂环烃的结构和性质。 3.掌握环的大小与环张力、稳定性的关系。 4.掌握环烷烃的结构。 5.了解秸类和笛族化合物 二.本章节重点、难点 脂环经的定义和命名、脂环烃的结构和性质、环的大小与环张力、稳定性的关系、脂环 烃的顺反异构,环己烷及取代环己烷的构象分析(船式和椅式、a键和:健)、其它环 烷烃的结构。 三。教学内容: 5.1脂环烃的定义和命名 5.1.1脂环烃的定义 在结构上具有环状碳骨架,而性质上和脂肪烃相似的烃类,叫做脂环烃。脂环烃的分类 如下所示: 饱和脂环烃,环烷烃如:O了出口等 脂环烃 环烯烃如:◇○○ 不饱和脂环烃 环炔烃 按环的大小又将脂环烃分为:小环(3一4元)脂环烃:普通环(5一7元)胎环烃 中环(8~12元)脂环烃和大环(十二碳以上)脂环烃。 按环的多少可将脂环分为:单环化合物;多环(桥环、螺环)化合物
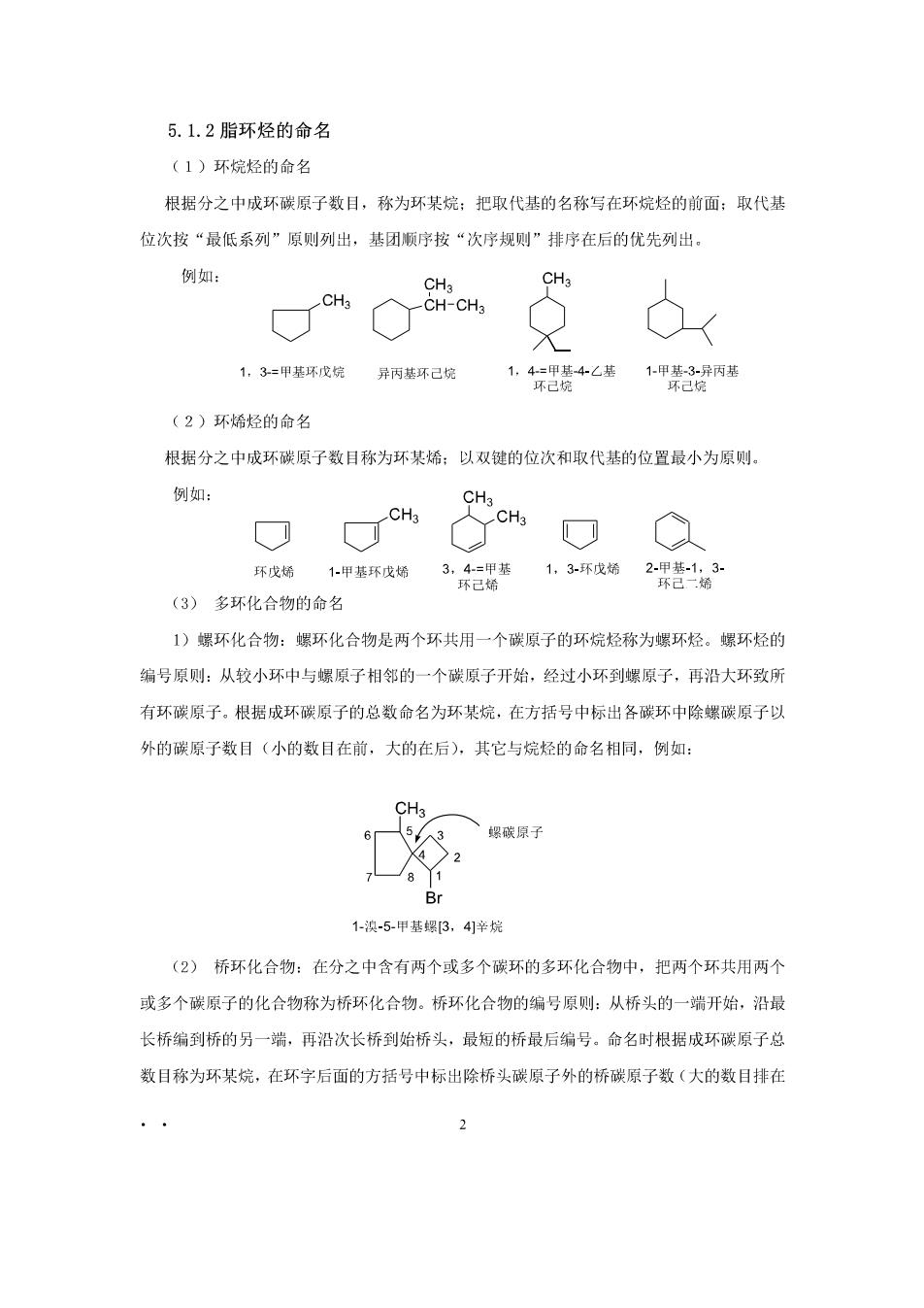
5.1.2脂环烃的命名 (1)环烷烃的命名 根据分之中成环碳原子数目,称为环某烷:把取代基的名称写在环烷烃的前面:取代基 位次按“最低系列”原则列出,基团顺序按“次序规则”排序在后的优先列出 例如: CH3 O 1,3=甲基环戊烷 异丙基环己烷 (2)环烯烃的命名 根据分之中成环碳原子数目称为环某烯:以双键的位次和取代基的位置最小为原则。 例如: 环成烯 (3)多环化合物的命名 1)螺环化合物:螺环化合物是两个环共用一个碳原子的环烷烃称为螺环烃。螺环烃的 编号原则:从较小环中与螺原子相邻的一个碳原子开始,经过小环到螺原子,再沿大环致所 有环碳原子。根据成环碳原子的总数命名为环某烷,在方括号中标出各碳环中除螺碳原子以 外的碳原子数目(小的数目在前,大的在后),其它与烷烃的命名相同,例如: CH3 65人3 螺碳原子 》2 Br 1-澳-5-甲基螺即3,41辛烷 (2)桥环化合物:在分之中含有两个或多个碳环的多环化合物中,把两个环共用两个 或多个碳原子的化合物称为桥环化合物。桥环化合物的编号原则:从桥头的一端开始,沿最 长桥编到桥的另一端,再沿次长桥到始桥头,最短的桥最后编号。命名时根据成环碳原子总 数目称为环某烷,在环字后面的方括号中标出除桥头碳原子外的桥碳原子数(大的数目排在
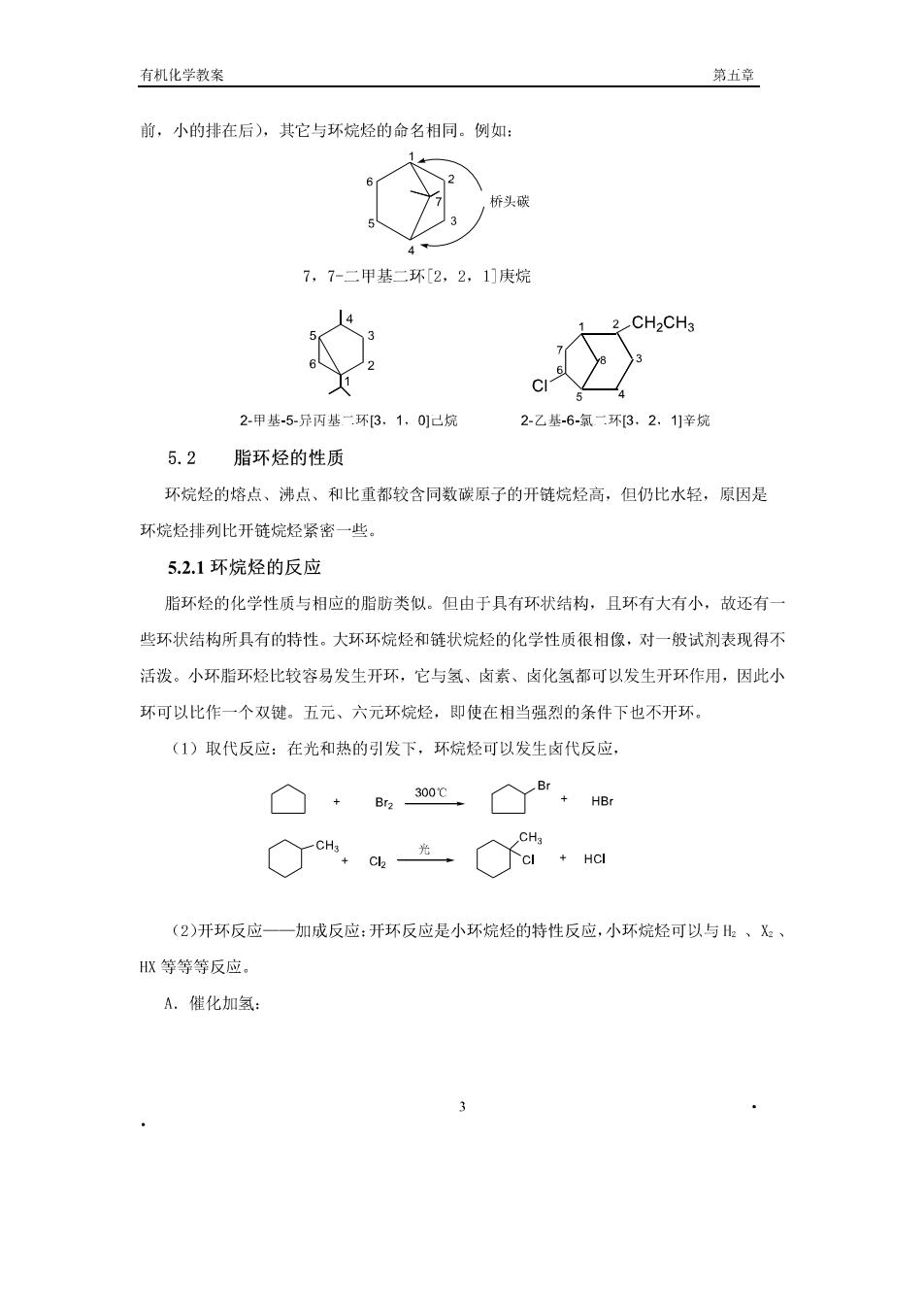
有机化学教案 第章 前,小的挂在后),其它与环烷烃的命名相同。例如: ,桥头 7,7-二甲基二环2,2,1]庚烷 4 2CH2CH3 2-甲基-5-异丙基一环3.1,01已烷 2乙基-6-氣二环3,2、1辛烷 5.2脂环烃的性质 环烷烃的熔点、沸点、和比重都较含同数碳原子的开链烷烃高,但仍比水轻,原因是 环烷烃排列比开链烷烃紧密一些。 5.2.1环烷烃的反应 脂环烃的化学性质与相应的脂肪类似。但由于具有环状结构,且环有大有小,故还有一 些环状结构所具有的特性。大环环烷烃和链状烷烃的化学性质很相像,对一般试剂表现得不 活泼。小环脂环烃比较容易发生开环,它与氢、卤素、卤化氢都可以发生开环作用,因此小 环可以比作一个双键。五元、六元环烷烃,即使在相当强烈的条件下也不开环。 (1)取代反应:在光和热的引发下,环烷烃可以发生卤代反应, □·30oc8re, (2)开环反应—加成反应:开环反应是小环烷烃的特性反应,小环烷烃可以与、飞、 HR等等等反应。 A.催化加氢

口·此00 CHaCH2CH2CHa D·此oe CHCH2CH2CH2CH3 由上可以看出,三元环和四元环是不太稳定的。 (2)加卤素或卤化氧 +8ycu一gt-c8t CH、 广加成反应 CHa H-C-CH, 入十B心©,公一不起加成,岸是散代反 与溴水的加成反应可以用来鉴定小环烷烃 人·e一oH-88c CHs CHs Br CHa CHa 人+0,一c% CHs CHs 一CH-CHg OSO.H (3)氧化反应:在常温下,环烷烃与一般氧化剂都不起反应,但在加热时,可以与强氧 化剂作用,或在催化剂的作用下,与空气氧化。例如:用热硝酸氧化环已烷,则环被破坏, 生成二元酸。 5.2环烯烃和环二烯烃的反应 (1)环烯烃的加成反应 Br2/C C14 (卡)14加成 1.2-加成
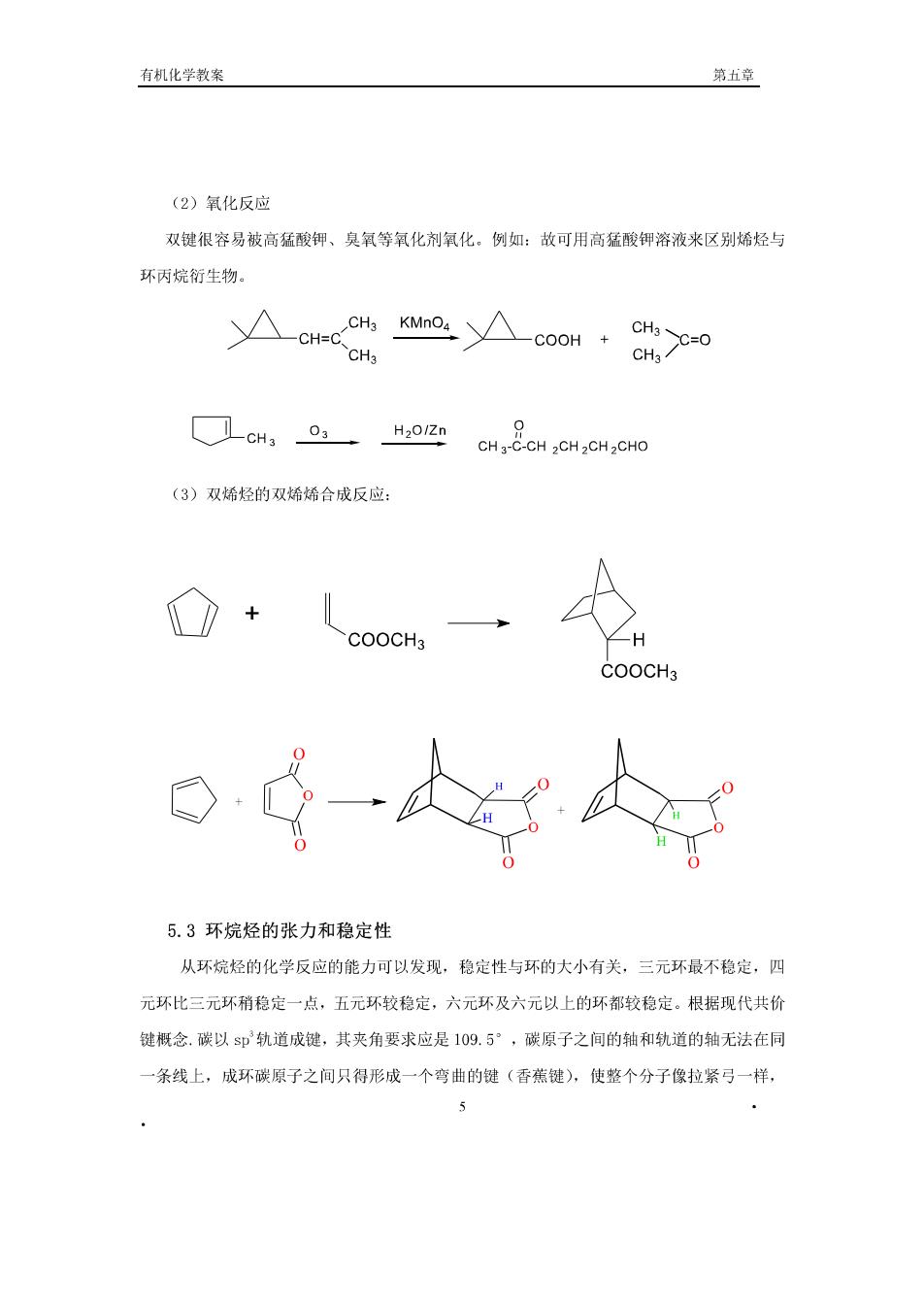
有机化学教案 第章 (2)氧化反应 双键很容易被高猛酸钾、臭氧等氧化剂氧化。例如:故可用高猛酸钾溶液来区别烯烃与 环丙烷衍生物。 △coo·8h0 CH3 CH23H201Zn CH2CH CH CH2CHO (3)双烯烃的双烯烯合成反应: + COOCH3 5.3环烷烃的张力和稳定性 从环烷烃的化学反应的能力可以发现,稳定性与环的大小有关,三元环最不稳定,四 元环比三元环稍稳定一点,五元环较稳定,六元环及六元以上的环都较稳定。根据现代共价 键概念.碳以$即轨道成键,其夹角要求应是109.5°,碳原子之间的轴和轨道的轴无法在同 一条线上,成环碳原子之间只得形成一个弯曲的键(香蕉键),使整个分子像拉紧弓一样

有张力,张力可分为角张力和扭张力两种形式。 (1)角张力:由于碳原子采取SP杂化方式,当碳与其他原子连结时,任何两个键之 间夹角都为四面体角(109.5”),键角与109.5相差越大越不稳定。环丙烷是三角形,夹角 是60。环中每个碳上的两C-C键,不能是109°28',必须压缩到60°,这样与正常的四 面体键角(109.5°)有了一定的偏差,引起了分子的张力,力图恢复正常键角,这种张力 称做角张力,这样的环叫做"张力环”,有张力的环是不稳定的,为了减小张力,有张力的 环有生成更稳定的开毓化合物的倾向,所以可以进行加成反应。在环丁烷分子中,电子云的 重叠不能沿者即轨道轴对称重叠,只能偏离键轴一定的角度以弯曲键侧面重叠,形成弯曲 键(香焦键),其键角为105.5°,因键角要从109.5°压缩到105.5°,故环丁烷也有一定 的张力(角张力),所以环丁烷不稳定。 (2)扭张力:除了角张力以外,环丙烷分子中还存在者另一种张力(扭张力)。由于环 中三个碳位于同一平面,相邻的C-H键互相处于重叠式构象,有旋转成交叉式的趋向,这样 分子中也存在张力,这种张力称为扭转张力。环丙烷的总张力能为11KJ/ol。 从热化学实验测得:含碳原子数不同的环烷烃中,每个C-的燃烧热是不同的。三元 环:697:四元环:6S6:五元环:664:六元环:659(kJ/mol),它的大小反映出分子内能 的高低。根据燃烧热数据可看出,从环丙烷到环己烷,每个CH的燃烧热量逐渐降低,说明 环愈小内能愈大,愈不稳定,六元环以上的中环和大环,每个的燃烧热差不多等于 661KJ/ol,说明大环是稳定的,即无张力。近年来制备了很多大环化合物,它们都是稳定 的。经X一射线分析,分子是皱折形,碳原子不在同一平面内,碳原子之间的键角接近正常 键角109,5°。 5.4环烷烃的结构 从环烷烃的化学性质可以看出,环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己 烷以上的大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。 5.4.1环丙烷的结构 现代物理方法测定,环丙烷分子中:键角C-C-C=105.5°:H-C-H=114°。所 以环丙烷分子中碳原子之间的s即'杂化轨道是以弯曲键(香蕉键)的形式相互交盖的如下图 所示: 6
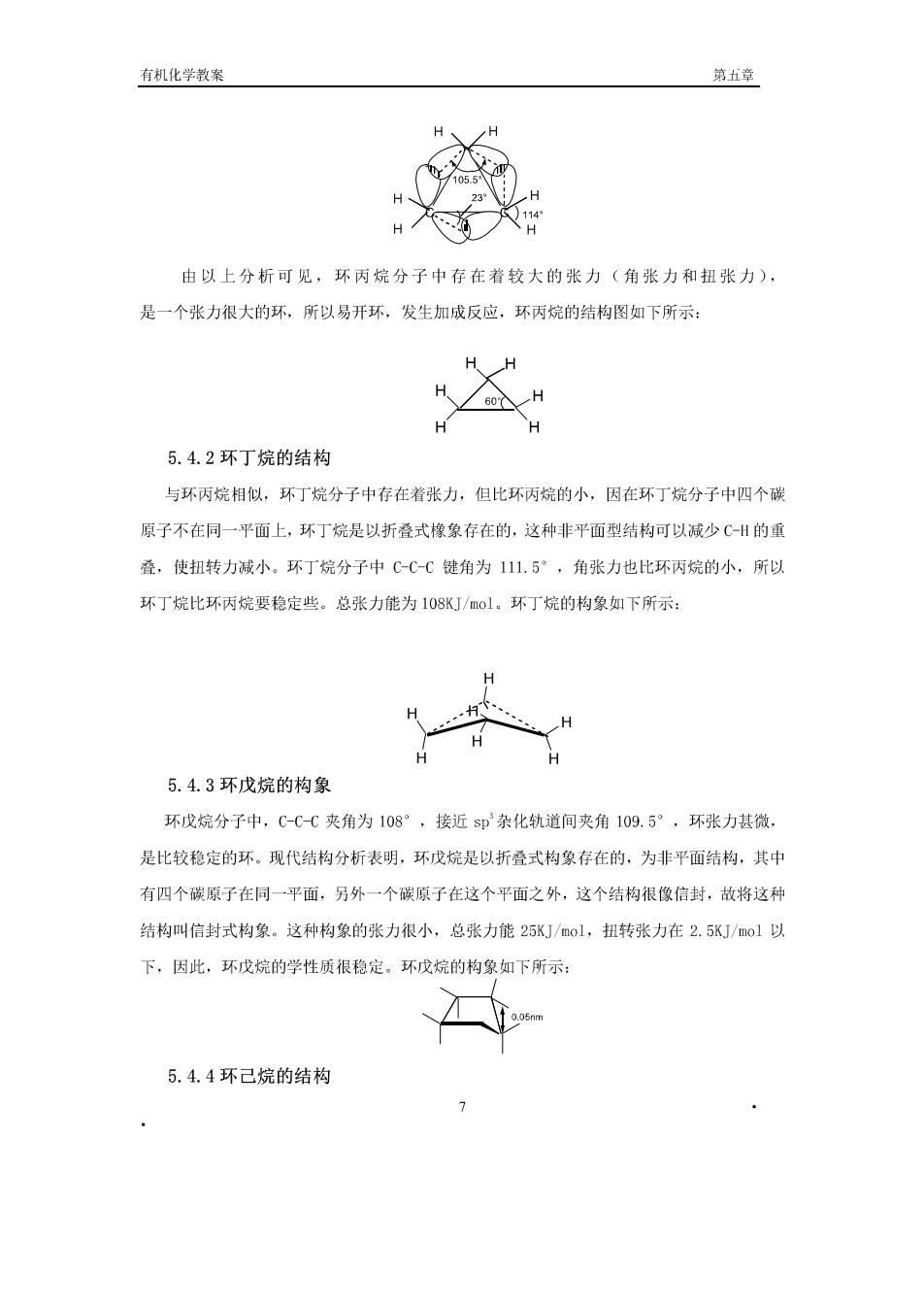
有机化学教案 第五章 由以上分析可见,环丙烷分子中存在着较大的张力(角张力和扭张力), 是一个张力很大的环,所以易开环,发生加成反应,环丙烷的结构图如下所示: H@×H 5.4.2环丁烷的结构 与环丙烷相似,环丁烷分子中存在若张力,但比环丙烷的小,因在环丁烷分子中四个碳 原子不在同一平面上,环丁烷是以折叠式橡象存在的,这种非平面型结构可以减少CH的重 叠,使扭转力减小。环丁烷分子中C-C-C链角为111,5°,角张力也比环丙烷的小,所以 环丁烷比环丙烷要稳定些。总张力能为108KJ/mol。环丁烷的构象如下所示: 5.4.3环戊烷的构象 环戊烷分子中,C-C-C夹角为108°,接近$即杂化轨道间夹角109.5°,环张力甚微, 是比较稳定的环。现代结构分析表明,环成烷是以折叠式构象存在的,为非平面结构,其中 有四个碳原子在同一平面,另外一个碳原子在这个平面之外,这个结构很像信封,故将这科 结构叫信封式构象。这种构象的张力很小,总张力能25KJ/mol,扭转张力在2.5KJ/ol以 下,因此,环戊烷的学性质很稳定。环戊烷的构象如下所示: 5.4.4环己烷的结构
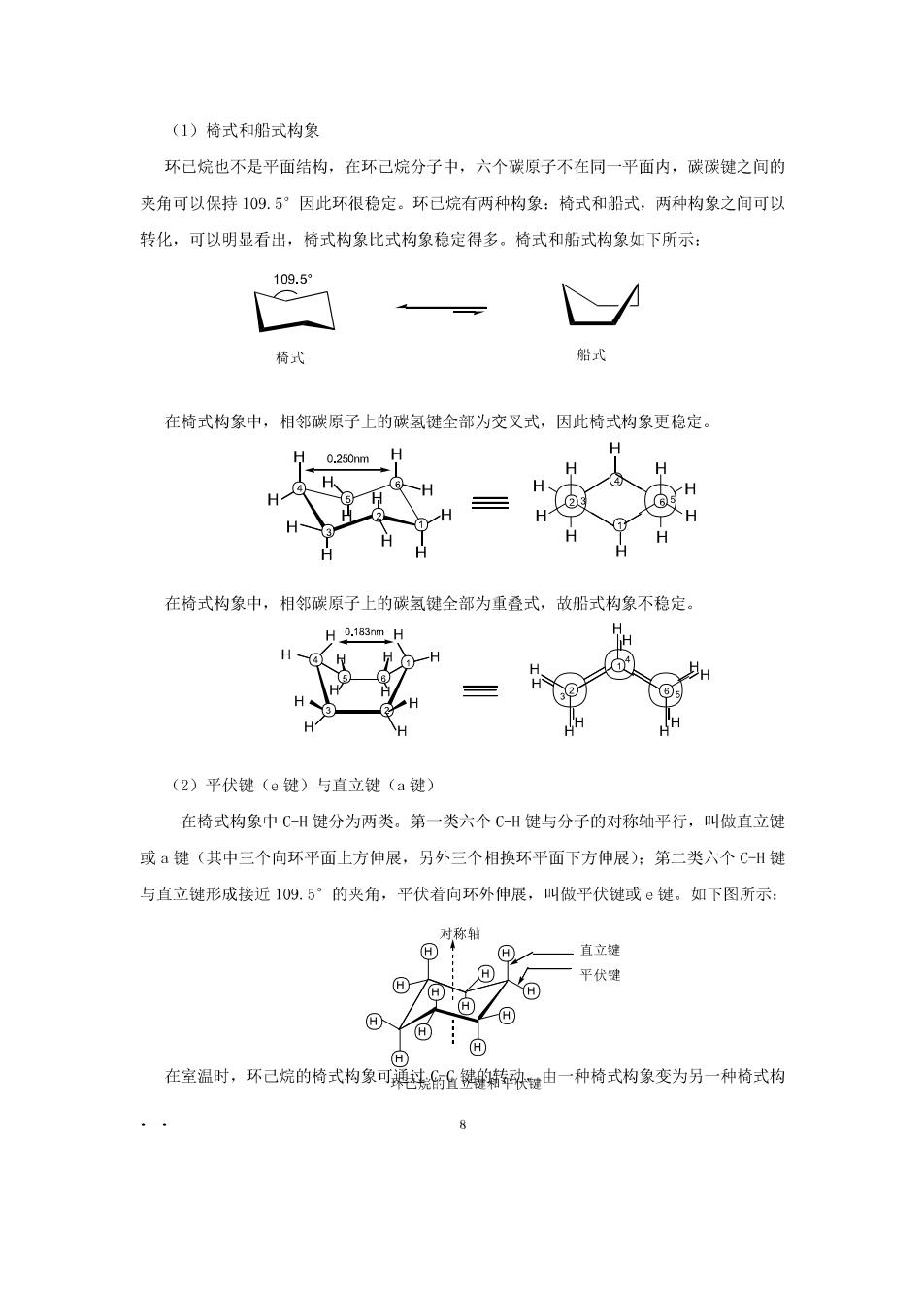
(1)椅式和船式构象 环已烷也不是平面结构,在环己烷分子中,六个碳原子不在同一平面内,碳碳键之间的 夹角可以保持109.5”因此环很稳定。环已烷有两种构象:椅式和船式,两种构象之间可以 转化,可以明显看出,椅式构象比式构象稳定得多。椅式和船式构象如下所示 109.5° 待北 船式 在格式构象中,相邻碳原子上的碳氢键全部为交叉式,因此椅式构象更稳定。 = 在楠式构象中,相邻碳原子上的碳氢键全部为重叠式,故船式构象不稳定 0.183m (2)平伏键(e键)与直立键(a键) 在椅式构象中C-H键分为两类。第一类六个C-H键与分子的对称轴平行,叫做直立键 或键(其中三个向环平面上方伸展,另外三个相换环平面下方伸展):第二类六个C-H键 与直立键形成接近109.5°的夹角,平伏若向环外伸展,叫做平伏键或©键。如下图所示 一平伏键 在室温时。环已烷的格式构象可鼎储由一种传式构象变为另-件特式构

有机化学教案 第五章 象,在互相转变中,原来的a键变成了e键,而原来的e键变成了a键。如下图所示: 对称轴 回!回一a健 对称轴 一a继 一e健 一e键 回 当六个碳原子上连的都是氧时,两种构象是同一构象。连有不同基团时,则构象不同。 (3)取代环己烷的构象 1)一元取代环己烷的构象 一元取代环己烷中,取代基可占据a键,也可占据e链,由于a键取代基结构中的原 子间斥力比e键取代基的大,所以占据e键的构象更稳定。例如:甲基占据e键比甲基占据 a键的构象更稳定,内能小75.3kJ/ol在平衡系统中占93%。如下所示: 3 在叔丁基环已烷中,叔丁基占据e键比叔丁基占据a键的构象更加稳定,在平衡系统 中占99%以上。如下所示: CH CH 2)二元取代环己烷的构象
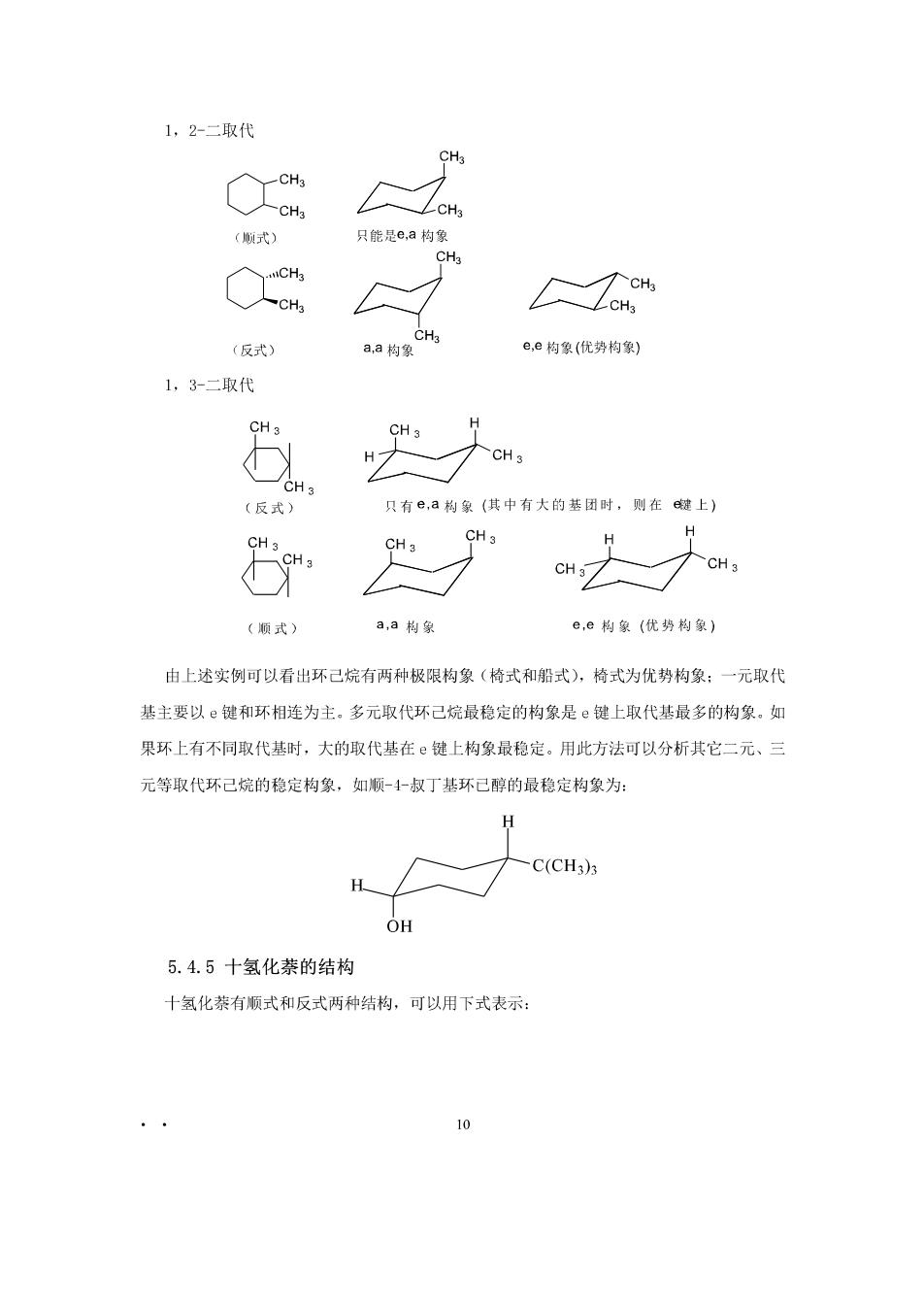
1,2-二取代 式) 只能是e,a构象 CH Lo (反式) a,a均g e,e构象(优势构象) 1,3二取代 H CH 只有©,a构象(供中有大的基团时,则在威上) (顺式) a,a构象 e,e构象(优势构象) 由上述实例可以看出环己烷有两种极限构象(椅式和船式),椅式为优势构象:一元取代 基主要以e键和环相连为主,多元取代环己烷最稳定的构象是ε键上取代基最多的构象.如 果环上有不同取代基时,大的取代基在©键上构象最稳定。用此方法可以分析其它二元、三 元等取代环己烷的稳定构象,如顺-↓叔丁基环已醇的最稳定构象为: H -C(CH3)3 5.4.5十氢化萘的结构 十氢化恭有顺式和反式两种结构,可以用下式表示: 10