
第十五章硝基化合物及胺 学习目的及基本要求 1,握硝基化合物及胺的分类、命名法和结构。 2.掌握胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规 则。 3.掌握硝基化合物的性质。 4.理解三种分子重排反应的实例 5。了解腈和异腈的性质。 6.了解硝基化合物的性质、制法以及重要代表物。 7.了解硝基化合物及胺的制法。 8.了解相转移原理作为有机合成新方法的原因。 9.了解表面活性剂。 重点:胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。 难点:分子重排反应 教学方法采用多媒体课件、模型和板书相结合的课堂讲授方法 引言: 分子中含有CN键的有机化合物称为含氨有机化合物。含氢有机化合物种类很多,本章 简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。 硝基化合物 在有机化合物中,除C、H、O三种元素外,N是第四种常见元素。有机含氨化合物的 种类很多,范国也很广,它们的结构特征是含有碳氮键(C-N、C=N、C三N),有的还含有 NN、N=N、N-N、NO,N-O及NH键等, 分子中含有一NO2官能团的化合物统称为硝基化合物.硝基化合物可看成是烃分子中的 一个或几个氢原子被硝基取代的结果,硝基化合物一般写为RNO2,A-NO2,不能写成 R-ONO(R-ONO表示硝酸酯)
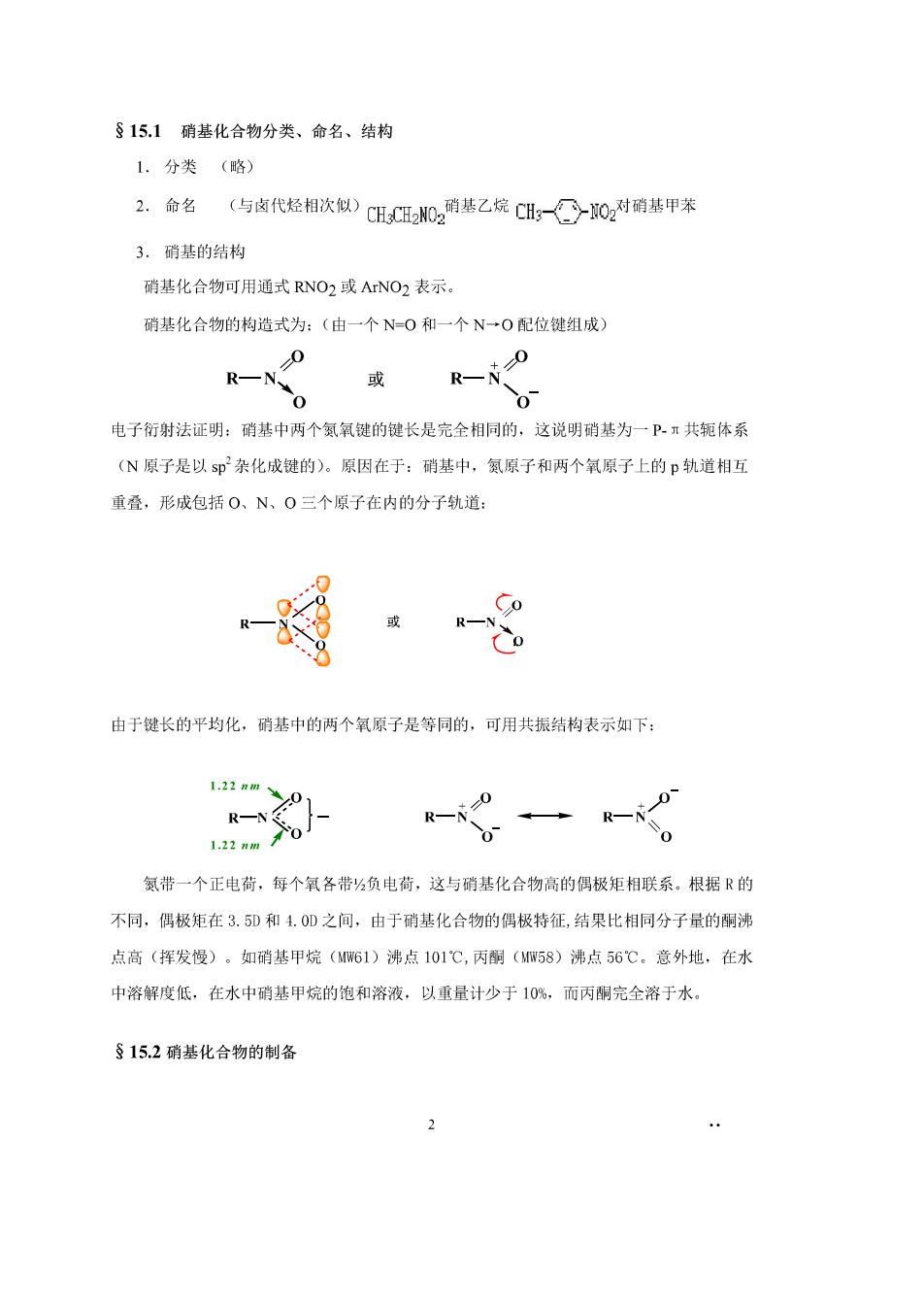
§15.1硝基化合物分类、命名、结构 1.分类(略) 2.命名 (与卤代烃相次似)CHCN02南基乙烷CHg-○02对消装甲苯 3.硝基的结构 硝基化合物可用通式RNO2或ANO2表示。 硝基化合物的构造式为:(由一个N=O和一个N一O配位键组成) 0 R一N、 0 0 电子衍射法证明:硝基中两个氨氧键的键长是完全相同的,这说明硝基为一Pπ共轭体系 (N原子是以sp杂化成键的)。原因在于:硝基中,氮原子和两个氧原子上的p轨道相互 重叠,形成包括O、N、0三个原子在内的分子轨道: 或R一 (o 由于键长的平均化,硝基中的两个氧原子是等同的,可用共振结构表示如下: 1:22nm、 0 R一N 1,22m0 氨带一个正电荷,每个氧各带⅓负电荷,这与硝基化合物高的偶极矩相联系。根据R的 不同,偶极矩在3.D和4.0D之间,由于硝基化合物的偶极特征,结果比相同分子最的酮沸 点高(挥发慢)。如硝基甲烷(WG1)沸点101℃,丙酮(WW58)沸点56℃,意外地,在水 中溶解度低,在水中硝基甲烷的饱和溶液,以重量计少于10%,而丙陶完全溶于水 §15.2硝基化合物的制备
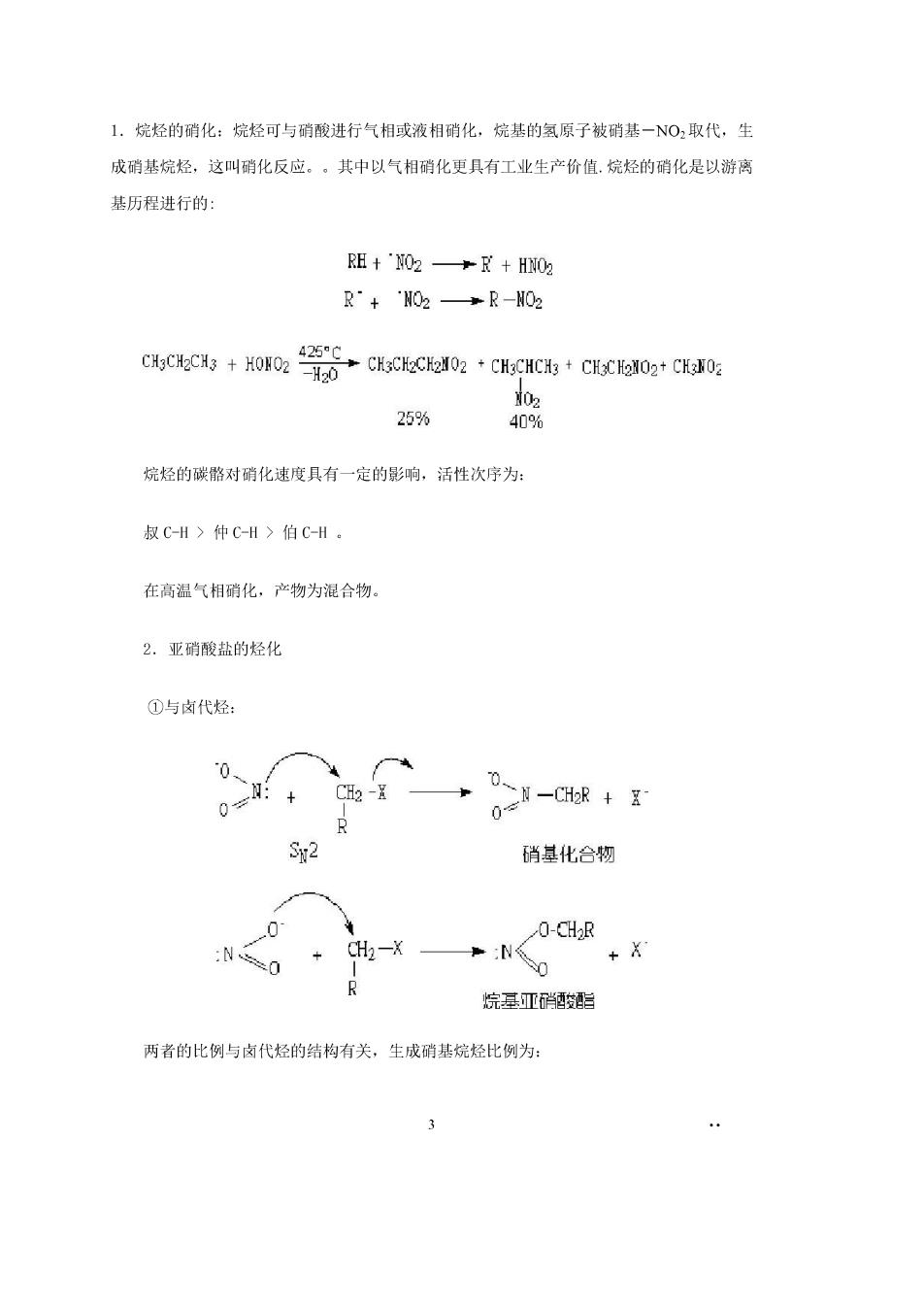
L.烷烃的硝化:烷烃可与硝酸进行气相或液相硝化,烷基的氢原子被硝基一O,取代,生 成硝基烷烃,这叫硝化反应,。其中以气相硝化更具有工业生产价值.烷烃的硝化是以游离 基历程进行的 R阻+02→+H02 R”+NO2→R-02 c6C+02器6ce0:·0gc+GEo0grG 25% 409% 烷烃的碳骼对硝化速度具有一定的影响,活性次序为: 叔C-H>仲C-H>伯C-H. 在高温气相硝化,产物为混合物 2.亚硝酸盐的烃化 ①与肉代烃 0:+ C- 0 R 硝基化合物 0 0-CH2R :CHa-X + R 烷基亚硝贷酯 两者的比例与卤代烃的结构有关,生成硝基烷烃比例为: 3

伯卤代烃)仲卤代烃)叔卤代烃 肉代烃中肉素敲取代的难易是:I>Br>CI>F 1卤代烃与亚硝酸银的反应: CHa(CH2)6CH2I+AgNO2-CH3(CH2)6CH2NO2+CH3(CH2)60NO B3% 11第 ⅱ卤代烷与亚硝酸锂(钠、钾)反应 0 )210.,r-、 R-CH2-NOz R >60% 实际上硝基化合物和亚硝酸酯两者同时生成,在DWF和DMS0中,硝基化合物为主要产 物。所以,这个反应是制备脂肪和脂环族硝基化合物的简单有效方法,这个反应能进行的 关键是亚硝酸碱金属盐和卤代烷都有一定量溶解在溶剂中,常用溶剂为D、DMS0。 ②与a-氯代羧酸 c1w1,ae0a60n二gc 作火箭魅料 C1-CH-C02H NaNO2ACH3CH2N02 NaCl +C02 CH3 3芳烃的硝化: ·o速0+c 5060℃ §153硝基化合物的物理性质和光谱性质

1.物理性质: 脂肪族硝基化合物多数是油状液体,芳香族硝基化合物除了硝基苯是高沸点液体外,其 余多是淡黄色固体,有苦仁气味,味苦。不溶于水,溶于有机溶剂和浓疏酸(形成盐), 硝基具有强极性,所以硝基化合物是极性分子,有较高的沸点和密度。随者分子中硝基 数目的增加,其培点、沸点和密度增大、苦味增加,对热稳定性减少,受热易分解爆炸(如 TNT是强烈的炸药). 多数硝基化合物有毒,在贮存和使用硝基化合物时应注意。 1R:基化合物0硝(g一)有两个强吸收。 0. 0 0 对称件缩振动181255cr反对称伸缩振动(16551510cm1 脂肪族硝基化合物的这两个强峰分别位于-1560cm和-1350cm',其中反对称伸展振 动峰比对称伸展振动峰强。这两个峰的位置将受碳原子上取代基电负性和a,B不饱和 键共轭效应的影响。芳香硝基物的0,反对称伸展振动峰和对称伸展振动峰分别在 1550-1510cm和1365-1335cm'处,和脂肪硝基物相反,其对称伸展振动峰较反对称伸 展振动峰强些,并且吸收峰位置受苯环上取代基的影响。大多数芳香硝基化合物在850或 750cm附近出现吸收谱带 §15.4硝基化合物的化学性质 15.4.1酸性 脂肪族硝基化合物中,硝基为强吸电子基,ā一氢受硝基的影响,较为活泼,可发生类 似酮-烯醇互变异构,从而具有一定的酸性

酮式(硝基式) 烯醇式(假酸式) 烯醇式中连在氧原子上的氢相当活泼,反陕了分子的酸性,称假酸式,其能与强碱成盐, 所以含有ū一氢硝基化合物可溶于氢氧化钠溶液中,无α一氧硝基化合物则不溶于氧氧化钠 溶液。利用这个性质,可鉴定是否含有á-氢的伯、仲消基化合物和叔硝基化合物, 例如硝基甲烷、硝基乙烷、硝基丙烷的pKa值分别为:10.2、8.5、7.8。 R-CH2-NO R-CH-N<OH NaOH I R-CH-NNa" 假酸式(主) 酸式(较少) 15,4.2与羧基化合物缩合 有αH的硝基化合物在碱性条件下能与某些基化合物起缩合反应。 O OH-R-C OH H R-CHa NO2 +R-CH -NO2二HeR-C=C-NO2 R”) .R (R) (RR H OH 其缩合过程是:硝基烷在碱的作用下脱去ā-H形成碳负离子,碳负离子再与羰基化合 物发生缩合反应。 6
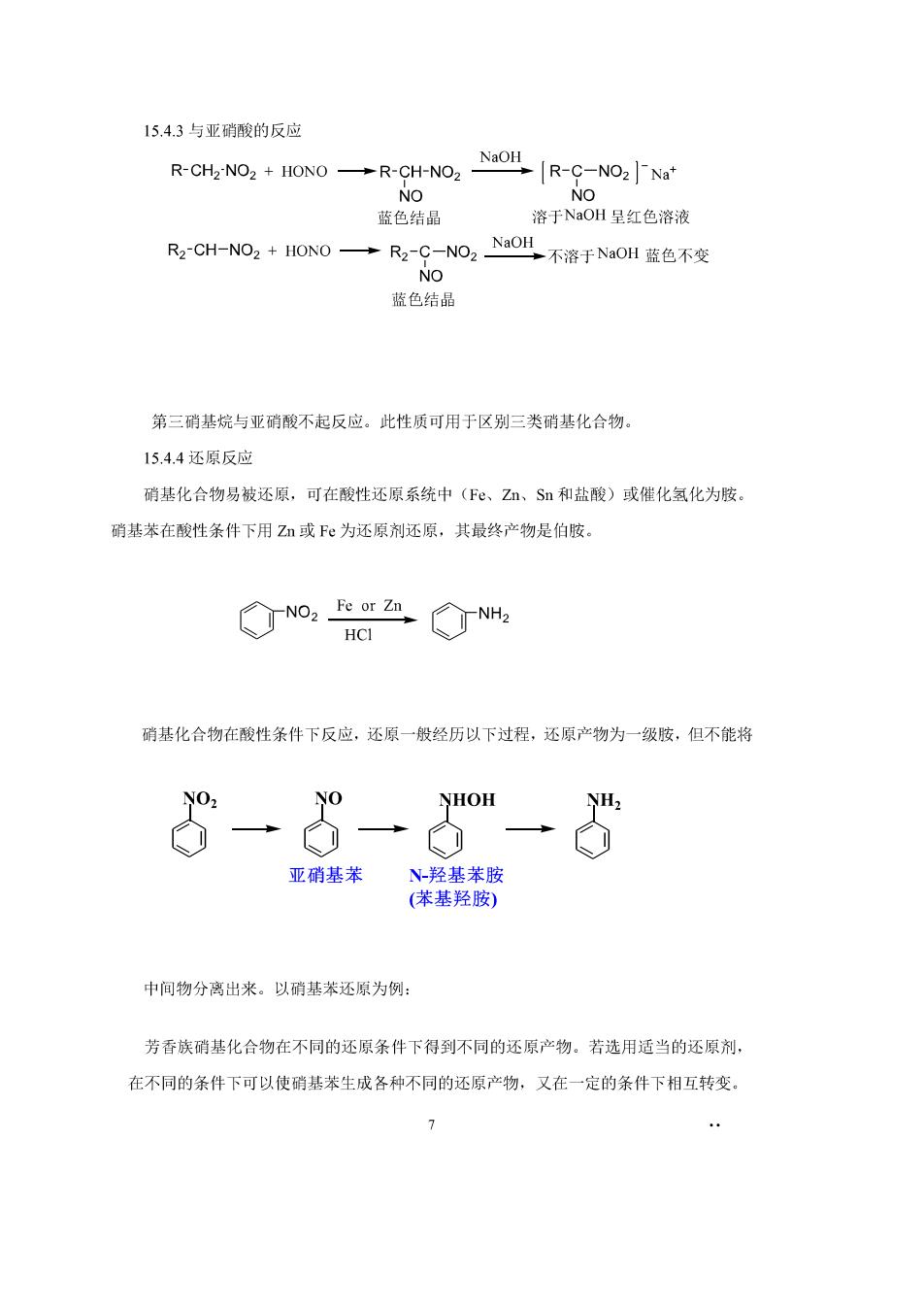
15.4.3与亚硝酸的反应 R-CH2-NO2 HONO -R-CH-NO2 o NOH R-C-NON 蓝色结晶 溶于NaOH呈红色溶液 R-CH-NO2+ION0→R-C-NO2aOI不溶于NaOH蓝色不变 NO 蓝色结晶 第三硝基烷与亚硝酸不起反应。此性质可用于区别三类硝基化合物。 15.4.4还原反应 硝基化合物易被还原,可在酸性还原系统中(F,Zm、Sn和盐酸)或催化化为胺 硝基苯在酸性条件下用Z或F心为还原剂还原,其最终产物是伯胺。 o:a☑N HCI 硝基化合物在酸性条件下反应,还原一般经历以下过程,还原产物为一级胺,但不能将 NO NHOH 三之00 亚硝基苯 N羟基苯胺 (苯基羟胺) 中间物分离出来。以硝基苯还原为例: 芳香族硝基化合物在不同的还原条件下得到不同的还原产物。若选用适当的还原剂, 在不同的条件下可以使硝基苯生成各种不同的还原产物,又在一定的条件下相互转变】 7

0 a8的:一O氧化偶氨幸 Fe.NaCL 偶氣苯 2a.ea0H,CN氢化偶氨苯 2n.盟CL→Ci 苯胲(h) 20→CN0 亚硝基苯 若选用适当的还原剂,可使硝基苯还原成各种不同的中间还原产物,这些中间产物又 在一定的条件下互相转化。见P4 154.5硝基对苯环上其它基闭的影响 硝基是吸电子基团,使苯环电子云密度降低,特别是硝基的邻对位电子云密度降低更 为显著,而间位的电子云密度相对较高。所以在芳环的亲电取代反应中,硝基是钝化芳环 的间位定位基。如果硝基苯邻对位连有其它基团,它们也要受到硝基的影响。 (1)硝基对芳环亲电取代反应的影响:硝基是间位定位基,因此,亲电取代反应主要发生 在间位,反应速度比苯慢。例如: N02 OBr O0, FeBr; +Br2 ◎0 95 +0(发烟)+浓S0: ○-NO2+H0 NO2 8

(2)硝基对苯环上邻、对位卤素的影响:在卤代苯分子中,由于卤原子与芳环的P-”共 轭效应,使卤原子与苯环碳原子结合得更加紧密,因此卤原子很不活泼。在一般条件下, 卤代苯不能发生亲核取代反应。例如在一般条件下氯苯很难和氢氧化钠作用,发生碱性水 解。但如果套氯苯分子中氧原子的怎对位以入猜基,由于弱韩的吸电子诱导效应和吸电 子共轭效Q漏基邻位或对位的电子云密然,从而使C-C1键极性增强,因此氯原子活 性增强,例如,邻或对硝基氯苯就容易水解,而且邻、对位硝基愈多,卤原子的活性愈强, 愈容易水解。例如: NaOH CI OH 10c NO2 NaHCO 100c (3)与硝基处于邻或对位的酚羟基或羧基的臀性增强,例如: 6 O k-88 72b0H 7.1600H 8.0c00H O ONO: O @02 0 pK=4.17 2.21 3.40 3.46 硝基的邻、对位碳原子的电子云密度低,受此影响,这两个碳原子上的羧基或羟基 的氢原子,其质子化倾向增强。间位碳原子的电子云密度也有降低,但比邻对位碳原子高

因此间位上的羧基或羟基的酸性虽有增强,但增强的程度较小。 显然,苯环上硝基愈多,则苯环上羟基或羧基的酸性愈强,例如2,+,6三硝基苯酚 的酸性己接近无机酸的水平。苦味酸的pK-0.38。 氨分子中的氢原子被一个或几个烃基取代后的化合物统称为胺。胺按氨原子连接的烃基 数目不同,可分为1°、2”、3”胺。 此外,还有一类相当于NH4CI一和NH4+OH一的化合物: NH4C”季铵盐 NH4OH季铵碱 §15.5胺的分类和命名与结构 1.分类 [ArNH R-NH,伯胺P胺)脂 芳】 RNH仲胺2°胺) NH→RN 叔胺G胺)J 胺 胺 ArNHR RNX季铵盐 ArNR2 RNOH季铵碱 2.命名(P6) 简单胺的命名是在烃基名称后加胺字,称为某胺。 复杂结构的胺是将氨基和烷基作为取代基来命名。 季铵盐或季铵的命名是将其石作铵的衍生物来命名。 3.胺的结构 1,2s2,2p,2g,2p 氮原子的电子结构为: 其中三个2印轨道都没有完全填满,可以成键。氨原子应为三价,且键角似乎应互为90”。 但实际上N原子和H原子或烷基形成的单键的键角为1O9··这就是说,N原子在成键时