
第十章醇和醚 一,学习目的和要求: L,掌握醇、醚的分类及其命名法。 2.掌握氢键对培点、沸点、水溶性、红外吸收峰位移等物理性质的影响。 3.掌握醇、醚的化学性质、碳正离子的重排。 上.理解醇和酰的结构特点。 5.理解B-消除E1、2历程,消除反应的立体化学特征 6.理解E1与SW1,2与S2之间的竞争及影响因素。 7.了解醇、醚的制备方法。 8.了解甲醇、乙醇、乙二醇和丙三醇的制法和用途 9.了解硫醇、硫醚的制法和用途。 10.了解乙酰、环氧乙烷的性质和用途。 1L.了解一般冠藤及相转移催化剂。 二.本章节重点、难点 醇、醚的化学性质、碳正离子的重挂,E1与Sl,E2与S2之间的竞争及影响因素。 引言 醇和醚都是烃的含氧衍生物,它们可以看作是水分子中的氢原子被烃基取代的化合物, H-O-H R-OH R-0-R 水 醇 醚 10.1醇的结构、分类和命名等 1.醇的结构 醇可以看成是烃分子中的氢原子被羟基(OH)取代后生成的衍生物(R-OH), G一即0原子为5杂化 R-C 由于在s即杂化轨道上有未共用电子对, 两对之间产生斥力,使得∠C0小于 109.5。 2.醇的分类 1

1)根据羟基所连碳原子种类分为:一级醇(伯醇)、二级醇(仲醇、三级醇(叔醇) 2)根据分子中烃基的类别分为:脂肪醇、脂环醇和芳香醇(芳环侧链有羟基的化合物, 羟基直接连在芳环上的不是醇而是酚)。 3)根据分子中所含羟基的数目分为: 元醇、二元醇和多元醇 两个羟基连在同一碳上的化合物不稳定,这种结构会自发失水,故同碳二醇不存在。另 外,烯醇是不稳定的,容易互变成为比较稳定的醛和酮,这在前面己讨论过。 3.醇的命名 1)俗名 如乙醇俗称酒精,丙三醇称为甘油等 2)简单的一元醇用习惯命名法命名。 例如: CH CH. cH-8Hc,oHct-oH○oH丁ceoH CHa 并丁醇 叔丁醇环已醇 3)系统命名法 结构比较复杂的醇,采用系统命名法。选择含有羟基的最长碳链为主链,以羟基的位置 最小编号,称为某醇。 O日 例如: CH-CH-CH-CH-CH-CHs 2甲基5-氯-3己醇 CI CH3-CH-CH2-CH=CH2 4-戊烯2醇 OH CH-CH-CHOH 3苯基-2-丙烯醇 1·苯基乙醇(a-苯乙醇) CH-CH.OH 2苯基乙醇邛~苯乙醇) 多元醇的命名,要选择含-O州尽可能多的碳链为主链,羟基的位次要标明。

例如: CH2-CHz-CH2 OHOH 1,3丙二醇 顺上甲基1,2-环己二醇 4.醇的物理性质 1.性状:(略) 2.沸点 1)比相应的烷经的沸点高100-120℃(形成分子间氢键的原因),如乙烷的沸点为 -88.6℃,而乙醇的沸点为78.3℃. 2)比分子量相近的烷烃的沸点高,如乙烷(分子量为30)的沸点为-88.6℃,甲醇(分子量 32)的沸点为64.9℃。 3)含支链的醇比直链醇的沸点低,如正丁醇(117.3)、异丁醇(108.4)、叔丁醇(882)。 3,溶解度: 甲、乙、丙醇与水以任意比混溶(与水形成氢键的原因):C4以上则随着碳链的增长溶 解度减小(烃基增大,其遮蔽作用增大,阻碍了醇羟基与水形成氢键):分子中羟基越多, 在水中的溶解度越大,沸点起高。如乙二醇(bp=197℃)、丙三醇(bp=290℃)可与水混 浴。 4.结晶醇的形成 低级醇能和一些无机盐(MgCl:、CaC2、CuSO:等)作用形成结品醇,亦称醇化物。 如:MgC2·6CHOH CaCl2·4C2H0H 不溶于有机溶剂,溶于水。 结品醇: CaC2·4CHOH 可用于除去有机物中的少量醇 5.醇的光谱性质 R:-0H未缔合的在3640-3610cm有尖峰 缔合的在3600-3200cm1宽峰 C-0吸收峰在1000-1200cm(1060-1030cm伯醇、1100cm仲醇、1140叔醇) 3

(CH3)2C-C(CH3)2 0-H0-H…0-H R -B 0 0 V(om320-2500cm分有很宽的吸收峰,分 V0w3400-3200cm分子间氢键 子内氢键 分子间氢健随着溶液逐渐稀释而变弱,当溶液变得极稀时,vO州回到正常值。而分子 内氢键无此现象。(峰位不受影响)借此可区别分子间氢键与分子内氢键。 一些活泼氢的化学位移变化很大,难以确认。可以在测得通常谱图后的样品中加两滴重 水D,0,摇动片刻,在同样仪器条件下,再绘制一张重水交换的谱图。将两谱图进行比较, 即可以指认活泼氧。一般来说,重水交换后活泼氢信号大为减弱或消失。但酰胺质子因交换 慢不易消失,形成分子内氢键的活泼氢也难消失。 NMR:-OH8值1-5.5范围内。 -OH活泼氢的化学位移与溶剂、溶液温度浓度和形成氢键都有很大关系。活泼氢的化学 位移因而在一个比较宽的范围内变化。 活泼氢的峰形与活泼氢之间交换速度有密切关系。如果交换速度快,即活泼氢在0原 子上停留时间比11000秒短很多,它就不能感觉到邻近质子两种自旋态的不同影响,而是 处于一种平均环境之中。邻近质子不对活泼氢峰形产生裂分,故显示单峰。反过来也一样, 邻近质子也只能处于活泼氧的两自旋态平均环境之中,故活泼氧也不对邻近质子产生蜂的裂 分。 质子互换的速率可被所用的溶剂减慢,如用(CD)S0时,可以看到复杂的信号分裂形 式。如非常干燥和高度纯的乙醇样品呈现出羟基的自旋一自旋分裂信号,表现为三重峰。邻 近的亚甲基,由于同时与甲基质子和羟基质子偶合,也表现为双四重峰。 10.2醇的制备 1.由烯烃制备 1)烯烃的水合(略) 2)硼氢化氧化反应
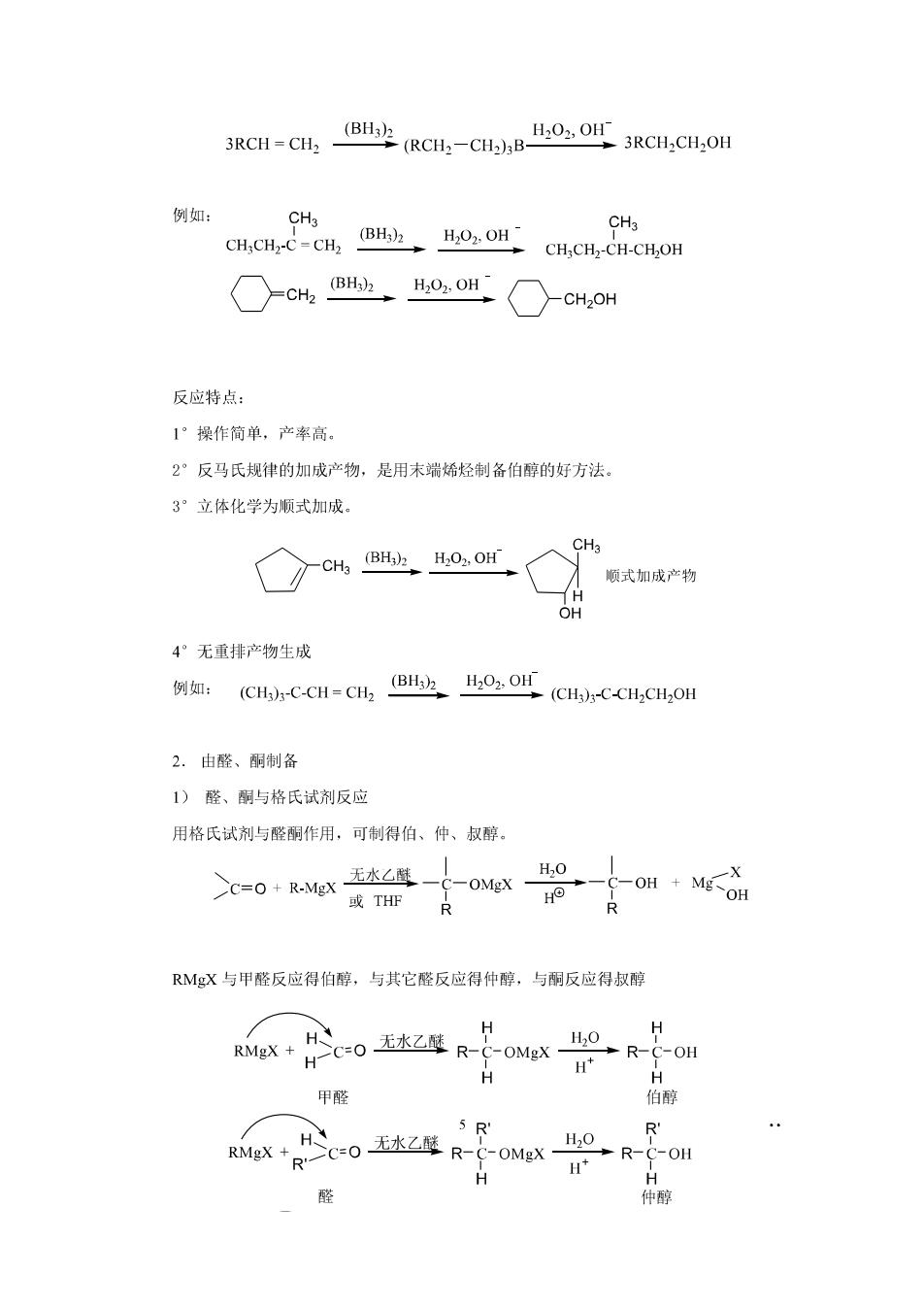
3RCH-CH (RCH-CH),B 3RCH.CH.OH 例如: CH.CH.CH O CH.CH,CHCH.OH CH3 ○c@ho,oH○cHoH 反应特点: 1°操作简单,产率高。 2°反马氏规律的加成产物,是用末端烯烃制备伯醇的好方法。 3°立体化学为顺式加成 ☑coor CHa 顺式加成产物 4°无重排产物生成 例如:(CHC-CH=cH,Bor(CH-C-CH,CH,OH 2.由醛、酮制备 1)醛、酮与格氏试剂反应 用格氏试剂与醛酮作用,可制得伯、仲、叔醇。 R R RMgX与甲醛反应得伯醇,与其它醛反应得仲醇,与相反应得叔醇 RMgX:H H 10-R-C-OH c04 R-OMX o H H 甲醛 伯醇 5R' eX+R"C-0五Z4 R-oMex H HO R-C-OH H* 仲

应注意:1”反应的第一步要绝对无水,因此两步一定要分开 2°制格氏试剂的底物应没有易与格氏试剂反应的基团。 2)醛、酮的还原 醛、酮分子中的羰基用还原剂(NaBH4,LiAH4)还原或催化加氢可还原为醇。 例如: 85% H,0 87% 不饱和醛、酮还原时,若要保存双健,则应选用特定还原剂。见P 3.由卤代烃水解 此法只适应在相应的卤代烃比醇容易得到的情况时采用。 CH2-CHCHCI H2O NaCO,CH.-CHCH.OH HCI CHGI Nuo阳+BOCH.OH 00 Br 10.3醇的化学性质 醇的化学性质主要由羟基官能闭所决定,同时也受到烃基的一定影响,从化学键米看 反应的部位有COH、OH、和C一H. R- 48 片酸性,生成酯 氧化反应形成C+,发生取代及消除反应

分子中的C一0键和0一H键都是极性键,因而醇分子中有两个反应部位。又由于受C 一O键极性的影响,使得H具有一定的活性,所以醇的反应都发生在这三个部位上。 1.与活泼金属的反应 CH,CH2OH Na →CH,CH,ONa+1/2H2 粘糊固体(溶于过量乙醇中》 N与醇的反应比与水的反应缓慢的多,反应所生成的热量不足以使氧气自燃,故常利 用醇与Na的反应销毁残余的金属钠,而不发生燃烧和燥炸。 CH:CH,O°的碱性比OH强,所以醇钠极易水解。 CH;CH2ONa H20 CH;CH2OH NaOH 较强成 较强酸 较弱酸较弱碱 醇的反应活性:CH,OH)伯醇(乙醇)>仲醇)叔醇 pKa15.09 15.93 >19 醇钠(RON)是有机合成中常用的碱性试剂。金属镁、铝也可与醇作用生成醇镁、醇铝。 CH3 CH3 6 CHs-CH-OH 2Al- →2CH,-CHO)AN+3H 还原剂 有机合成中常用的试剂 2.与氢卤酸反应(制卤代烃的重要方法) R-OH HX →R-X+H20 1)反应速度与氢卤酸的活性和醇的结构有关。 HX的反应活性: H>HBr〉HCI 创知a.Ct.CH,CHoH+H6△CHCHCH.CH+O HB CH,CH.CH.CH.Br+H.O +HCI ZnCh CH,CH.CH.CH,CI+HO

醇的活性次序:烯丙式醇>叔醇>仲醇〉伯醇>CH,OH 例如,醇与卢卡斯(Lucas)试剂(浓盐酸和无水氯化锌)的反应: CHs H(浓H+无水2aCcH一8cl+H0 CH3 CH 室温 CHa 1min钟混浊,放置分层 CH,CH,GCH卢断达剂CHCH,CHC+HO OH 室温 10mn钟混浊,放置分层 CH,C,CH,CH,OH卢卡斯试剂CH,CH,CH,CH,C+,0 室温 放置一小时也不反应(混浊) 加热才起反应(先混浊,后分层) Ls试剂可用于区别伯、仲、叔醇,但一般仅适用于3一6个碳原子的醇。 原因:1一2个碳的产物(卤代烷)的沸点低,易挥发。 大于6个碳的醇(卡醇除外)不溶于卢卡斯试剂,易混淆实验现象 2)醇与HX的反应为亲核取代反应,伯醇为S2历程,叔醇、烯丙醇为S、1历程 仲醇多为Sx1历程。 3)B位上有支链的伯醇、仲醇与HX的反应常有重排产物生成。见P5 例如 CHa CH3 CH CH2CHg 重样产物(主要产物 原因:反应是以S、1历程进行的,见P26 这类重排反应称为瓦格涅尔-麦尔外因(gmer-Meerwein)重排,是碳正离子的重排 3.与卤化磷和二氯亚砜反应 3ROH PX3(P+X2) →3RX+POHg X=Br、I(制备澳代或碘代烃) ROH+PC,→R-CI+POC,+HC↑】 制氯代短 ROH+SOC→R-CI+SOf+HCI↑ 此反应产物纯净

4.与酸反应(成酯反应) 1)与无机酸反应 醇与含氧无机酸硫酸、硝酸、磷酸反应生成无机酸酯。 CHCH,OH +HOSO,OH CH;CH2OSO2OH H2O 硫酸氢乙酯(酸性酯)》 CH,CH,OSO,OH减压蒸馏 (CH:CH,O)SO,HSO 硫酸二乙酯《中性酯) CH OSO,OCH CHCH2OSO2OCH2CH: 有机合成中的烷基化剂,有剧毒 高级醇的硫酸酯是常用的合成洗涤剂之一。如C1H,OSO:ONa(十二烷基磺酸钠) CH2-OH CH2-ONO2 CH-OH 3HNO;- CH-ONO2 +3H20 三硝酸甘油酯 可作炸药 CH2-OH CHzONO2 3C4H,OH P=0(COP=0+3H,0 ho 磷酸三丁陷(作茶取剂,增塑剂) )与有机酸反应 R.OH+CHC0OHCH,C0OR+H,0(见第十三章 5.脱水反应 醇与催化剂共热即发生脱水反应,随反应条件而异可发生分子内或分子间的脱水反应。 CH2=CH2 H2O HzS04.140℃ CH2-CH2- HOH0rAl,03.240-260℃ CHCH2OCH2CH;H2O 醇的脱水反应活性:3°R-OH>2°R-OH)1°R-OH

例如: CH;CH2CH2CH2OH 75%1S04 CH CH=CHCH3 140℃ CH:CH-CHCH 60%H2S04 CHCH=CHCH OH 100℃ 80% 20%HO CH-C-CHa CH3 (CH3)3C-OH 85-90℃ 100% 醇脱水反应的特点: 1)主要生成札依采夫烯,例如: CH:CH2CHCH: CH,CH-CHCHs +CH.CH.CH-CH OH 80% 206 GRGHCCH-GGHCH-CH OH (主) ○8的r%,Cy% (主) 2)用疏酸催化脱水时,有重排产物生成。 H CHsCH2CHCH2OH cH,cH,CHC#2氢重推CH,CH.CCH, 伯碳正离子 叔碳正离于 .H' H CH CH:CH2-C=CH2 CHCH-C-CH, 主要产物 6.氧化和脱氢 1)氧化:伯醇、仲醇分子中的“H原子,由于受羟基的影响易被氧化。 10