
第九章卤代烃 一,学习目的和要求: 1.掌提卤代烃的分类、同分异构和命名法。 2.掌握SN1、S2反应的动力学,立体化学及影响因素(烃基结构、试剂亲核性、离去基团 及溶剂)。 3.掌握卤代烃的化学性质、格林那试剂的制法和性质、 4.掌握卤代烃的消除反应(E、E)机理和札依采夫(Sayz心规则,消除反应的立体化 学特征。 5.理解不饱和卤代烃的三种类型及反应活性。 6.理解Sx1和Sw2、E与E历程的竞争。 7.了解重要的亲核取代反应及其应用。 8.了解重要卤代烃的制法和用途(NBS试剂的溴代,氯甲基化)。 9.了解离子对理论及邻基参与效应。 10.了解氟代烃的特性及应用 二。本章节重点、难点: S1、S2反应的动力学,立体化学及彩响因素,卤代烃的化学性质,卤代烃的消除反 应(E、E,)机理和札依切夫(Sayz)规则,不饱和卤代烃的三种类型及反应活性,S1 和S2、E,与E2历程的竞争 引言 卤代烃可以看作是烃分子中一个或多个氢被卤原子取代后所生成的化合物。其中卤原子 就是卤代烃的官能团。一卤代烃可表示为R-X,X=C1、Br、【、F。 卤代烃的性质比烃活泼得多,能发生多种化学反应,转化成各种其它类型的化合物。所 以,烃分子中引入凶原子,在有机合成中是非常有用的。自然界极少含有卤素的化合物,绝 大多数是人工合成的 分类: 1.按分子中所含肉原子的数目,分为一卤代烃和多岗代烃。 2.按分子中卤原子所连烃基类型,分为:

卤代烷烃 R-CH2-X 卤代烯经 R-CH=CH-X 乙烯式 R-CH=CH-CH:-X 烯丙式 R-CH=CH (CH:)n-X ≥2 孤立式 X 卤代芳烃 CHx 3.按卤素所连的碳原子的类型,分为: R-CH2-X R2CH-X RC-X 伯卤代烃 仲卤代经 叔卤代经 一级卤代烃(1) 二级肉代烃(2) 三级卤代烃(3) 9.1卤代烷 9.11命名 【.结构简单的卤代烃可以按肉原子相连的烃基的名称来命名,称为卤代某烃或某基。 (CH),CHBr,溴代异丙烷(异丙基溴):CH,CH,C,氯代¥(苄基氯) 2.较复杂的卤代烃按系统命名法命名: ①.卤代烷,以含有卤原子的最长碳链作为主链,将卤原子或其它支链作为取代基。命 名时,取代基按“顺序规则”较优基闭在后列出。[烷烃为母体] CHCH2CE: a CH3 CH2CI 4-甲基一2-氯己烷 2一乙基-1一氯戊烷 ②。卤代烯烃命名,含双键的最长碳链为主链,以双键的位次最小为原则进行编号。 【烯烃为母体]

C-CH-C dEC e-dt-dne CH3 3-甲基-4-氯-1-丁烯 3一溴丙烯 ③.卤代芳烃,[芳烃为母体 2一氣甲荣 侧链氯代芳烃,常以烷烃为母体, 卤原子和芳环作为取代基 ◇cta 2一苯基一1一飘丙烷 ①.卤代环烷烃则一般以脂环烃为母体命名,卤原子及支链都看作是它的取代基。 顺-1-甲基一2一溴环己烷 3.同分异构现象 卤代烷的同分异构体数目比相应的烷烃的异构体数多。如一卤代烷除了具有碳干异构体 外,南原子在碳链上的位置不同,也会引起同分异构现象。 CHgCH2CH2CI CH2CHCH3 d 9.1.2卤代烷的制法 一由烃制备 1,烃的卤代 RH CI hV >RCI+HO

CC4沸腾 N-bromo-succinimide(NBS) 〔 85% 85% CH3-CH-CH2- NBS BrCH2-CH=CH2 (○-c-0)2 历程 e一· NBS在这里是与反应中的极少量HBr反应而产生少量的溴 是。-0-804.0g-0 O+Br2→C-Br+Br
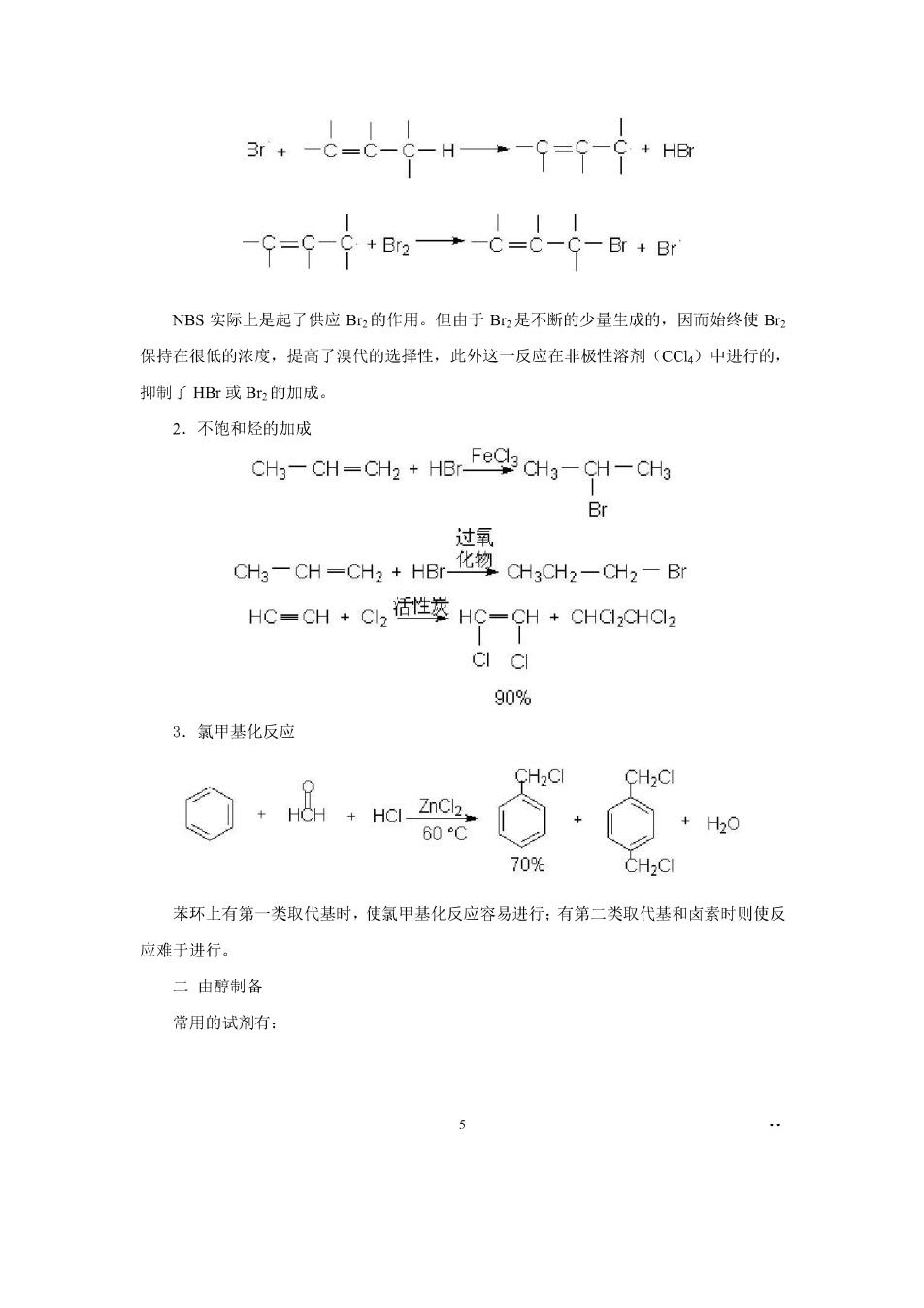
r+-G-6-g-H一-9=9-9+H6 9=9-ge一t-6-g-88r NBS实际上是起了供应Br,的作用。但由于B,是不断的少量生成的,因而始终使Br 保持在很低的浓度,提高了溴代的选择性,此外这一反应在非极性溶剂(CCL4)中进行的, 抑制了HBr或Br,的加成, 2.不饱和烃的加成 CHg-CH-CH2+HBr Fe CHa-CH-CHo CH3-CH-CH2 HBr- 题a,n-c, HC-CH Cl HC-CH CHCCHC 90% 3.氯甲基化反应 CHaCI CH2CI 60℃ 70%CH2CI 苯环上有第一类取代基时,使氯甲基化反应容易进行:有第二类取代基和卤素时则使反 应难于进行。 二由醉制备 常用的试剂有:

1.醇与ⅸ作用 ROH+HX亡RX+H2O 2.醇与卤化磷作用 3ROH PX3-3RX P(OH)3 X=Brl 在制备中,常将赤磷与碘(溴)加到醇中,然后加热,便可生成三碘(溴)化磷再与醇 作用。 醇与三氯化磷作用生成氯代烷,产率不高。一般低于50%,因有副反应生成。 3ROH PClg- →POR3+3HC 亚磷酸酯 副产物 3.醇与二氯亚砜作用 ROH SOCl2-RCI SO2+HCI 副产物为气体,氯化物分离,提纯方使。在与手性醇反应时,构型保持。溴化亚砜因其 不稳定而难得,故不用于这种反应 小H鹰0 H CI CI ”riH&a 6

R 0s0 R S=0+ HI CI +S02 0, 紧密离子对 构型保持 但在醇的氯化亚砜的混合液中加成弱亲核试剂吡啶,即发生构型的转化。 H S0 R →d-c< ·s0+ R 构型反转 三卤化物的置换 RC+Nal丙RI+NaC RBr+Nal丙RI+NaBr 这是一个可逆反应,通常将氯代烷或澳代烷的丙酮溶液与碘化钠共热,由于碘化钠(碘 化御)溶于丙酮后反应生成的NaCL,NaBr.KCl.KBr的溶解度很小,这祥可使平衡向右移动促 使反应继续进行。这是制备碘代烷比较方便而且产率较高的方法,。 9.13物理性质(略) 光谱性质 1.R: eF1400~1000cm'VeF800~600em1e.m600~500cmk4500cm 碳卤键的吸收须率随着卤素原子量的增加而减少。 2.NMR:

8值:HC-F4~4.5:HC-C3~4:HC-Br2.5~4:HC-I2~4. 随着卤代烷中卤原子电负性的增加(I2.5,Br2.8,C13.0,F4.0)其化学位移值也 增加。 9.14化学性质 卤代烃的化学性质活泼,且主要发生在C一X键上。因: ①分子中C一X键为极性共价键亡心,碳带部分正电荷,易受带负电荷或孤电 子对的试剂的进攻。 卤代烷: CH;CH2-CI CH:CH2-Br CH;CH2-I CH3CH3 偶极矩μD) 2.05 2.03 1.91 0 ②分子中C一X键的键能(C一F除外)都比C一H键小. 键 C-H C-CI C-Br C-I 键能KJ/mol414339 285218 故C一X键比C一H键容易断裂而发生各种化学反应。 (1)、取代反应 RX Nu RNu X- Nu=HO、RO、-CN、NH、ONO2 Nu为亲核试剂(mucleophile)。由亲核试剂进玫引起的取代反应称为亲核取代反应 (nucleophilicsubstitution,简写为Sx)。 1.水解反应 RCHX+NaOH水、RCH,OH+NaX I°加NaOH是为了加快反应的进行,是反应完全。 2°此反应是制备醇的一种方法,但制一般醇无合成价值,可用于制取引入O州比引入 卤素困难的醇。 2.与氰化钠反应 RCH.NaCN RCHCN Nax

1°反应后分子中增加了一个碳原子,是有机合成中增长碳的方法之一。 2°CN可进一步转化为-COOH,-CONH,等基团。 3.与氨反应 R-X+NH(过景→RNH,+NHX 4.与醇钠(RONa)反应 RX+b心一R+NaX RX一般为伯卤代烃,仲、叔卤代烷与醇纳反应时,主要发生消除反应生成烯烃。 5.与AgNO,一醇溶液反应 R-X AgNO,R-O NO2+AgX 硝酸酯 此反应可用于鉴别卤化物,因卤原子不同、或烃基不同的卤代烃,其亲核取代反应活性 有差异,其活性次序是: R:C-X(叔卤烷)>R,CHX(仲卤烷)>RCHX(伯卤烷) R-I R-Br R-CI 上述反应都是由试剂的负离子部分或未共用电子对去进攻C一X键中电子云密度较小 的碳原子而引起的。这些进攻试剂都有较大的电子云密度,能提供一对电子给C一X键中带 正电荷的碳,也就是说这些试剂具有亲核性,我们把这种能提供负离子的试剂称为亲核试剂, 由亲核试剂的进攻而引起的取代反应称为亲核取代反应,简称为S、。 (2)消除反应 从分子中脱去一个简单分子生成不饱和键的反应称为消除反应(elimination reaction,简 写作E)。 卤代烃与NaOH(KOH)的醇溶液作用时,脱去肉素与B碳原子上的氢原子而生成烯烃。 R-CH-CH,,+NOI醇、RCH-C+NaX+H,O H X 父a里OLHOFOR·x-3o 9
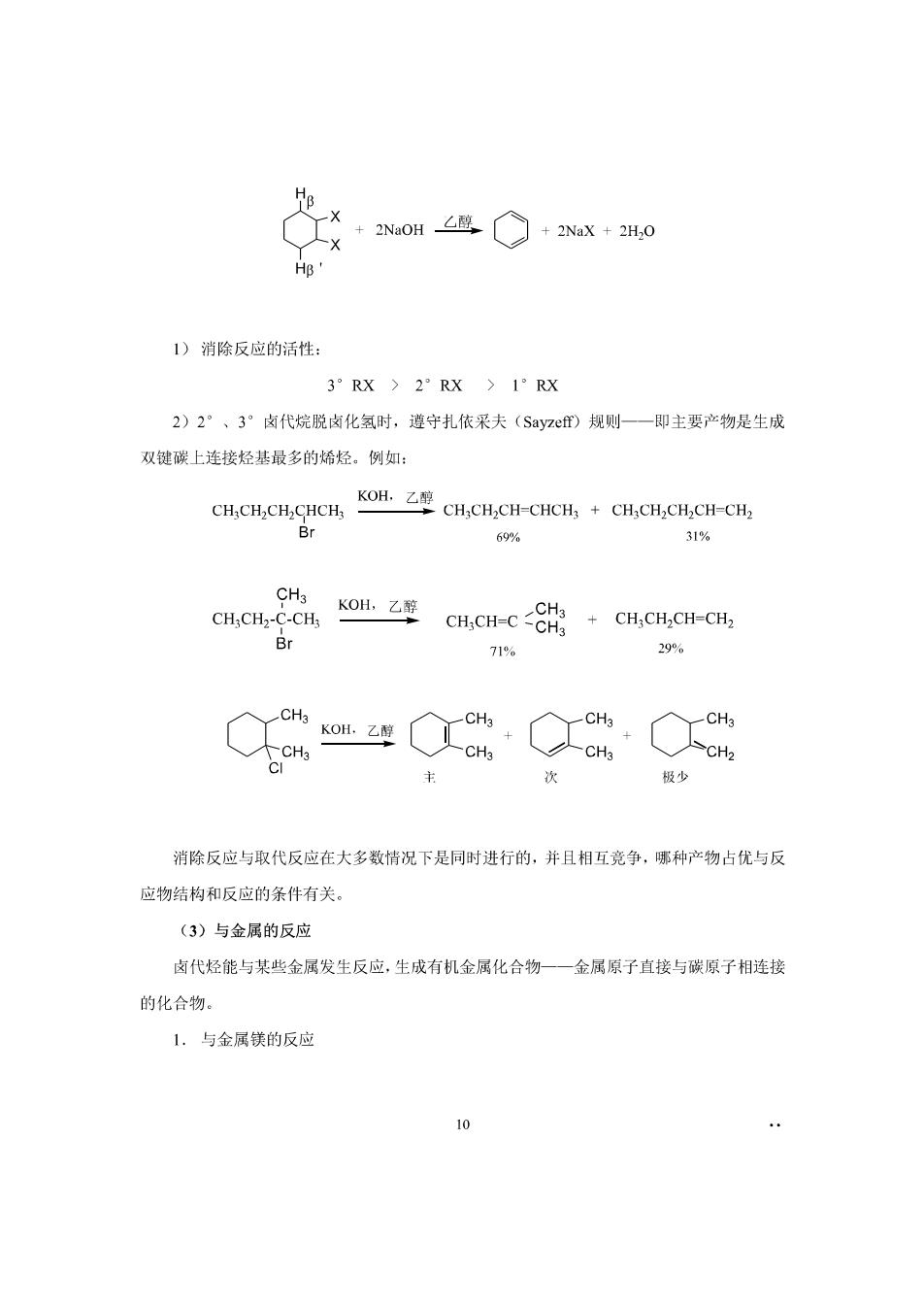
+2N0H鹰+2N0x+2H0 人x HB' 1)消除反应的活性 3°RX)2RX)1°RX 2)2”、3”卤代烷脱卤化氢时,遵守扎依采夫(Syz)规则一一即主要产物是生成 双键碳上连接烃基最多的烯烃。例如: CH,CH,CH,CHCH,o CH,CH,CH-CHCH,+CH,CH,CH,CH-CH. Br 69% 31% u084a246a0He:8欲 CH;CH2CH-CH2 Br 71% 299% C40Q8C 主 次 极少 消除反应与取代反应在大多数情况下是同时进行的,并且相互竞争,哪种产物占优与反 应物结构和反应的条件有关。 (3)与金属的反应 南代烃能与某些金属发生反应,生成有机金属化合物一一金属原子直接与碳原子相连接 的化合物。 1.与金属镁的反应 10