
第十二章醛和酮核磁共振谱 学习要求 1、掌握醛、酮的命名方法,结构特征及波谱特征。 2.掌握醛酮中羰基的亲核加成反应(与醇、氢氰酸、亚硫酸钠、格林那试剂,魏悌希试 剂、氮及其衍生物的加成)及其运用。 3.掌握αH的反应:羟醛缩合发生的条件、形式和应用:卤仿反应的条件和在鉴别及 合成上的应用。 1、理解羰基亲核加成反应的历程。 5.理解核磁共振谱的一般原理。 6.理解)C-C和>C-0双键的结构差异以及在加成反应上的不同点。 7.理解醛酮化合物的还原方法,并能区别各种还原剂的应用范围 8.理解醛酮化合物的氧化反应、与托伦试剂和斐林试剂反应的结构要求及应用 9.理解康尼查罗反应的条件和交错康尼查罗的应用。 10了解饱和一元醛雨的常用制备方法。 I了解饱和醛酮的UV、IR和INHMR的特征吸收峰。 12了解饱和一元醛酮的代表物, 13.了解金属氢化物。 计划课时数6课时 重点:醛酮的亲核加成反应,QH的反应:羟醛缩合发生的条件、形式和应用;卤仿反应 的条件和在鉴别及合成上的应用,核磁共振谱的一般原理。 难点:亲核加成反应的历程。 教学方法采用多媒体课件、模型和板书相结合的课堂讲授方法 引言 醛和酮都是分子中含有羰基官能团(>汇-0)的化合物,窥基与一个烃基相连的化合物称为 隆陕同®夏转基相装能。及C0《R-6R) H

§121醛、酮的结构,分类,同分异构和命名 12.1.1醛、酮的结构 能酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。羰基是用一个双键利 氧相连的原子团(>C=0)。 21.8 C=0 g 1165 /0.0 近平而三角形结构 羰基碳原子是SP杂化的,其中一个SP条化轨道与氧原子的P轨道重选形成 键,>⑧绝方一个P轨道与碳原子的P轨道侧面重选形成x键,C-0=ū+π 与 相似 C=0双键中氧原子的电负性比碳原子大,所以电子云的分布偏向氧原子,故装 基是一个极性基团,具有偶极矩,氧原子上带部分负电荷,碳原子上带部分正电荷。 、☑ >8-8 电负性C<0 a 电子云偏向氧原子 极性双键 12.1.2分类 CH,CH2CH2CHO脂肪醛 脂肪酮 CHO 脂环醛 脂环酶 《CcHO &CH 芳香酮 芳香醛 CH,CH=CHCHO不饱和醛 CHgCH=CH-C-CHg ⊙-0 不饱和酮 CH2CHO CH2CHO 二元醛 CHg-C-CHz-C-CHa 二元雨 2
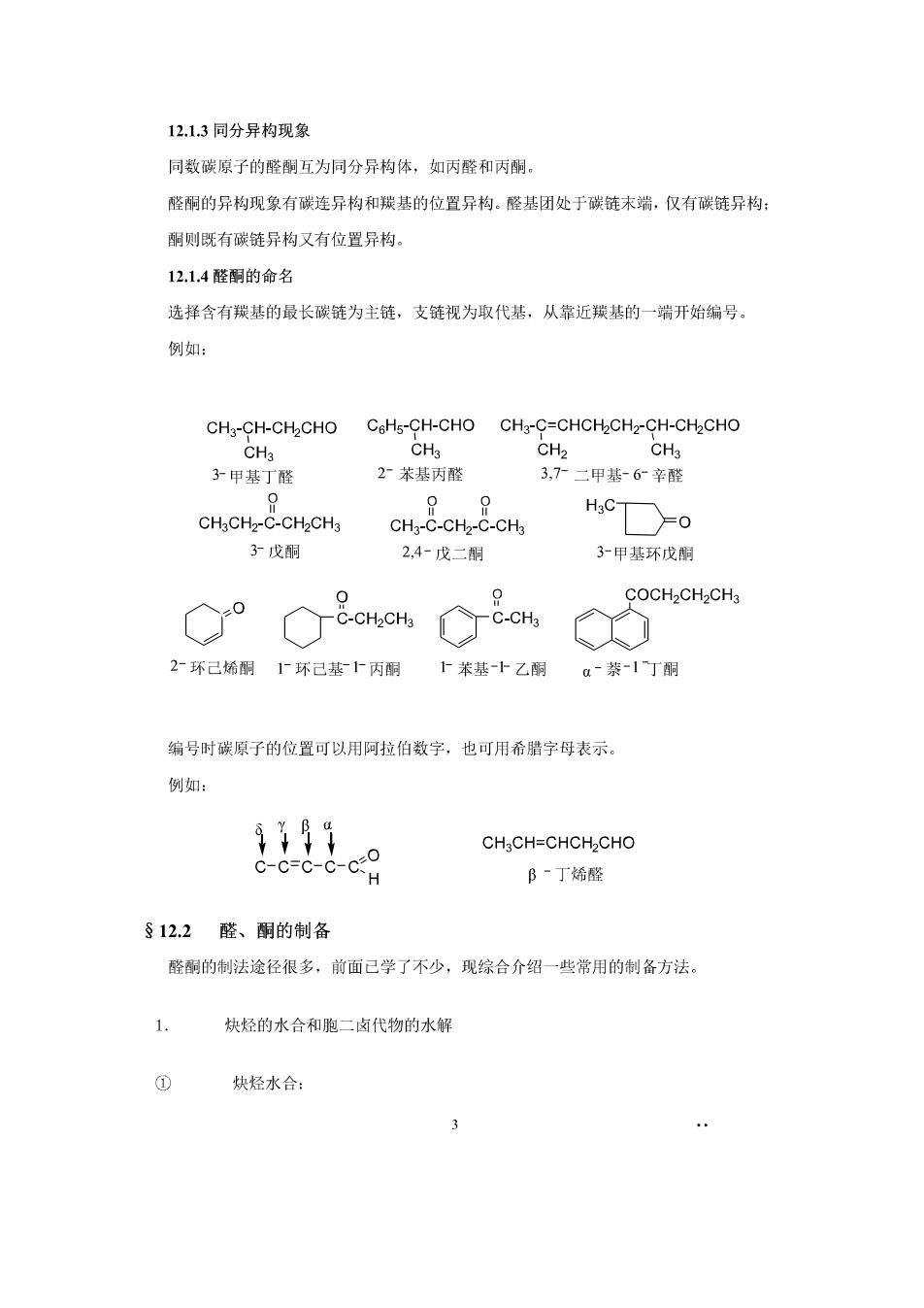
12.13同分异构现象 同数碳原子的醛酮互为同分异构体,如丙醛和丙酮。 醛酮的异构现象有碳连异构和联基的位置异构。醛基团处于碳链末端,仅有碳链异构: 酮则既有碳链异构又有位置异构 12.1,4醛酮的命名 选择含有羰基的最长碳链为主链,支链视为取代基,从常近羰基的一端开始编号。 例如: CH3-CH-CH2CHO CoHs-CH-CHO CHs-C=CHCH2CHz-CH-CH2CHO CH cH 子甲基丁醛 2苯基丙醛 3,7二甲基-6辛醛 0 00 CHaCHz2-C-CH2CH3 CH:-C-CH2-C-CHa HCT产o 3戊酮 2,4-戊二朋 3甲基环戊酮 C° COCH2CH2CHs 2环己烯酮下环己基上丙酮上苯基-十乙酮a~萘-1丁酮 编号时碳原子的位置可以用阿拉伯数字,也可用希腊字母表示。 例如: 9199 o-c-6-c-c CH3CH=CHCH2CHO B-丁烯醛 §12.2醛、酮的制备 醛酮的制法途径很多,前面已学了不少,现综合介绍一些常用的制备方法。 1. 缺经的水合和胞一卤代物的水辑 ① 炔烃水合 3

OH R-C三C-R+H20 H20-BrOR -C=CH--C-CH3 端快 0甲基酮 HgS0。-H2S04 m0,cu6i,c=6e4c6a%0c,0-em2d人人Y个V 60-100C 80% 适合于端炔或对称的炔。 用硼氢化一氧化法进行水合,由末端炔可以制得 1-CgnC=0H5+20+n-C,00 -OH ②胞二卤代物水解: C光:90+:c C0光0-⊙照Qi⊙ CI 2.由烯烃制备 ① 烯烃的氧化

人入八0,n+人入√o+cH,0 CH2C12 HDAc CHCPC2 CCH ② 氢甲醛化法(Hydroformy lation) -w·m次 正 CHO次 125℃,4141-656tkpa 个cm C02(C0)g △,压力 不对称烯烃主要产物直链烃基醛,对称烯烃可得单一产物。 3.由芳烃侧链aH的氧化 CH3 a0nW到 CHO 控制氧化条件,氧化剂不要过量 ②Cr0,-醋酐作氧化剂 CH Cr0,~乙酐 CHO 45% Br HOAc,H250 二乙酸酯不易连续被氧化

CH2CK; · -%82 4.由醇氧化或脱氢 ①Na,Cr.0,(加疏酸)氧化法 0,0%6,0,0n,60-6H610,005(随时毫出1 H504 醛 6R0,-O-6a也89,0,0%,-○0n3 H2S04 的 由仲醇氧化制备酮,产率相当高:而由伯醇氧化制备醛,产率低,生成的醛可继续氧化 成羧酸。 ②Cu0脱氢法 合>0H0w0 ③Cr0,-吡啶(萨瑞特试剂)一Cr0(CLN) 1-6,风369n 氧化很好地控制在生成醛的阶段,且双键不受影响
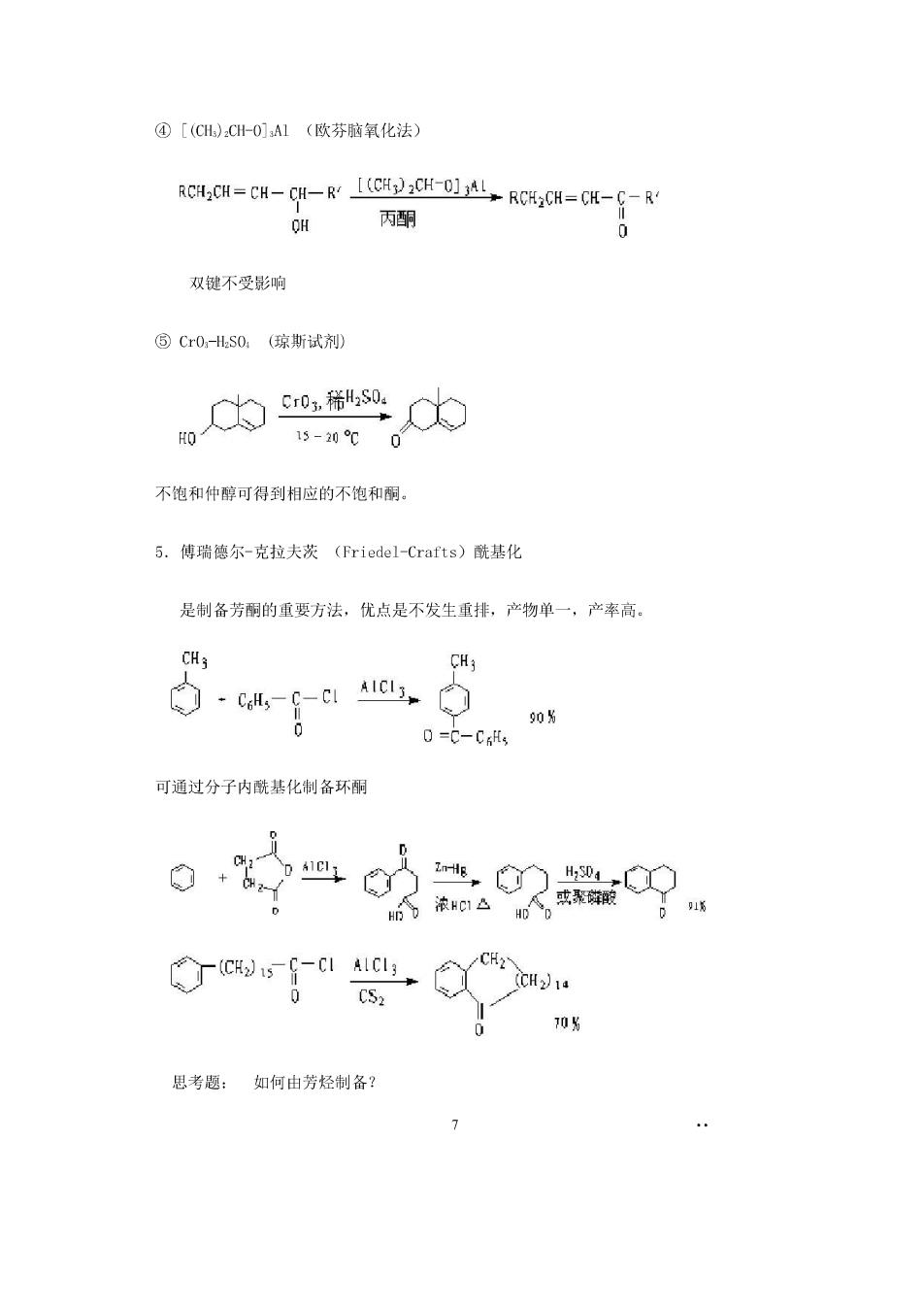
④[(C).CH-0]A1(欧芬脑氧化法) R8,0=6H-0-CD1LR0,0=0-f- OH 丙酮 双键不受影响 ⑤Cr0-lS0.(琼斯试剂 内000 15-20℃0 不饱和仲醇可得到相应的不饱和酮。 5.傅瑞德尔-克拉夫茨(Friedel--Crafts)酰基化 是制各芳酮的重要方法,优点是不发生重排,产物单一,产率高。 CH; -g-c. 908 0-C-C, 可通过分子内酰基化制备环酮 CS2 0 10% 思考题:如何由芳烃制备?

om 0 N02 COOH COOH COCI 力,0器+ N02 A1C不反应 0:·cc 6.盖德曼-柯赫(Gattermann-Koch)反应 在催化剂存在下,芳烃和HC1,C0混合物作用,可以制得芳醛 CHO ○+o+C1Alcl 该反应叫盖德曼-柯赫反应,它是一种特殊的傅氏酰基化反应。 如果芳环上有烃基、烷氧基,侧醛基按定位规则导入,以对位产物为主。 CHs CH ·0ct 如果芳环上带有羟基,反应效果不好,如果连有吸电子基,则反应不发生。 7.瑞默-梯曼反应(Reimer-Tiemann) 苯酚在NaO州存在下和CHCL:作用,生成酚醛
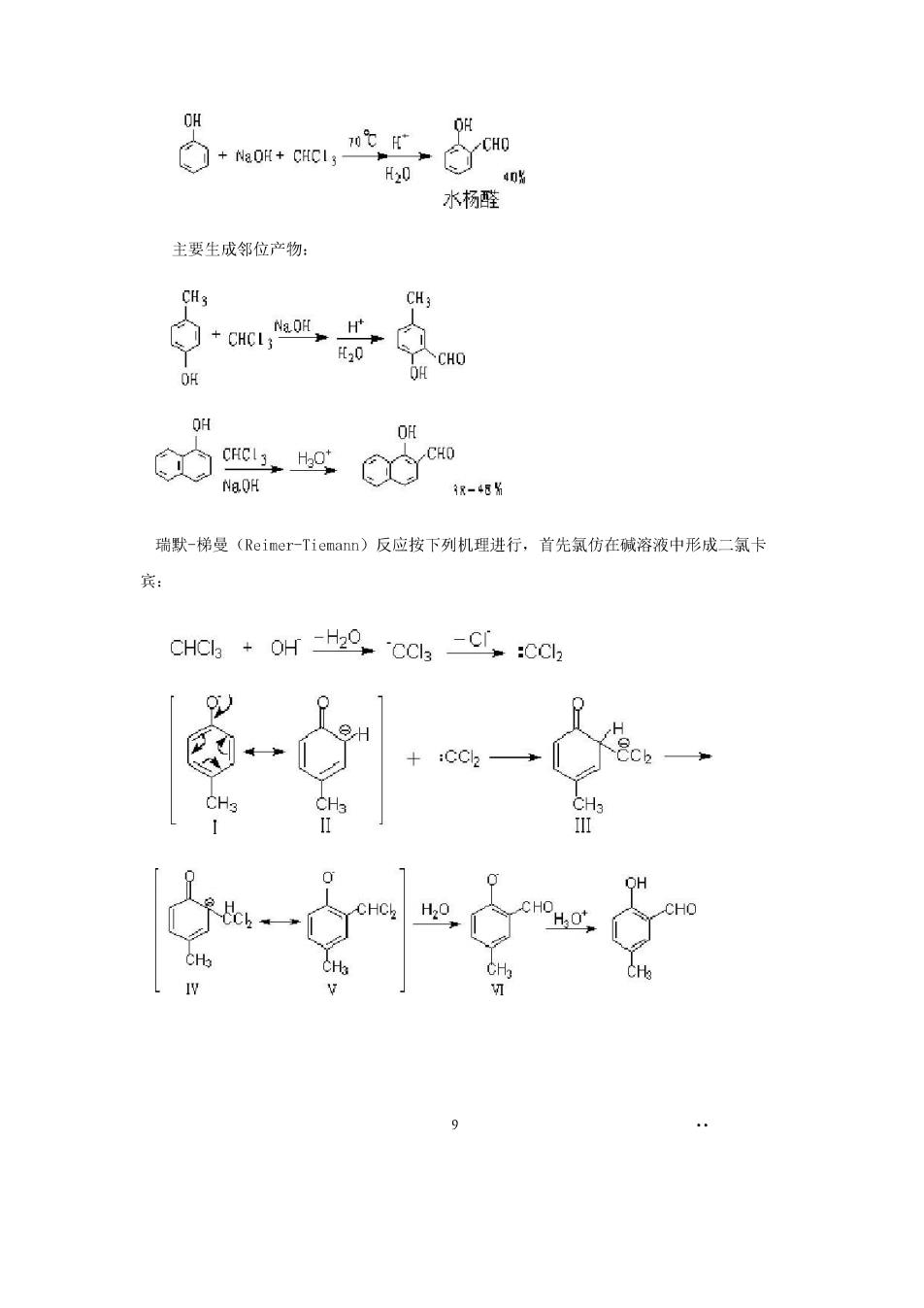
+NaOR+CHCI3 H20 0贴 水杨醛 主要生成邻位产物: CH3 [30 OH C nco 汉-45% 瑞默-梯曼(Reimer-Tiemann)反应按下列机理进行,首先氯仿在碱溶液中形成二氯卡 +:CC2

此外,二氯卡宾还可以攻击(1)的带甲基的碳原子,形成环己二烯酮衍生物: CH3CCLa CH CHCLz (v)或(v)中-CC1:上的氢过去通常认为是与它相连的苯环碳原子上的氢发生1,2转移 过来的,但背普(D.S.Kep)等发现并非如此,CHC:上的氢是来自溶剂,然后苯环在把 一个氢给子溶剂,为了证实这点,肯普在含氘的水(TO)中进行了Reimer-Tiemann反应 生成的水杨醛中,醛基含有99.6%的氚只有不到0.的佩在苯环上,这表明醛基的氧是来 自溶剂,即: 参考书:邢其毅等(下册)(1983)P:752-753 8.维路斯梅尔反应(Vilsmeier-Haack反应) CH CH3 65% 通常是指应用N,N二取代甲酰胺和POC13使芳环(主要是酚类和芳胺类)甲酰化反应。 9.酰氯还原制备醛 10