
有机化学教案 第十六章 第十六章重氮化合物和偶氮化合物 一.学习目的和要求: 1.学握重氢盐的性质及其在有机合成上的应用 2.掌握重氨甲烷的结构、性质。 3.理解“一消除和Y一消除的反应机理,特别是碳烯的形成及应用。 4.了解偶氨化合物及偶氮染料。 5.了解叠氮化合物及氮烯。 二.本章节重点、难点 重氮盐的性质及其在合成上的应用;重氨甲烷的结构、性质。 三.教学内容: 引言 重氨和偶氮化合物分子中都含有-N一N官能团,官能团两端都与烃基相连的称为偶氨化 合物,只有一端与烃基相连,而另一端与其他基团相连的称为重氨化合物,重氢盐的结构如 图所示: 重和偶氮化合物的命名阅读P9。 16.1芳香族重氮盐的制备一一重氮化反应 伯芳胺在低温及强酸水溶液中,与亚硝酸作用生成重氮盐(diazotization)的反应称为重氮 化反应。重氯化反应是制备芳基重氮盐最重要的方法。 (H2S04) i站·wea+o 0-5℃ 强调: 1.重氨盐温度较高时易分解,故重氨化反应常在低温下进行。 2.亚硝酸的存在会加速重氨盐的分解,故亚硝酸不能过量。 3。重氮化反应须保持强酸性条件,以避免生成的重氮盐与未起反应的芳胺发生偶合反应
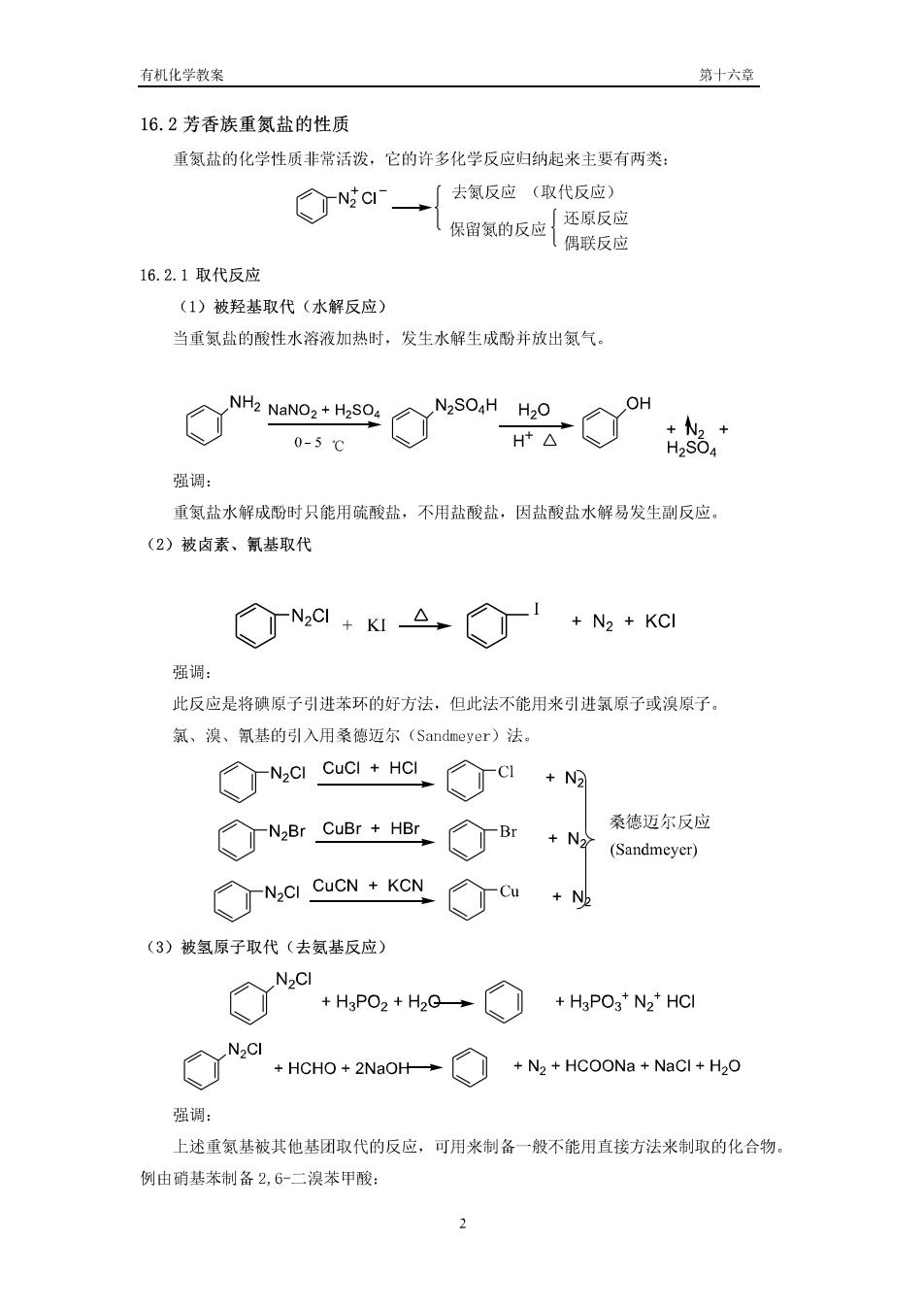
有机化学教案 第十六章 16.2芳香族重氮盐的性质 重氯盐的化学性质非常活泼,它的许多化学反应归钠起来主要有两类: ◇cr→ 去氨反应(取代反应) 核南家的版世西服 16.2.1取代反应 (1)被羟基取代(水解反应) 当重氨盐的酸性水溶液加热时,发生水解生成酚并放出氮气。 小2ao2+2s42—+ 0-5℃ t品 强调: 重氯盐水解成酚时只能用硫酸盐,不用盐酸盐,因盐酸盐水解易发生副反应。 (2)被卤素、氰基取代 ◇o1+I△○1+M+k@ 强调: 此反应是将碘原子引进苯环的好方法,但此法不能用来引进氯原子或溴原子 氯、溴、氰基的引入用桑德迈尔(Sandmeyer)法。 NGI CUCI HCICNG 桑德迈尔反应 ◇N8rcu8r+8◇r·4S ◇N,ICUCN+kCN◇a +N2 (3)被氢原子取代(去氨基反应) +H,PO2+H,G→○ +H3PO3*N2*HCI h.a +HCHO+2NaOH+N2+HCOONa+NaCl+H2O 强调: 上述重氮基被其他基团取代的反应,可用来制备一般不能用直接方法来制取的化合物, 例由硝基苯制备2,6二溴苯甲酸:

有机化学教案 第十六章 5÷5oe52 NHCOCH NHCOCH3 HNO, NO. NH2 NH2 N支HSO H204 NO2 NO2 CuCN KCN H20 NO2 NO2 16.2.2还原反应 重氮盐可被氯化亚锡、锡和盐酸、锌和乙酸、亚硫酸钠、亚疏酸氢钠等还原成苯肼:如 用较强的还原剂则生成苯胺和氨。 阅读:Pm 16.23偶联反应 重氮盐与芳伯胺或酚类化合物作用,生成有颜色的偶氮化合物的反应称为偶联反应。偶 联反应是亲电取代反应,是重氮阳离子(弱的亲电试剂)进攻苯环上电子云较大的碳原子而 发生的反应,它是制备偶氨染料的基本反应。 (1)与胺偶联 NNICHh PH1 5-6N-N--NCHa)2 强调: 反应要在中性或弱酸性溶液中进行是由于: 在中性或弱酸性溶液中,重氨离子的浓度最大,且氨基是游离的,不影响芳胺的反应 活性。 b若溶液的酸性太强(K5),会使胺生成不活泼的铵盐,偶联反应续难进行或很慢。 NO.COMO CHa 4磺酸基-4二甲胺基偶苯 (甲基橙) 强调: 偶联反应总是优先发生在对位,若对位被占,则在邻位上反应,间位不能发生偶联反应。 (2)与酚偶联 2

有机化学教案 第十六章 NGon om 低温 OH CHa 强调: 反应要在弱碱性条件下进行,因在弱碱性条件下酚生成酚盐负离子,能使苯环活化,有 利于亲电试剂重氨阳离子的进攻。但缄性不能太大(H不能大于10),因碱性太强,重氨盐 会转变为不活泼的苯基重氨酸或重氨酸盐离子,而苯基重氮酸或重氨酸盐离子都不能发生偶 联反应。 Cia=Cao芒◇no 可偶合 不偶合 不偶合 强调: 重氯阳离子是一个弱亲电试剂,只能与活泼的芳环(酚、胺)偶联,其它的芳香族化合 物不能与重氢盐偶联。在重氨基的邻对位连有吸电子基时,对偶联反应有利。故在进行偶联 反应时,要考虑到多种因素,选择最适宜的反应条件,才能收到预期的效果。 16.3偶氮化合物和偶氮染料 染料是一种可以较牢固的附在纤维上耐光和耐洗性的有色物质,根据化学结构一般分为 偶氨染料、靛系染料、煦醌染料、芳甲烷染料、酲亚胺染料、喹啉染料、酞菁染料和黄酮染 料等。偶氨基-N八-是一个发色基团,因此,许多偶氮化合物常用作染料(偶氮染料),偶氨 染料是合成染料中品种最多的一种。 阅读:P 16.4重氨甲烷 重氨甲烷的分子式是CH,它的结构比较特别,根据物理方法测量,它是一个线型分 子,但是没有一个结构能比较完满地表示它的结构。共振论用下列极限式来表示 8:→cHA98:→th-NR H952 H/6.396 6,-
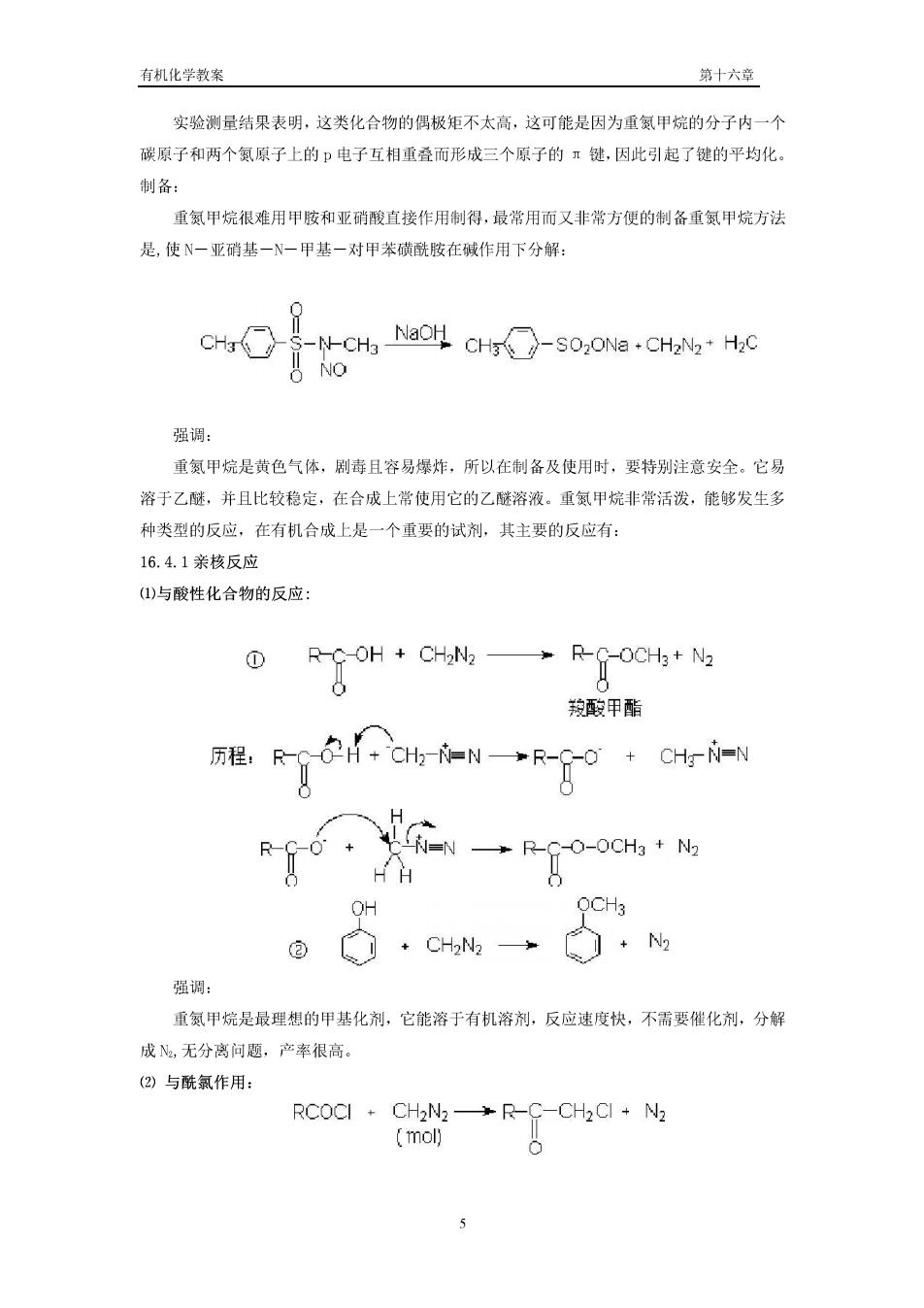
有机化学教案 第十六章 实验测量结果表明,这类化合物的偶极矩不太高,这可能是因为重氨甲烷的分子内一个 碳原子和两个氨原子上的p电子互相重叠而形成三个原子的元键,因此引起了键的平均化。 制备 重氮甲烷很难用甲胺和亚硝酸直接作用制得,最常用而又非常方便的制备重氨甲烷方法 是,使N一亚硝基一N一甲基一对甲苯磺酰胺在碱作用下分解: -NCHa NaCH CH-sO:ONa-CHaN2*Hc NO 强调: 重氮甲烷是黄色气体,剧毒且容易爆炸,所以在制备及使用时,要特别注意安全。它易 溶于乙醚,并且比较稳定,在合成上常使用它的乙醚溶液。重氮甲烷非常活泼,能够发生多 种类型的反应,在有机合成上是一个重要的试剂,其主要的反应有 16.4.1亲核反应 ()与酸性化合物的反应: ①ROH+CHN→RC-OCH+N 羧酸甲酯 程,RHCIG R-N-一→R-g0·GHr= OH ·CH→· 强调: 重氨甲烷是最理想的甲基化剂,它能溶于有机溶剂,反应速度快,不需要催化剂,分解 成,无分离问题,产率很高 (②)与酰氯作用: RCOCI CH2N2->R-C-CH2CI N2 (mol)

有机化学教案 第十六章 e,0a+cHw一→CHCHcl+M 历得: ORC-C+CH=N产FCGH 0 ②R- R 历程:)R CHNRCHR-N P (ii)R -CHz N-N:R-C-CHR=N:CI (ii)R-C-CHa-N:R-C-CHN2 H' CH2-N=N: 夺取H Wolf(沃尔夫)重氨酮重排为烯酮: 烯酮
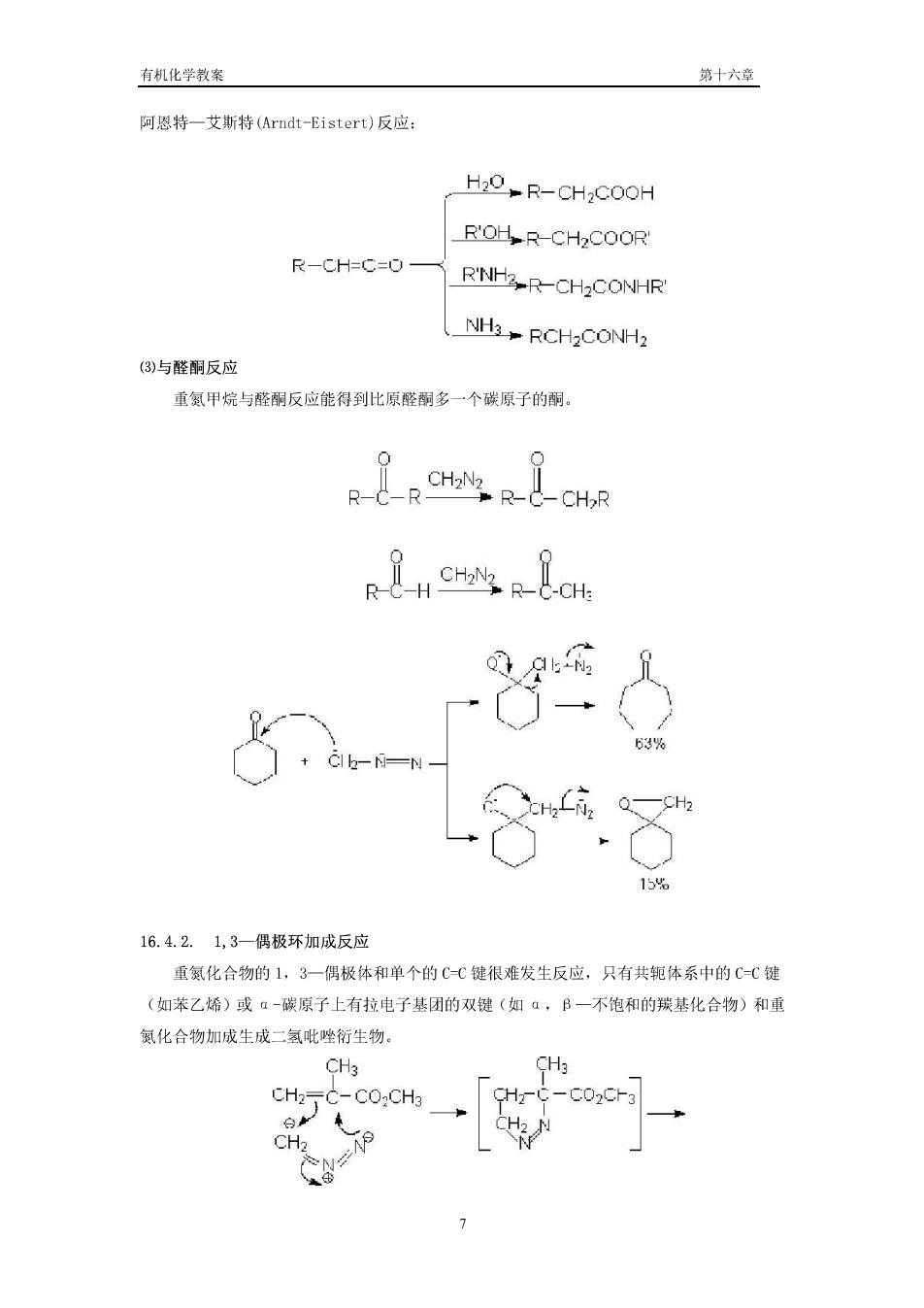
有机化学教案 第十六章 阿恩特一艾斯特(rndt-Eistert)反应: H2O-R-CH2COOH R'OHR-CH2COOR' R-CH=C=0 RNH2-R-CH2CONHR NH3>RCH2CONH2 (3)与醛酮反应 重氮甲烷与醛酮反应能得到比原醛嗣多一个碳原子的酮, a 63% 15% 16.4.2.1,3一-偶极环加成反应 重氮化合物的L,3一偶极体和单个的C-C键很难发生反应,只有共轭体系中的C-C键 (如苯乙烯)或ū-碳原子上有拉电子基团的双键(如α,B一不饱和的疾基化合物)和重 氨化合物加成生成二氢比唑衍生物, CH3 CH3 CH2-C-CO:CHg CH-C 白 CH2
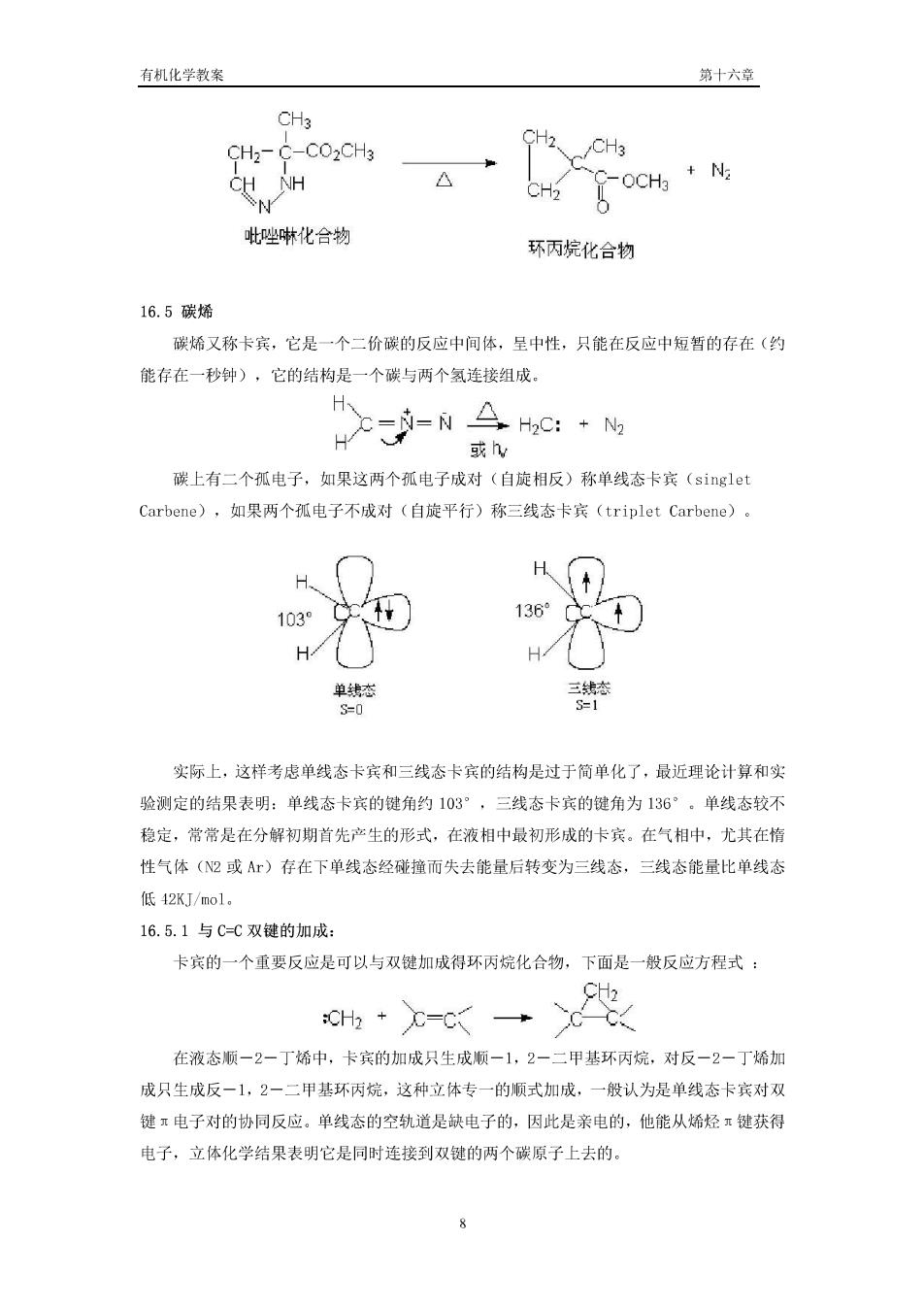
有机化学教案 第十六章 CH3 CH2-C-CO2CH3 飞wH 吡唑啉化合物 环丙烷化合物 16.5碳烯 碳烯又称卡宾,它是一个二价碳的反应中间体,呈中性,只能在反应中短暂的存在(约 能存在一秒钟),它的结构是一个碳与两个氢连接组成。 怎-N会hC:· H 或v 碳上有二个孤电子,如果这两个孤电子成对(自旋相反)称单线态卡宾(singlet Carbene),如果两个孤电子不成对(自旋平行)称三线态卡宾(triplet Carbene)。 H 103 136°0 H 实际上,这样考虑单线态卡宾和三线态卡宾的结构是过于简单化了,最近理论计算和实 验测定的结果表明:单线态卡宾的键角约103°,三线态卡宾的键角为136°。单线态较不 稳定,常常是在分解初期首先产生的形式,在液相中最初形成的卡宾。在气相中,尤其在格 性气体(2或A)存在下单线态经碰撞而失去能量后转变为三线态,三线态能量比单线态 低42KJ/nol. 16.5.1与C-C双键的加成: 卡宾的一个重要反应是可以与双键加成得环丙烷化合物,下面是一般反应方程式: 、2 h·x-c→>x 在液态顺一2一丁烯中,卡宾的加成只生成顺一1,2一二甲基环丙烷,对反一2一丁烯加 成只生成反一1,2一二甲基环丙烷,这种立体专一的顺式加成,一般认为是单线态卡宾对双 健π电子对的协同反应。单线态的空轨道是缺电子的,因此是亲电的,他能从烯烃π键获得 电子,立体化学结果表明它是同时连接到双键的两个碳原子上去的

有机化学教案 第十六章 Bc-c H B>C-C 、CH3 CH3 CH3 单统态1CH2(↓】与双牌顺势加戒 在气态,卡宾与2一丁烯(顺式或反式)的加成产物是等量的顺和反一1,2一二甲 基环丙烷的混合物。 CH2 参加反应的卡宾是三线态,非立体选择性

有机化学教案 第十六章 强调: 从上述反应可以看出,单线态卡宾和烯烃的加成是协同反应(顺式加成),而三线态卡 宾和烯烃的加成都是按分步的双游离基理发生反应。 16.5.2插入反应(insertion) 卡宾能把自身插入到大多数分子的C-H键中去, -H·h→-0H CH2-E OO++0+0 40% 25% 25%10g 强调: 在饱和和不饱和的CH键中发生插入反应,在希望进行加成时,插入反应将是一个副反 应。 16.5叠氮化合物(自学) 作业:P4,5,6,7,8,9.10,11