
工程化学试卷E 一是非题(在对的括号内填“正”,错的括号内填“误”)(10分) 1反应的△H就是反应的热效应。() 2反应C(S+HO(g)=CO(g+H(g)方程式两边物质的化学计量数(绝对值) 的总和相等,所以增加总压力对平衡无影响。( 3催化剂能改变反应历程,降低反应的活化能,但不能改变反应的△Gm .() 4由HAc一Ac组成的缓冲溶液,若溶液中c(HAc)>c(Ac),则该缓冲溶 液抵抗外力酸的能力大于抵抗外来碱的能力。() 5有两种分子酸HⅨ溶液和Y溶液有相同的pH,则这两种酸的浓度 (mol.dm)相同。() 6电池电动势E(或电极电势φ)的数值与电池反应(或半反应式)的写法 无关,而平衡常数K的数值随反应式的写法(即化学计量数不同)而变。 7多电子原子轨道的能级只与主量子数n有关。() 8.甲酸HC00H(1)中存在色散力和诱导力,但不存在氢键。() 9半导体和绝缘体有十分类似的能带结构,只是半导体的禁带宽度要窄 得多。() 10在配离子中,中心离子的配位数等于每个中心离子拥有的配位体的数 目。() 二选择题(将正确答案的标号填入括号内)(20分) 1下面对于热和功的描述中,正确的是() a)都是途径函数,无确定的变化途径就无确定的数值 b)都是途径函数,对应于某一状态有一确定值. c)都是状态函数,变化量与途径无关 d)都是状态函数,始终态确定,其值也确定
1 工程化学试卷 E 一 是非题(在对的括号内填“正”,错的括号内填“误”)(10 分) 1 反应的△H 就是反应的热效应。( ) 2 反应 C(s)+H2O(g)=CO(g)+H2(g)方程式两边物质的化学计量数(绝对值) 的总和相等,所以增加总压力对平衡无影响。( ) 3 催化剂能改变反应历程,降低反应的活化能,但不能改变反应的△rGm θ .( ) 4 由 HAc-Ac-组成的缓冲溶液,若溶液中 c(HAc)>c(Ac- ),则该缓冲溶 液抵抗外力酸的能力大于抵抗外来碱的能力。( ) 5 有两种分子酸 HX 溶液和 HY 溶液有相同的 pH,则这两种酸的浓度 (mol.dm-3 )相同。( ) 6 电池电动势 E(或电极电势)的数值与电池反应(或半反应式)的写法 无关,而平衡常数 K 的数值随反应式的写法(即化学计量数不同)而变。 ( ) 7 多电子原子轨道的能级只与主量子数 n 有关。( ) 8.甲酸 HCOOH(l)中存在色散力和诱导力,但不存在氢键。( ) 9 半导体和绝缘体有十分类似的能带结构,只是半导体的禁带宽度要窄 得多。( ) 10 在配离子中,中心离子的配位数等于每个中心离子拥有的配位体的数 目。( ) 二 选择题(将正确答案的标号填入括号内)(20 分) 1 下面对于热和功的描述中,正确的是( ) a)都是途径函数,无确定的变化途径就无确定的数值. b)都是途径函数,对应于某一状态有一确定值. c)都是状态函数,变化量与途径无关. d)都是状态函数,始终态确定,其值也确定

2下面说法中,不正确的是() a)焓只有在某种特定条件下,才能与系统反应热相等 b)焓是人为定义的一种具有能量量纲的热力学量, c)焓是状态函数 d)焓是系统与环境热交换的能量 3汽车尾气无害化反应NO(g十CO(g上12N2(grCO2(g)的△Hm(298K)1 0,要取得有毒气体N0和C0的最大转化率,可采取的措施是() a)低温低压b)高温高压c)低温高压d)高温低压 4下列各物质的浓度均为0.01mol.dm3,按它们渗透压递减的顺序排列正 确的是() a)HAc-NaCI-C6H1206-CaCl2 b)C6H12O6-HAc-NaCI-CaCl2 c)CaCl2-NaCl-HAc-C6H12O6 d)CaCl2-HAc-C6H1206-NaCl 5氨水的浓度为c,若将其稀释1倍,则溶液中c(OH-I)为() a)ic b)vK。c c)Kp.c/2 d)2c 6有一个原电池由两个氢电极组成,其中一个是标准氢电极,为了得到 最大的电动势,另一个电极侵入的酸性溶液〔设pH上10OkPa)应为 () a)0.Imol.dm3HCI b)0.1mol.dm3HAc+ 0.1mol.dmNaAc c)0.1mol.dm3HAc d)0.1mol.dm-3H3PO4 7已知某元素+2甲的离子的电子分布式为1s22s22p3s3p3I0,该元素在 周期表中的分区为() a)s区 b)d区 c)ds区 d)f区e)p区 8下列化合物中,中心原子以sp不等性杂化的是() a)BaCl2 b)PH3 c)H2S d)SiCla 9易于形成配离子的金属元素是位于周期表中的() 2
2 2 下面说法中,不正确的是( ) a)焓只有在某种特定条件下,才能与系统反应热相等. b) 焓是人为定义的一种具有能量量纲的热力学量. c) 焓是状态函数. d) 焓是系统与环境热交换的能量. 3 汽车尾气无害化反应 NO(g)+CO(g)=1/2N2(g)+CO2(g)的△rHm (298K) 0,要取得有毒气体 NO 和 CO 的最大转化率,可采取的措施是( ) a) 低温低压 b) 高温高压 c) 低温高压 d) 高温低压 4 下列各物质的浓度均为 0.01mol.dm-3,按它们渗透压递减的顺序排列正 确的是( ) a) HAc-NaCl-C6H12O6-CaCl2 b) C6H12O6-HAc-NaCl-CaCl2 c) CaCl2-NaCl-HAc-C6H12O6 d) CaCl2-HAc-C6H12O6-NaCl 5 氨水的浓度为 c,若将其稀释 1 倍,则溶液中 c(OH-1)为( ) a) c2 1 b) K c 2 b 1 c) Kb c / 2 d) 2c 6 有一个原电池由两个氢电极组成,其中一个是标准氢电极,为了得到 最大的电动势,另一个电极侵入的酸性溶液〔设 p(H2)=100kPa〕应为 ( ) a) 0.1mol.dm-3HCl b) 0.1mol.dm-3HAc+ 0.1mol.dm-3NaAc c) 0.1mol.dm-3HAc d) 0.1mol.dm-3H3PO4 7 已知某元素+2 甲的离子的电子分布式为 1s22s22p63s23p63d10,该元素在 周期表中的分区为( ) a) s 区 b) d 区 c) ds 区 d) f 区 e)p 区 8 下列化合物中,中心原子以 sp3 不等性杂化的是( ) a) BaCl2 b) PH3 c) H2S d) SiCl4 9 易于形成配离子的金属元素是位于周期表中的( )

a)p区 b)d区和ds区 c)s区和p区 d)s区 10在配离子PtC13(C2H4)]氧化值为() a)+3 b)+4 c)+2 d)+5 三填空题(每空1分,共20分) 1准确称取1.000g苯甲酸在氧弹量热计内完全燃烧,以测定其反应热, 必须知道 ; 2反应N2(g)+3H2(g)=2NH3(g)的△Hm(298.15K)=-92.2kJ.mo1,将 温度升高(例如升高100水),下面各项将如何变化(填写:不变,基本 不变,增大,减小。)△Sm △Gm9 3向10.0cm30.10mol,dm3的NH水溶液加入约1.0g的固体NH4C1并使 之溶解,NH3在水中的离解度会 。(填:增大,减小,不变: 基本不变。) 4向10.0cm3的纯水中加入1.0gNH4CI固体使之溶解,形成溶液的pH与 原纯水相比会 。(填:升高,降低,不变,基本不变。) 5原电池 (-)Pt I Fe2*(1mol.dm),Fe(0.01mol.dm)ll Fe2*(Imoldm).Fe(Imol.dmI Pt (+ 负极反应为 ,正极反应为 6设原电池的电池反应为Ni+Sn4+=N2++Sn2+,则该电池的图示为 7原子序数为22的元素,其外层电子构型为 ,未成对电子数 为 一,在周期表中所属区是。 8PH、C2H4、CO2、这几种物质中,仅存在o键的是 ;同 时存在σ键和π键的是 9配合物[Co(NH):C1]C12命名为 ,配位体 是 ,配位数为。 10在HS0、HC10、HP0、HPO这四种酸中,酸性最强的酸是」
3 a) p 区 b) d 区和 ds 区 c) s 区和 p 区 d) s 区 10 在配离子[PtCl3(C2H4)]-氧化值为( ) a) +3 b) +4 c) +2 d) +5 三 填空题(每空 1 分,共 20 分) 1 准确称取 1.000g 苯甲酸在氧弹量热计内完全燃烧,以测定其反应热, 必须知道 ; ; 。 2 反应 N2(g) + 3H2(g) = 2NH3(g) 的△rHm (298.15K)= -92.2kJ.mol-1,将 温度升高(例如升高 100K),下面各项将如何变化(填写:不变,基本 不变,增大,减小。) △rSm ; △rGm 3 向 10.0cm30.10mol.dm-3 的 NH3 水溶液加入约 1.0g 的固体 NH4Cl 并使 之溶解,NH3 在水中的离解度会 。(填:增大,减小,不变; 基本不变。) 4 向 10.0cm3 的纯水中加入 1.0gNH4Cl 固体使之溶解,形成溶液的 pH 与 原纯水相比会 。(填:升高,降低,不变,基本不变。) 5 原电池 (-)Pt∣Fe2+(1mol.dm-3 ),Fe3+(0.01mol.dm-3 )‖Fe2+(1mol.dm-3 ),Fe3+(1mol.dm-3 )∣Pt(+) 负极反应为 ,正极反应为 。 6 设原电池的电池反应为 Ni + Sn4+ = Ni2+ + Sn2+,则该电池的图示为 。 7 原子序数为 22 的元素,其外层电子构型为 ,未成对电子数 为 ,在周期表中所属区是 。 8 PH3、C2H4、CO2、N2 这几种物质中,仅存在σ键的是 ;同 时存在σ键和π键的是 。 9 配合物[Co(NH3)5Cl]Cl2 命名为 ,配位体 是 ,配位数为 。 10 在 H2SO4、HClO4、H3PO4、HPO3 这四种酸中,酸性最强的酸是
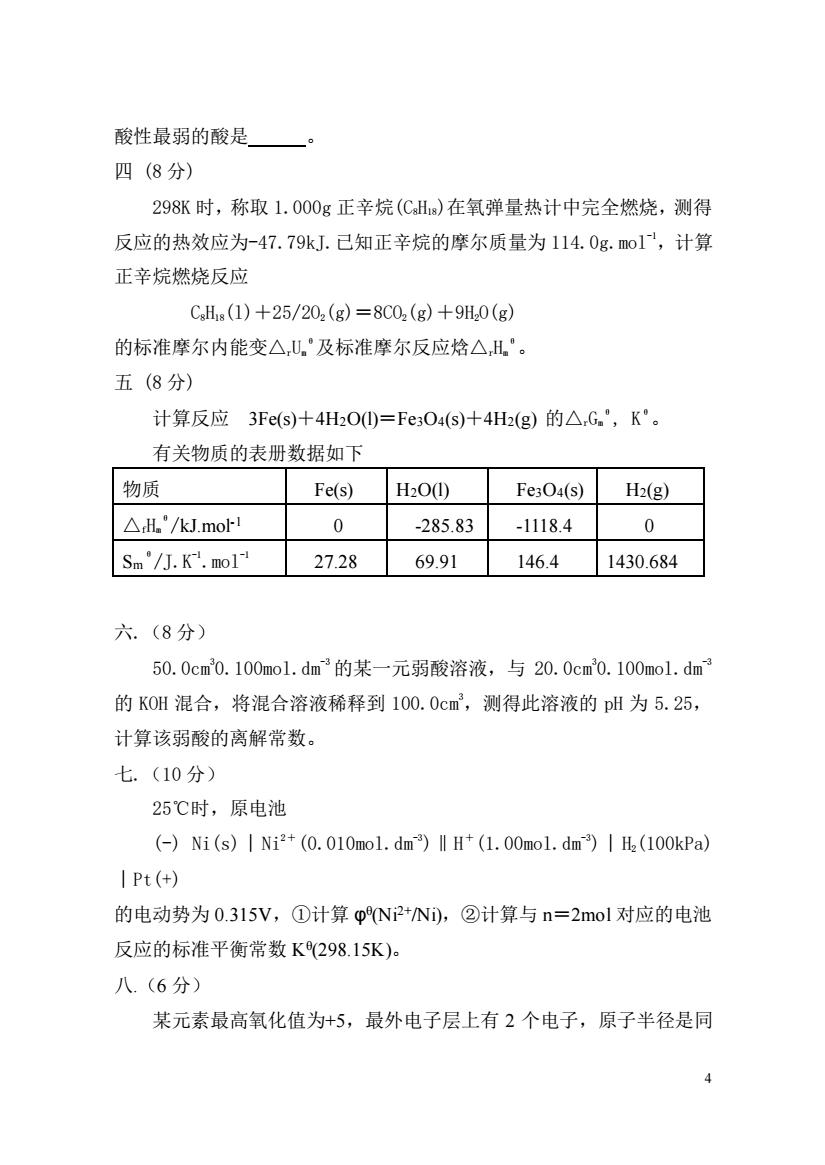
酸性最弱的酸是一。 四(8分) 298K时,称取1.000g正辛烷(CHa)在氧弹量热计中完全燃烧,测得 反应的热效应为-47.79kJ.己知正辛烷的摩尔质量为114.0g.mo,计算 正辛烷燃烧反应 CHs(1)+25/202(g)=8C02(g)+9H0(g) 的标准摩尔内能变△,山。"及标准摩尔反应焓△,H' 五(8分) 计算反应3Fc(s)+4H2O0=Fe3O4(s)十4H(g)的△.G,',K°。 有关物质的表册数据如下 物质 Fe(s) H2O(1) Fe3O4(s) H2(g) △L./k.mor 0 -285.83-1118.4 0 Sm'/J.K.mol- 27.28 69.91 146.4 1430.684 六.(8分) 50.0cm0.100mol.dm3的某一元弱酸溶液,与20.0cm0.100mol.dm 的KOH混合,将混合溶液稀释到100.0cm,测得此溶液的pH为5.25, 计算该弱酸的离解常数。 七.(10分) 25℃时,原电池 (-Ni(s)I Ni2*(0.010mol.dm)Il H*(1.00mol.dm)I H2(100kPa) IPt(+) 的电动势为0.315V,①计算pN2+ND,②计算与n=2mol对应的电池 反应的标准平衡常数K298.15K)。 八.(6分) 某元素最高氧化值为+5,最外电子层上有2个电子,原子半径是同 4
4 酸性最弱的酸是 。 四 (8 分) 298K 时,称取 1.000g 正辛烷(C8H18)在氧弹量热计中完全燃烧,测得 反应的热效应为-47.79kJ.已知正辛烷的摩尔质量为 114.0g.mol-1,计算 正辛烷燃烧反应 C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g) 的标准摩尔内能变△rUm θ及标准摩尔反应焓△rHm θ。 五 (8 分) 计算反应 3Fe(s)+4H2O(l)=Fe3O4(s)+4H2(g) 的△rGm θ , Kθ。 有关物质的表册数据如下 物质 Fe(s) H2O(l) Fe3O4(s) H2(g) △fHm θ /kJ.mol-1 0 -285.83 -1118.4 0 Sm θ /J.K-1 .mol-1 27.28 69.91 146.4 1430.684 六.(8 分) 50.0cm3 0.100mol.dm-3 的某一元弱酸溶液,与 20.0cm3 0.100mol.dm-3 的 KOH 混合,将混合溶液稀释到 100.0cm3,测得此溶液的 pH 为 5.25, 计算该弱酸的离解常数。 七.(10 分) 25℃时,原电池 (-) Ni(s)︱Ni2+ (0.010mol.dm-3 )‖H + (1.00mol.dm-3 )︱H2(100kPa) ︱Pt(+) 的电动势为 0.315V,①计算 φθ (Ni2+/Ni),②计算与 n=2mol 对应的电池 反应的标准平衡常数 Kθ (298.15K)。 八.(6 分) 某元素最高氧化值为+5,最外电子层上有 2 个电子,原子半径是同

族中最小的。 ①该元素是何种元素?写出它的电子分布式。 ②该元素+3价的离子有几个未成对电子? ③该元素氧化值+2及+5的氧化物的水化物呈酸性还是碱性?写出相应 的化学式
5 族中最小的。 ① 该元素是何种元素?写出它的电子分布式。 ② 该元素+3 价的离子有几个未成对电子? ③ 该元素氧化值+2 及+5 的氧化物的水化物呈酸性还是碱性?写出相应 的化学式